0% encontró este documento útil (0 votos)
709 vistas4 páginasTincion de Gram
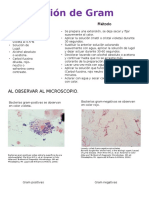
La tinción de Gram es una tinción diferencial que clasifica bacterias en Gram positivas y Gram negativas dependiendo de la composición de su pared celular. Se basa en que las bacterias Gram positivas tienen una pared celular gruesa rica en peptidoglicano que retiene el colorante cristal violeta después del proceso de decoloración, mientras que las bacterias Gram negativas tienen menos peptidoglicano y su colorante se decolora, tiñéndose luego con la safranina. Esta tinción es una herramienta útil en microbiología
Cargado por
Locoto KushDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
709 vistas4 páginasTincion de Gram
La tinción de Gram es una tinción diferencial que clasifica bacterias en Gram positivas y Gram negativas dependiendo de la composición de su pared celular. Se basa en que las bacterias Gram positivas tienen una pared celular gruesa rica en peptidoglicano que retiene el colorante cristal violeta después del proceso de decoloración, mientras que las bacterias Gram negativas tienen menos peptidoglicano y su colorante se decolora, tiñéndose luego con la safranina. Esta tinción es una herramienta útil en microbiología
Cargado por
Locoto KushDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd