Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Teorías Ácido-Base
Teorías Ácido-Base
Cargado por
Jenaro BarreraDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Teorías Ácido-Base
Teorías Ácido-Base
Cargado por
Jenaro BarreraCopyright:
Formatos disponibles
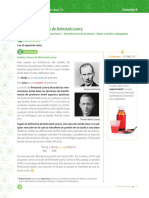
Teorías ARRHENIUS BRONSTED-LOWRY G.N.
LEWIS
Definición Definición Definición
En 1884, el químico sueco Svante En 1923 el científico danés J.N. En 1993 un químico americano
ÁCIDO Arrhenius llego a la conclusión de
que los ácidos son sustancias que
Bronsted y el científico inglés T.M.
Lowry propusieron cada uno por
Gilbert Newton Lewis definió a
un ácido como una sustancia
al ionizarse en solución acuosa separado los nuevos conceptos para capaz de aceptar un par de
producen iones de hidrogeno estas sustancias. Ellos indicaron que electrones.
(H+). un ácido es una sustancia capaz de
ceder o donar un protón.
Ejemplo de reacción Ejemplo de reacción Ejemplo de reacción
HCl H+ + Cl- HCl(g) + H2O(l) H3O+(ac) + Cl-(ac) BF3 + NH3 F3BNH3
Ácido Clorhídrico Ion Ion Cloruro de Agua ion hidronio ion cloruro Trifluoruro amoniaco complejo
Hidrógeno
Hidrógeno Cloruro
Definición Definición Definición
En 1884, el químico sueco Svante En 1923 el científico danés J.N. En 1993 un químico americano
BASE Arrhenius llego a la conclusión de
que las bases son sustancias que
Bronsted y el científico inglés T.M.
Lowry propusieron cada uno por
Gilbert Newton Lewis definió a
una base como una sustancia
al ionizarse en solución acuosa separado los nuevos conceptos para capaz de donar un par de
liberan iones hidróxido (OH-). estas sustancias. Ellos indicaron que electrones.
una base es una sustancia capaz de
aceptar un protón en una reacción
química.
Ejemplo de reacción Ejemplo de reacción Ejemplo de reacción
NaOH OH- + Na+ H3O+(ac) + Cl-(ac) HCl(g) + H2O(l)
Hidróxido Ion Ion
de sodio Hidróxido Sodio
También podría gustarte
- Tarea XI QUIMICA ....Documento10 páginasTarea XI QUIMICA ....gladys castillo0% (2)
- Practica 8 FMDocumento5 páginasPractica 8 FMALBERTO SAMPAYOAún no hay calificaciones
- Muestra Tema 55Documento5 páginasMuestra Tema 55LngAún no hay calificaciones
- Historia Acidos BasesDocumento11 páginasHistoria Acidos BasesFaby AlbisturAún no hay calificaciones
- Informe Formacion de HalurosDocumento6 páginasInforme Formacion de HalurosCatty DelgadoAún no hay calificaciones
- Yacimientos MagmaticosDocumento20 páginasYacimientos MagmaticosEdwin AguilarAún no hay calificaciones
- Resumen Acido BaseDocumento4 páginasResumen Acido BaseKimberly JulcaAún no hay calificaciones
- ¿Qué Aprendí? Ácidos y BasesDocumento2 páginas¿Qué Aprendí? Ácidos y BasesJeffrey EnriqueAún no hay calificaciones
- Exposición Química Orgánica 1Documento20 páginasExposición Química Orgánica 1Mauro CastilloAún no hay calificaciones
- Ácidos BasesDocumento3 páginasÁcidos Basesangel millingalleAún no hay calificaciones
- AcidosybasesDocumento5 páginasAcidosybasesNery AmairaniAún no hay calificaciones
- UNIDAD 1 Reacciones Ácido Base.Documento5 páginasUNIDAD 1 Reacciones Ácido Base.Javier Ignacio Cruces MuñozAún no hay calificaciones
- Ácidos y Bases Según Arrhenius y Según Bronstde-LowryDocumento10 páginasÁcidos y Bases Según Arrhenius y Según Bronstde-LowryChristian RestrepoAún no hay calificaciones
- Acidez y Alcalinidad de Las Soluciones e Importancia de Estas en La VidaDocumento9 páginasAcidez y Alcalinidad de Las Soluciones e Importancia de Estas en La VidaalvaroAún no hay calificaciones
- QuimicaDocumento6 páginasQuimicaKarina MontesAún no hay calificaciones
- Acido BaseDocumento20 páginasAcido BaseSofia Dominguez VenezianAún no hay calificaciones
- Definicion Acido BaseDocumento5 páginasDefinicion Acido BaseangelAún no hay calificaciones
- Teorías de Ácidos y BasesDocumento12 páginasTeorías de Ácidos y BasesTaily ZuaresAún no hay calificaciones
- CUESTIONARIO-Acido BaseDocumento5 páginasCUESTIONARIO-Acido BaseLazo DayelyAún no hay calificaciones
- Cuadro Comparativo. Teorías Acido BaseDocumento4 páginasCuadro Comparativo. Teorías Acido BasedeysiAún no hay calificaciones
- Naturaleza de Ácidos y Bases. Arrhenius, Bronsted-Lowry, Lewis. 2023Documento30 páginasNaturaleza de Ácidos y Bases. Arrhenius, Bronsted-Lowry, Lewis. 2023Jessica Astrid Reyes Del cidAún no hay calificaciones
- Teoría de ArrheniusDocumento3 páginasTeoría de ArrheniusEmerson Jianpiere Diaz AvellanedaAún no hay calificaciones
- Teorías de Ácidos y BasesDocumento3 páginasTeorías de Ácidos y BasesBillaine Ciprian.Aún no hay calificaciones
- Investigación Teoría Ácido - Base de Bronsted-Lowry y Ecuación de Henderson-Hasselbalch. Balam Hau Sergio AdrianDocumento12 páginasInvestigación Teoría Ácido - Base de Bronsted-Lowry y Ecuación de Henderson-Hasselbalch. Balam Hau Sergio AdrianSergio Adrian Balam HauAún no hay calificaciones
- TEORÍAS - Ácido BaseDocumento4 páginasTEORÍAS - Ácido BaseAstrid Quiroz ValladaresAún no hay calificaciones
- Teoría de Ácidos y Bases de ArrheniusDocumento9 páginasTeoría de Ácidos y Bases de ArrheniusGuillermo GarciaAún no hay calificaciones
- Acidos BasesDocumento18 páginasAcidos BasesEliana DelgadilloAún no hay calificaciones
- Teoria de Acidos y Bases PDFDocumento5 páginasTeoria de Acidos y Bases PDFRoberto SantiagoAún no hay calificaciones
- PHDocumento4 páginasPHEleanta GarciaAún no hay calificaciones
- Racc Ev3 FQDocumento10 páginasRacc Ev3 FQRamiro Andres Corpus CoronadoAún no hay calificaciones
- Teoria Ácido Base BioanálisisDocumento17 páginasTeoria Ácido Base BioanálisisKevin LoboAún no hay calificaciones
- HIDROGENODocumento2 páginasHIDROGENODieter OrellanaAún no hay calificaciones
- Informe Laboratorio de Bioquimica N 1Documento32 páginasInforme Laboratorio de Bioquimica N 1Anyi RomeroAún no hay calificaciones
- VHJ Ar E3s1 FqeDocumento6 páginasVHJ Ar E3s1 FqeLizeth Hernandez JuarezAún no hay calificaciones
- Acido-Base. Ing EugeniaToral SosaDocumento31 páginasAcido-Base. Ing EugeniaToral Sosadeliana claret crespo araujoAún no hay calificaciones
- HIDROGENODocumento2 páginasHIDROGENOAlexander Rojas Carrillo100% (1)
- Cuadro Comparativo Teorias Ácido-BaseDocumento2 páginasCuadro Comparativo Teorias Ácido-BaseJairo Cuervo Gámez75% (4)
- Informe Laboratorio de Bioquímica N-1Documento30 páginasInforme Laboratorio de Bioquímica N-1monique24060% (1)
- Teoria Diapositivas Concepto Ácido y BaseDocumento10 páginasTeoria Diapositivas Concepto Ácido y BaseJose Manuel Mejia CañasAún no hay calificaciones
- Ácidos y BasesDocumento3 páginasÁcidos y BasesAlondra Aguirre GonzálezAún no hay calificaciones
- Teoria Acido Base G1QADocumento19 páginasTeoria Acido Base G1QAAnthony ChiliquingaAún no hay calificaciones
- U9 - 2023-1C - Equilibrio Ácido-Base - BAtAlPOFDocumento32 páginasU9 - 2023-1C - Equilibrio Ácido-Base - BAtAlPOFmelulacontentaAún no hay calificaciones
- Guia Tercero Medio Química Electivo N 42Documento5 páginasGuia Tercero Medio Química Electivo N 42CarlosAún no hay calificaciones
- Unidad 2 - Ácidos y BasesDocumento7 páginasUnidad 2 - Ácidos y BasesJorge Blas Ramírez GonzálezAún no hay calificaciones
- AcidosBases1 (1802)Documento5 páginasAcidosBases1 (1802)Leticia FoncubiertaAún no hay calificaciones
- Acidos y BasesDocumento19 páginasAcidos y BasesAna Cristina Romero Guerra100% (1)
- Acidos y Bases MapaDocumento1 páginaAcidos y Bases MapaMia Lopez100% (1)
- Teoría de Ácidos y Bases de Svante August ArrheniusDocumento14 páginasTeoría de Ácidos y Bases de Svante August ArrheniusJenny LetterniAún no hay calificaciones
- Teoria Acido BaseDocumento6 páginasTeoria Acido Basenelson becerraAún no hay calificaciones
- RUTA #1 Acidos y BasesDocumento6 páginasRUTA #1 Acidos y BasesYoleth Patricia Ramos CaballeroAún no hay calificaciones
- Acido - BaseDocumento3 páginasAcido - BaseMarianAún no hay calificaciones
- Acido Base1 PDFDocumento9 páginasAcido Base1 PDFGreca AMAún no hay calificaciones
- Acidos y Bases 9° Colombia Aprende PDFDocumento12 páginasAcidos y Bases 9° Colombia Aprende PDFDiana Del Pilar Chaustre DuranAún no hay calificaciones
- INFORME ACADÉMIC ResumenesDocumento17 páginasINFORME ACADÉMIC ResumenesSthreisy Espinoza durandAún no hay calificaciones
- Acidos y BasesDocumento9 páginasAcidos y Basesluisgerardo94Aún no hay calificaciones
- Tema 7 - QuimicaDocumento58 páginasTema 7 - QuimicartAún no hay calificaciones
- Actividad Integradora 1. El PH en La Vida CotidianaDocumento6 páginasActividad Integradora 1. El PH en La Vida CotidianaJuan De Dios AlvarafoAún no hay calificaciones
- Guia Acidos y Bases RenovadosDocumento9 páginasGuia Acidos y Bases RenovadosFelipe Alejandro JaraAún no hay calificaciones
- Sintesis Del AcidoDocumento2 páginasSintesis Del AcidoAna MendezAún no hay calificaciones
- Teoria de Lewis Sobre Los Acidos y BasesDocumento5 páginasTeoria de Lewis Sobre Los Acidos y BasesFer Jimenez FigueroaAún no hay calificaciones
- Equilibrio Ionico Primera ParteDocumento21 páginasEquilibrio Ionico Primera ParteIngrid PolliAún no hay calificaciones
- Teoria de Acidos y Bases-1Documento2 páginasTeoria de Acidos y Bases-1fjborges26Aún no hay calificaciones
- Mapa Conceptual REGULACION ACIDO BASEDocumento2 páginasMapa Conceptual REGULACION ACIDO BASEItzayana Dominguez100% (2)
- Pia BMDocumento7 páginasPia BMMaryjosse Cisneros GarzaAún no hay calificaciones
- FQ2eso T6 EnergiaDocumento12 páginasFQ2eso T6 EnergiaAlicia Suárez BerzalAún no hay calificaciones
- Laboratorio 10 Intercambiadores de CalorDocumento15 páginasLaboratorio 10 Intercambiadores de CalorMiguel FloresAún no hay calificaciones
- Elementos NativosDocumento5 páginasElementos NativosWilliam David Caballero SalazarAún no hay calificaciones
- QuimicaDocumento6 páginasQuimicaluis eduardoAún no hay calificaciones
- La AtmósferaDocumento15 páginasLa AtmósferaKATHERINE GUISSELA SARAGURO CALLEAún no hay calificaciones
- ARROZDocumento21 páginasARROZAlexis Macías HolguínAún no hay calificaciones
- Informe de Laboratorio FISICA II - 2Documento9 páginasInforme de Laboratorio FISICA II - 2Jeova MachacaAún no hay calificaciones
- TEXTO EN ESPAÑOL TCHOBANOGLOUS 2003 - p1Documento13 páginasTEXTO EN ESPAÑOL TCHOBANOGLOUS 2003 - p1CHRISTIAN ANDRES GOYES QUETAMAAún no hay calificaciones
- Proyecto 4 Semana 3 QuímicaDocumento11 páginasProyecto 4 Semana 3 QuímicaLuis IntriagoAún no hay calificaciones
- Como Hacer Emplames Electricos Super ResistenteDocumento14 páginasComo Hacer Emplames Electricos Super ResistenteFernando EscalanteAún no hay calificaciones
- Monografia-Polímeros ConductoresDocumento37 páginasMonografia-Polímeros ConductoresAntonio David Torres JimenezAún no hay calificaciones
- El Período de Un Movimiento Ondulatorio Que Se Propaga Por El Eje de Abscisas Es de 3Documento10 páginasEl Período de Un Movimiento Ondulatorio Que Se Propaga Por El Eje de Abscisas Es de 3waltercabezasrojasAún no hay calificaciones
- Reporte Flotación 1Documento21 páginasReporte Flotación 1Licario75Aún no hay calificaciones
- Guia Del RayoDocumento9 páginasGuia Del RayoDavid DavidAún no hay calificaciones
- Fisica Actividades I, Llly IVDocumento38 páginasFisica Actividades I, Llly IVSilvia Sánchez MonteroAún no hay calificaciones
- Reactivos QuimicosDocumento20 páginasReactivos QuimicosAndres R. Añez100% (1)
- Brunilda Heredia - Tipos de PisciculturaDocumento8 páginasBrunilda Heredia - Tipos de PisciculturaFisicultor100% (1)
- Segunda Ley de NewtonDocumento6 páginasSegunda Ley de NewtonMau SeBer100% (1)
- Laboratorio 1 Resuelto Fisica GeneralDocumento19 páginasLaboratorio 1 Resuelto Fisica GeneralFilander Garcia100% (1)
- Resumen Agua Fria y Caliente Instalaciones 1Documento24 páginasResumen Agua Fria y Caliente Instalaciones 1marAún no hay calificaciones
- Qca de Materiales - Soluciones Sólidas PDFDocumento27 páginasQca de Materiales - Soluciones Sólidas PDFAngélicaAún no hay calificaciones
- Analisis Proximos PDFDocumento8 páginasAnalisis Proximos PDFOscar SalazarAún no hay calificaciones
- Guía 5. Leyes de NewtonDocumento5 páginasGuía 5. Leyes de Newtonruth_barahonaAún no hay calificaciones
- Capitulo 3Documento5 páginasCapitulo 3Ricardo GonzalezAún no hay calificaciones
- Configuración ElectrónicaDocumento7 páginasConfiguración ElectrónicaRAMÍREZ FERNÁNDEZ CARLOS OMARAún no hay calificaciones