Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Determinacion de Fosforo
Determinacion de Fosforo
Cargado por
Rolando CuaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Determinacion de Fosforo
Determinacion de Fosforo
Cargado por
Rolando CuaCopyright:
Formatos disponibles
Cálculos:
17. Utilizar la curva de calibración para cuantificar el contenido de fósforo en la muestra.
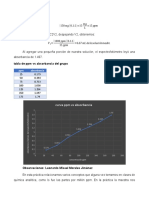
18. Graficar los valores de absorbancia contra concentración en ppm.
17.-
Los cálculos para cuantificar la presencia de fosforo en la muestra se derivan de la Ley de
Lambert-Beer: que establece que la absorbancia de una muestra es proporcional a la
concentración de la especie que absorbe la luz y a la longitud del camino óptico.
Expresandose como: Concentración de fosforo (mg/L) = (Absorbancia de la muestra /
Absorbancia de la solución estándar) x Concentración de fosforo en la solución estándar.
Con base en lo inferido a partir de la curva de calibración se decidió utilizar el punto en eje x
de 0.8 ppm.
Entonces:
Para la primera muestra: absorbancia de 0.307:
Concentración de fosforo en mg/L = (0.307 / 0.302) x 0.8 ppm = .813 mg/L
Para la segunda muestra (absorbancia de 0.336):
Concentración de fosforo en mg/L = (0.336 / 0.302) x 0.8 ppm = 0.890 mg/L
Resultados:
MUESTRA 01 CONCENTRACIÓN mg/L CONCENTRACIÓN ppm
0.307 .813 mg/L .813 ppm
0.336 0.890 mg/L 0.890 ppm
NOTA:
El espectrofotómetro Uv-vis con el que trabajamos realizó un cálculo automático de la
concentración directamente en ppm, el cual difiere de nuestra concentración calculada por el
procedimiento de Lambert-Beer.
MUESTRAS pmm
0.307 .805 ppm
0.336 .885 ppm
Calculo del espectrofotómetro de uv.
18.-
A.Curva de calibración
1
0.863
0.9
0.8 0.729
0.7
0.6
ABSORBANCIA
0.6
0.467
0.5
0.4
0.302
0.3
0.2 0.153
0.1
0
0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2
CONCENTRACIÓN ppm
A.-Curva de calibración de las soluciones estándar.
También podría gustarte
- Determinación de Hierro en Un MedicamentoDocumento6 páginasDeterminación de Hierro en Un MedicamentoMelissa OchoaAún no hay calificaciones
- Practica 2. Subsalicilato de BismutoDocumento9 páginasPractica 2. Subsalicilato de BismutoHumberto SánchezAún no hay calificaciones
- Solucionario Segunda Práctica Calificada 2Documento7 páginasSolucionario Segunda Práctica Calificada 2Edgard Mendoza33% (3)
- Bca y Bradford (20096) PDFDocumento20 páginasBca y Bradford (20096) PDFKenia VilchisAún no hay calificaciones
- Informe 6 FOTOCOLORIMETRIADocumento9 páginasInforme 6 FOTOCOLORIMETRIANathaly FalconíAún no hay calificaciones
- Lab Analisis FosforoDocumento4 páginasLab Analisis Fosforojamop7Aún no hay calificaciones
- Determinación de Colorantes en Bebidas GaseosasDocumento6 páginasDeterminación de Colorantes en Bebidas GaseosasMelissa OchoaAún no hay calificaciones
- Informe I FaseDocumento35 páginasInforme I FaseFabiola DiazAún no hay calificaciones
- 2 Seleccion de Longitud de OndaDocumento6 páginas2 Seleccion de Longitud de OndaWilliam Huaman VigilAún no hay calificaciones
- Prácticas de Laboratorio (Espectrofotometria)Documento12 páginasPrácticas de Laboratorio (Espectrofotometria)Guillermo Javier Alonso Trujillo100% (1)
- Informe 1Documento12 páginasInforme 1ZENAIDA ALEXANDRA CCAMA CCAHUANAAún no hay calificaciones
- Práctica - Control de Calidad Instrumental// Análisis InstrumentalDocumento10 páginasPráctica - Control de Calidad Instrumental// Análisis InstrumentalRosmaira MartínezAún no hay calificaciones
- Informe ESPECTROFOTOMETRIADocumento6 páginasInforme ESPECTROFOTOMETRIAPaula Rincon TorresAún no hay calificaciones
- Reporte de Práctica de LabDocumento11 páginasReporte de Práctica de LabLuis Aurelio Galván MauricioAún no hay calificaciones
- Rojas Lab N°7Documento12 páginasRojas Lab N°7Elizabeth VelasquezAún no hay calificaciones
- Analisis InstrumentalDocumento15 páginasAnalisis InstrumentalEdu ChavarriaAún no hay calificaciones
- Informe Determinación de Fosforo Por Espectrofotometría Visible Método Del Cloruro EstañosoDocumento7 páginasInforme Determinación de Fosforo Por Espectrofotometría Visible Método Del Cloruro EstañosoJuan David López QuinteroAún no hay calificaciones
- MSCC QA - Tratamiento Estadístico de ErroresDocumento14 páginasMSCC QA - Tratamiento Estadístico de ErroresKat RoblesAún no hay calificaciones
- Determinación de Ácido Acetil Salicílico - InformeDocumento9 páginasDeterminación de Ácido Acetil Salicílico - InformePaola Brito SierraAún no hay calificaciones
- Determinación de NitritosDocumento7 páginasDeterminación de NitritosLaura RomeroAún no hay calificaciones
- Informe de EspectrosDocumento5 páginasInforme de Espectrosbelkys del valleAún no hay calificaciones
- E1P5L1013Documento14 páginasE1P5L1013Monserrat Hernandez100% (1)
- Practica 2Documento7 páginasPractica 2Alberto OlveraAún no hay calificaciones
- Informe Práctica 2 Ley de Beer-LambertDocumento7 páginasInforme Práctica 2 Ley de Beer-LambertSebas SalazarAún no hay calificaciones
- Reporte 2 Fosfato 2Documento5 páginasReporte 2 Fosfato 2scarlett salasAún no hay calificaciones
- Informe 1. EspectrofotometriaDocumento6 páginasInforme 1. EspectrofotometriaAlexa LópezAún no hay calificaciones
- 5101b92aa5673REPORTE 1Documento10 páginas5101b92aa5673REPORTE 1JuniorMendivilMirandaAún no hay calificaciones
- Curvas de CalibraciónDocumento3 páginasCurvas de CalibraciónMilagros Berenice Toga MedinaAún no hay calificaciones
- DETERMINACION ESPECTROFOTOMETRICA DE Fe (II)Documento10 páginasDETERMINACION ESPECTROFOTOMETRICA DE Fe (II)EMERSONAún no hay calificaciones
- Informe 3. AnaliticaDocumento11 páginasInforme 3. AnaliticaBrenda KarenAún no hay calificaciones
- NitratosDocumento5 páginasNitratosANTHONY PERCY INGA HUANCAAún no hay calificaciones
- Laboratorio Nro 5Documento8 páginasLaboratorio Nro 5Zayume GonzalesAún no hay calificaciones
- Evaluación Del Cumplimiento de La Ley de BeerDocumento13 páginasEvaluación Del Cumplimiento de La Ley de BeerMariAún no hay calificaciones
- AAS Ejercicios S1 2021Documento7 páginasAAS Ejercicios S1 2021Tatiana RodríguezAún no hay calificaciones
- Reporte 2Documento4 páginasReporte 2Yoselin SantiagoAún no hay calificaciones
- Informe Calibracion - G3Documento7 páginasInforme Calibracion - G3Mauricio FariasAún no hay calificaciones
- Determinación de ManganesoDocumento4 páginasDeterminación de ManganesoWendy Callata Z.Aún no hay calificaciones
- Det. de Prot. Biuret+LowryDocumento7 páginasDet. de Prot. Biuret+LowryKatibel GraellAún no hay calificaciones
- TP Fosforo - CalculosDocumento4 páginasTP Fosforo - CalculosNahuel PérezAún no hay calificaciones
- Hierro DiegoDocumento10 páginasHierro Diegoharold diazAún no hay calificaciones
- Informe 4Documento8 páginasInforme 4prissAún no hay calificaciones
- Eercicios AASDocumento18 páginasEercicios AASAbel PachecoAún no hay calificaciones
- Practica 2 Determinacion de CafeinaDocumento11 páginasPractica 2 Determinacion de Cafeinapaulina zamudioAún no hay calificaciones
- PRACTICA No 09 ESPECTROFOTOMETRIADocumento12 páginasPRACTICA No 09 ESPECTROFOTOMETRIAJuan Carlos Castillo ZamoraAún no hay calificaciones
- 10mo PRÁCTICA ANALISIS QUIMICODocumento6 páginas10mo PRÁCTICA ANALISIS QUIMICOCintbya Ccencho GaribayAún no hay calificaciones
- Anexo de ObservacionesDocumento4 páginasAnexo de ObservacionesOscar UrielAún no hay calificaciones
- Ejemplos de Curvas de CalibraciónDocumento2 páginasEjemplos de Curvas de CalibraciónMilagros Berenice Toga MedinaAún no hay calificaciones
- INFORME COLORANTES Semestre 2020Documento5 páginasINFORME COLORANTES Semestre 2020HERNANDO ESTEBAN ROLDÁN ESCUDEROAún no hay calificaciones
- DETERMINACION DE HIERRO EN MEDICAMENTOS Final PDFDocumento6 páginasDETERMINACION DE HIERRO EN MEDICAMENTOS Final PDFAndrea Arboleda MonsalveAún no hay calificaciones
- Solución de Problemas EUVDocumento4 páginasSolución de Problemas EUVAILED PAULINA VARGAS OROZCOAún no hay calificaciones
- Practica 5 Pka de Un IndicadorDocumento16 páginasPractica 5 Pka de Un IndicadorElihu EstradaAún no hay calificaciones
- Determinacion de Fosfatos en Cocacola y ColacaoDocumento99 páginasDeterminacion de Fosfatos en Cocacola y ColacaoJorge RamonAún no hay calificaciones
- Practica 5Documento6 páginasPractica 5TaTis CorReaAún no hay calificaciones
- Informe 3 QAIII Absorción Atómica BismutoDocumento13 páginasInforme 3 QAIII Absorción Atómica BismutoBrenda KarenAún no hay calificaciones
- Concentración de Na/Li, PPM I (Na) I (Li) I (Na) /I (Li)Documento7 páginasConcentración de Na/Li, PPM I (Na) I (Li) I (Na) /I (Li)Vannesa HernadezAún no hay calificaciones
- Informe 3Documento7 páginasInforme 3María Alejandra AtehortúaAún no hay calificaciones
- Informe Laboratorio 1A Grupo B 404 PDFDocumento4 páginasInforme Laboratorio 1A Grupo B 404 PDFenyelAún no hay calificaciones
- Informe PHDocumento8 páginasInforme PHdaAún no hay calificaciones
- Practica 3 EspectrofotometroDocumento3 páginasPractica 3 EspectrofotometroJosue TellezAún no hay calificaciones
- Fotografía básica: Guía de bolsillo (Basic Photography: Pocket Guide): Fundamentos de la exposición, ajustes de cámara, información sobre el objetivo, consejos clave de composición y escenarios fotográficos (Exposure Basics, Camera Settings, Lens Info, Compositiong Tips, and Shooting Scenarios)De EverandFotografía básica: Guía de bolsillo (Basic Photography: Pocket Guide): Fundamentos de la exposición, ajustes de cámara, información sobre el objetivo, consejos clave de composición y escenarios fotográficos (Exposure Basics, Camera Settings, Lens Info, Compositiong Tips, and Shooting Scenarios)Aún no hay calificaciones
- Protocolo Fe en Tabletas 2023 PDFDocumento3 páginasProtocolo Fe en Tabletas 2023 PDFRolando CuaAún no hay calificaciones
- InsulinosensibilizadoresDocumento11 páginasInsulinosensibilizadoresRolando CuaAún no hay calificaciones
- Ada3 FasDocumento4 páginasAda3 FasRolando CuaAún no hay calificaciones
- Ada1 Ensayo Cua CarlosDocumento6 páginasAda1 Ensayo Cua CarlosRolando CuaAún no hay calificaciones
- Ada1 BioenergeticaDocumento3 páginasAda1 BioenergeticaRolando CuaAún no hay calificaciones