Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Los Gases
Cargado por
Ñeca20090 calificaciones0% encontró este documento útil (0 votos)
24 vistas4 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
24 vistas4 páginasLos Gases
Cargado por
Ñeca2009Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 4
Física Aplicada (Física III) Undécimo 11vo. Prof.
Edwin Avila
Los Gases
¿Qué son los gases?
Con el término gas nos referimos a uno de los tres principales estados de
agregación de la materia (junto a los líquidos y los sólidos). Se caracteriza por
la dispersión, fluidez y poca atracción entre sus partículas constitutivas.
×
Los gases son la forma más volátil de la materia en la naturaleza y son
sumamente comunes en la vida cotidiana. Así, cuando una sustancia se
encuentra en estado gaseoso solemos llamarla gas.
Las sustancias líquidas o sólidas pueden ser transformadas en gas utilizando
diferentes procesos. Esta transformación implica un cambio en las propiedades
físicas de las sustancias, como su estado de agregación. Sin embargo, no
cambian sus propiedades químicas, pues las sustancias siguen teniendo la
misma estructura química, es decir, no ocurren rupturas de enlaces químicos ni
se generan nuevas sustancias.
Los gases se encuentran en todas partes: desde la masa heterogénea de
gases que llamamos atmósfera y que respiramos como aire, hasta los gases
que se generan dentro del intestino, producto de la digestión y descomposición,
hasta los gases inflamables con que alimentamos nuestras cocinas y hornos.
Historia de los gases
La palabra gas fue inventada en el siglo XVII por el científico flamenco Jan
Baptista van Helmont, a partir del término latino chaos (“caos”).
Eligió el nombre por el aparente grado de desorden que exhiben
las moléculas de un gas. También se conocía a este estado como “estado
aeriforme”, pero este término quedó en desuso.
Las primeras leyes sobre el comportamiento de los gases fueron consecuencia
de su estudio intensivo a finales del mismo siglo, en especial de sus relaciones
entre presión, temperatura y volumen.
Tipos de gases
Los gases pueden clasificarse según su naturaleza química en:
Combustibles o inflamables. Aquellos que pueden arder, esto es,
generar reacciones explosivas o exotérmicas en presencia
del oxígeno u otros oxidantes.
Corrosivos. Aquellos que, al entrar en contacto con otras
sustancias, las someten a procesos de reducción u oxidación
intensos, generando daños en su superficie o heridas en caso de ser
materia orgánica.
Comburentes. Aquellos que permiten mantener viva una llama o una
reacción inflamable, ya que inducen la combustión en otras
sustancias.
Tóxicos. Aquellos que representan un peligro para la salud por las
reacciones que introducen en el cuerpo de los seres vivos, como los
gases radiactivos.
Inertes o nobles. Aquellos que presentan poca o nula reactividad,
excepto en situaciones y condiciones determinadas.
Propiedades de los gases
Los gases pueden comprimirse al aplicarles presión.
Los gases presentan las siguientes propiedades:
No tienen volumen propio. Ocupan el volumen del contenedor en el
que se encuentren.
No tienen forma propia. También asumen la de su contenedor.
Pueden dilatarse y contraerse. Al igual que los sólidos y los
líquidos, los gases se dilatan si se les aumenta su temperatura, y se
contraen si se enfrían.
Tienen gran fluidez. Los gases fluyen mucho más que los líquidos
debido a que sus partículas tienen menor interacción. Pueden
fácilmente desplazarse a través de un orificio de un recipiente a otro.
Tienen alta difusión. Los gases pueden mezclarse fácilmente entre
sí debido al gran movimiento que tienen sus partículas.
Solubilidad. Los gases pueden ser solubles en agua o en otros
líquidos.
Se pueden comprimir. Aplicando presión a un gas, se puede lograr
que sus partículas estén más juntas, es decir, se comprime el gas.
Cambios de estados de los gases
El hielo seco es un ejemplo de sublimación.
Sublimación. Es un proceso físico de cambio de fase, que permite
convertir un sólido en un gas directamente, sin pasar primero por una
etapa líquida. Este proceso es poco común y suele involucrar
condiciones puntuales de presión y de temperatura. Podemos
observarlo en el hielo seco (o hielo de ) a temperatura ambiente: el
bloque sólido desprende un leve vapor que es la sustancia
recuperando su estado gaseoso original.
Ebullición. Es el proceso mediante el cual un líquido se transforma
en gas. Ocurre cuando toda la masa del líquido se calienta a una
temperatura igual a su punto de ebullición.
Evaporación. Es un proceso de cambio de fase sumamente común,
que conduce a un líquido a convertirse en gas cuando se aumenta la
temperatura del líquido. Ocurre de manera lenta y gradual. La
ponemos en práctica por ejemplo, en la ducha cuando el agua muy
caliente se convierte en vapor observable como una nube
blanquecina.
Condensación. Es el proceso opuesto a la evaporación, esto es, un
proceso de cambio de fase que conduce del estado gaseoso al
líquido, debido a la pérdida de energía calórica. Esta energía perdida
hace que las partículas del gas vibren más despacio, lo que les
permite aproximarse e interactuar más estrechamente, como ocurre
sobre un vidrio frío en día lluvioso, o sobre las plantas y otras
superficies con el rocío.
Los gases pueden volverse líquidos debido a la pérdida de energía calórica.
Sublimación inversa. Es el camino opuesto de la sublimación, o
sea, el paso del estado gaseoso al estado sólido sin pasar primero
por un momento de liquidez. Este proceso requiere de condiciones
de presión y temperatura muy específicas.
Ejemplos de gases
El metano es uno de los componentes del gas usado en los hogares.
Algunos ejemplos de gases son:
Hidrógeno (H2). Es el gas diatómico más común del universo entero.
Helio (He). Insípido, incoloro e inerte, es el menos soluble en agua
de todos los gases.
Metano (CH4). Es un hidrocarburo gaseoso de olor desagradable que
se obtiene como producto de la descomposición de la materia
orgánica.
Aire. Es la mezcla heterogénea de hidrógeno, nitrógeno, oxígeno,
argón y otros gases que respiramos los seres vivos.
También podría gustarte
- Qué Son Los GasesDocumento11 páginasQué Son Los GasesArnold Castaño LariosAún no hay calificaciones
- LECTURA Ndeg1 EL ESTADO GASEOSO Y SUS CARACTERISTICASDocumento5 páginasLECTURA Ndeg1 EL ESTADO GASEOSO Y SUS CARACTERISTICASIdzayana AguirreAún no hay calificaciones
- Taller 3 Noveno Grado QuimicaDocumento4 páginasTaller 3 Noveno Grado QuimicaLuisa BallesterosAún no hay calificaciones
- Propiedades Del Estado GaseosoDocumento15 páginasPropiedades Del Estado Gaseosoalvaro alvarez palaciosAún no hay calificaciones
- Propiedades de Los GasesDocumento16 páginasPropiedades de Los GasesMiguel Barcos RangelAún no hay calificaciones
- Resumen Taller IDocumento110 páginasResumen Taller IFaba CastroAún no hay calificaciones
- Qué Son Los GasesDocumento1 páginaQué Son Los Gasescarlos garciaAún no hay calificaciones
- Seguridad en La Industria Del Gas: DiplomaturaDocumento34 páginasSeguridad en La Industria Del Gas: DiplomaturaPedro AgestaAún no hay calificaciones
- Estado GaseosoDocumento5 páginasEstado GaseosoIVAN JORA COLQUEAún no hay calificaciones
- Ciencias Naturales 7mo Y 8voDocumento78 páginasCiencias Naturales 7mo Y 8voLa Contadora De HistoriasAún no hay calificaciones
- Clase 5. Propiedades de Los GasesDocumento12 páginasClase 5. Propiedades de Los GasesCristian MoraAún no hay calificaciones
- Significado de Estado GaseosoDocumento6 páginasSignificado de Estado GaseosojosetecoAún no hay calificaciones
- Guia Quimica 4to Año Actividad 5 3er Lapso Estado Gaseoso de La MateriaDocumento9 páginasGuia Quimica 4to Año Actividad 5 3er Lapso Estado Gaseoso de La MateriaJose GarciaAún no hay calificaciones
- Monserrath Gonzalez BarraganDocumento8 páginasMonserrath Gonzalez BarraganMONSERRATH GONZALEZ BARRAGANAún no hay calificaciones
- Estados de Agregación y FénomenosDocumento5 páginasEstados de Agregación y FénomenosSantiago RubioAún no hay calificaciones
- Química EECTRODocumento11 páginasQuímica EECTROtordomusico7Aún no hay calificaciones
- Estados de La MateriaDocumento7 páginasEstados de La MateriaHombre OceanoAún no hay calificaciones
- Trabajo de Química-2Documento17 páginasTrabajo de Química-2Yeison Armando Bravo BravoAún no hay calificaciones
- Propiedades de Los Gases 7º CienciasDocumento15 páginasPropiedades de Los Gases 7º CienciasCas de DuranAún no hay calificaciones
- Evaluación para QuímicaDocumento6 páginasEvaluación para QuímicarodrigoAún no hay calificaciones
- Taller de QuimicaDocumento8 páginasTaller de QuimicaEstefani LiceaAún no hay calificaciones
- Laboratorio #11 Dulce Mishell Dominguez HernándezDocumento15 páginasLaboratorio #11 Dulce Mishell Dominguez Hernándezdulce22003Aún no hay calificaciones
- Ciencias Naturales Propiedades de Los GasesDocumento2 páginasCiencias Naturales Propiedades de Los GasesViviana VidalAún no hay calificaciones
- Tarea 1 Secuencia 2 130773Documento10 páginasTarea 1 Secuencia 2 130773Maajis GuzmannAún no hay calificaciones
- QUÍMICADocumento19 páginasQUÍMICAJohan Mateo Alvarez GarzonAún no hay calificaciones
- Clase 1Documento4 páginasClase 1Marilina MarinAún no hay calificaciones
- Estado GaseosoDocumento11 páginasEstado GaseosoPaolin Martino100% (3)
- Agua 2Documento4 páginasAgua 2Edinson AsAún no hay calificaciones
- Taller 2 Materia y Energía Quimica Inorganica 10 PDFDocumento4 páginasTaller 2 Materia y Energía Quimica Inorganica 10 PDFSamuel ContrerasAún no hay calificaciones
- TP 1 Mat - Sist MatDocumento15 páginasTP 1 Mat - Sist MatYamila FiorinoAún no hay calificaciones
- Trabajo de Investigación. Juárez RamírezDocumento26 páginasTrabajo de Investigación. Juárez RamírezSaiki OwOAún no hay calificaciones
- Guia No. 10 de Quimica Ciclo 5Documento5 páginasGuia No. 10 de Quimica Ciclo 5JuanC.RomeroAún no hay calificaciones
- ACt 2.2QUIMICADocumento3 páginasACt 2.2QUIMICAMaryAún no hay calificaciones
- Mezclas Homogeneas y Heterogeneas.Documento5 páginasMezclas Homogeneas y Heterogeneas.coquicero0% (3)
- Comportamiento de Los GasesDocumento5 páginasComportamiento de Los GasesDaniel AdrianAún no hay calificaciones
- Soluciones Parte I 2020 2Documento13 páginasSoluciones Parte I 2020 2Liliana OlazarAún no hay calificaciones
- FISICOQUÍMICA Primera ParteDocumento6 páginasFISICOQUÍMICA Primera ParteFederico Agustín CastroAún no hay calificaciones
- Termodinamica Sustancia Pura TrabajoDocumento9 páginasTermodinamica Sustancia Pura TrabajoLuisangela MillanAún no hay calificaciones
- Característica de La Materia SolidaDocumento14 páginasCaracterística de La Materia SolidaPde Empalme GuayasAún no hay calificaciones
- El GasDocumento10 páginasEl GasCamila TorresAún no hay calificaciones
- Qué Es Estado GaseosoDocumento6 páginasQué Es Estado Gaseosojean carlos canales brunoAún no hay calificaciones
- Los GasesDocumento4 páginasLos GasesDiego Armando Bueno FuentesAún no hay calificaciones
- Propiedades Del Vapor, Aire y Gas.Documento18 páginasPropiedades Del Vapor, Aire y Gas.Eber Wilson Alvarez CcahuaAún no hay calificaciones
- Estado GaseosoDocumento27 páginasEstado Gaseosoomar kanaAún no hay calificaciones
- Estados de La Materia Incluye PlasmaDocumento12 páginasEstados de La Materia Incluye PlasmaCamilaa AndreaAún no hay calificaciones
- TAREA DE LA MateriaDocumento6 páginasTAREA DE LA MateriaSugey GlezAún no hay calificaciones
- Terminos en Quimica IDocumento4 páginasTerminos en Quimica IOscar Paul Seclén LeonardoAún no hay calificaciones
- MateriaDocumento2 páginasMateriaMINGO Y MARYAún no hay calificaciones
- Propiedades de La Materia y Tabla PeriódicaDocumento5 páginasPropiedades de La Materia y Tabla Periódicafolder plcAún no hay calificaciones
- Taller de Superación 5°2023Documento4 páginasTaller de Superación 5°2023ani alexandra mayor cardonaAún no hay calificaciones
- Taller de GasesDocumento13 páginasTaller de GasesSteven CastañedaAún no hay calificaciones
- Prepare El Eje de Los Seres Vivos Unidad Interrelaciones y CambiosDocumento3 páginasPrepare El Eje de Los Seres Vivos Unidad Interrelaciones y CambiosPatri SaucedoAún no hay calificaciones
- MONOCHUMPI Cambios FisicoquímicosDocumento8 páginasMONOCHUMPI Cambios FisicoquímicosAlbert FlorezAún no hay calificaciones
- Transporte de Solidos Por FluidosDocumento7 páginasTransporte de Solidos Por FluidoscarlosAún no hay calificaciones
- INFORME de Laboratorio 1Documento4 páginasINFORME de Laboratorio 1ERWIN IVAN PONGO BECERRAAún no hay calificaciones
- Estados de La MateriaDocumento6 páginasEstados de La MateriaCexarKentHurtadoAún no hay calificaciones
- Ciclos de La MateriaDocumento4 páginasCiclos de La MateriaAvi Tziboy ArchilaAún no hay calificaciones
- 9 Cambios de Estado, Leyes de GasesDocumento6 páginas9 Cambios de Estado, Leyes de Gasesmiriammedina344Aún no hay calificaciones
- Estados y Cambios de La MateriaDocumento2 páginasEstados y Cambios de La Materiala chefcita daniela0% (1)
- Gobierno Estudiantil 2024 GrandeDocumento1 páginaGobierno Estudiantil 2024 GrandeÑeca2009Aún no hay calificaciones
- Unidad No. 21Documento3 páginasUnidad No. 21Ñeca2009Aún no hay calificaciones
- ClimatologíaDocumento6 páginasClimatologíaÑeca2009Aún no hay calificaciones
- Parte Mensual ABRIL 2024Documento2 páginasParte Mensual ABRIL 2024Ñeca2009Aún no hay calificaciones
- Exámen de Recuperación Física Aplicada (Física III)Documento1 páginaExámen de Recuperación Física Aplicada (Física III)Ñeca2009Aún no hay calificaciones
- Rúbrica de Evaluación Química IDocumento5 páginasRúbrica de Evaluación Química IÑeca2009Aún no hay calificaciones
- Plan de Mejora HVM 2023Documento3 páginasPlan de Mejora HVM 2023Ñeca2009Aún no hay calificaciones
- Planificación 2023 Biología IDocumento7 páginasPlanificación 2023 Biología IÑeca2009Aún no hay calificaciones
- Calendarizacion I-PeriodoDocumento3 páginasCalendarizacion I-PeriodoÑeca2009Aún no hay calificaciones
- Práctica de Laboratorio Ley de Boyle 11voDocumento4 páginasPráctica de Laboratorio Ley de Boyle 11voÑeca2009Aún no hay calificaciones
- Planificación 2023 Fíisca Aplicada (Física III)Documento5 páginasPlanificación 2023 Fíisca Aplicada (Física III)Ñeca2009Aún no hay calificaciones
- Planificación 2023 Fíisca IDocumento8 páginasPlanificación 2023 Fíisca IÑeca2009Aún no hay calificaciones
- Calendarizacion II-periodo AlternoDocumento3 páginasCalendarizacion II-periodo AlternoÑeca2009Aún no hay calificaciones
- Planificación 2023 Química IDocumento8 páginasPlanificación 2023 Química IÑeca2009Aún no hay calificaciones
- Planificación de Campeonato de Futbolito 2022Documento2 páginasPlanificación de Campeonato de Futbolito 2022Ñeca2009Aún no hay calificaciones
- Componentes de Los EcosistemasDocumento3 páginasComponentes de Los EcosistemasÑeca2009Aún no hay calificaciones
- Ejercicios de Regresion LogaritmicaDocumento1 páginaEjercicios de Regresion LogaritmicaÑeca2009Aún no hay calificaciones
- Interacciones EcológicasDocumento5 páginasInteracciones EcológicasÑeca2009Aún no hay calificaciones
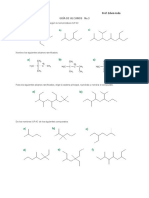
- Guia de Alcanos Zig ZagDocumento2 páginasGuia de Alcanos Zig ZagÑeca2009100% (1)
- Aparatos Reprodcutores HumanosDocumento3 páginasAparatos Reprodcutores HumanosÑeca2009Aún no hay calificaciones
- Enlace QuimicoDocumento1 páginaEnlace QuimicoÑeca2009Aún no hay calificaciones
- EcologíaDocumento3 páginasEcologíaÑeca2009Aún no hay calificaciones
- Movimiento RUADocumento4 páginasMovimiento RUAÑeca2009Aún no hay calificaciones
- La ContaminaciónDocumento4 páginasLa ContaminaciónÑeca2009Aún no hay calificaciones
- Ciclo HidrológicoDocumento3 páginasCiclo HidrológicoÑeca2009Aún no hay calificaciones
- Funciones Quimicas InorganicasDocumento10 páginasFunciones Quimicas InorganicasÑeca2009Aún no hay calificaciones
- Guia de Corriente ElectricaDocumento3 páginasGuia de Corriente ElectricaÑeca2009Aún no hay calificaciones
- Caida LibreDocumento1 páginaCaida LibreÑeca2009Aún no hay calificaciones
- Rumbo y AzimutDocumento3 páginasRumbo y AzimutÑeca2009Aún no hay calificaciones
- Patrones de Flujo Laminar (Modificado)Documento13 páginasPatrones de Flujo Laminar (Modificado)yessica menachoAún no hay calificaciones
- Practica 5 - Cuestionario Final APMDocumento6 páginasPractica 5 - Cuestionario Final APMOSCAR JOSUE VAZQUEZ GUZMANAún no hay calificaciones
- Practica 2 LIQ 2Documento13 páginasPractica 2 LIQ 2Carlos Cortes Aguirre100% (2)
- 9852 1914 05j Maintenance Manual Simba 1254Documento206 páginas9852 1914 05j Maintenance Manual Simba 1254Andres Atehortua100% (1)
- Den - 04B - Sala de Comando Imágenes Dental BDocumento2 páginasDen - 04B - Sala de Comando Imágenes Dental BVanessa MorenoAún no hay calificaciones
- Examen Final Pet 240 Ii-2011Documento1 páginaExamen Final Pet 240 Ii-2011HernanAún no hay calificaciones
- Presupuesto de Colectores - AlcantarilladoDocumento29 páginasPresupuesto de Colectores - AlcantarilladoDianetItmaAún no hay calificaciones
- 05 - I Ifsta ExtintoresDocumento44 páginas05 - I Ifsta ExtintoresBomberos SanmarcosAún no hay calificaciones
- MedicionDeLiquidosRev2 0 PDFDocumento129 páginasMedicionDeLiquidosRev2 0 PDFIvan RaAún no hay calificaciones
- BebidasDocumento14 páginasBebidasYENI CALLATAAún no hay calificaciones
- Memoria DescriptivaDocumento26 páginasMemoria DescriptivaHenrycito Zea GuevaraAún no hay calificaciones
- Introducción A Turbinas de GasDocumento27 páginasIntroducción A Turbinas de GasAntonio FloresAún no hay calificaciones
- ManometroDocumento11 páginasManometrokodeshitoAún no hay calificaciones
- TP 6 2016 Flujo-En-CaneriasDocumento5 páginasTP 6 2016 Flujo-En-Caneriasmartin danielAún no hay calificaciones
- Manual de NeumaticaDocumento72 páginasManual de NeumaticaLuis Eduardo Mercado100% (1)
- Artículo Peng-RobinsonDocumento8 páginasArtículo Peng-RobinsonF5LucasAún no hay calificaciones
- Ejercicios Resueltos Fiski DBH3 1.ebaluazioaDocumento17 páginasEjercicios Resueltos Fiski DBH3 1.ebaluazioaGarazi IDIAKEZ IRASTORZA0% (1)
- Natural Gas Processing From Midstream To Downstream - Chapitre1Documento14 páginasNatural Gas Processing From Midstream To Downstream - Chapitre1Beatriz Velásquez LeónAún no hay calificaciones
- ManualDocumento1 páginaManualDaniel Gomez MartinezAún no hay calificaciones
- B Vacio Anillo Liquido Va 22-150-210-280Documento4 páginasB Vacio Anillo Liquido Va 22-150-210-280Farid DiazAún no hay calificaciones
- Sesión #2Documento53 páginasSesión #2Kevin QFAún no hay calificaciones
- Manual de Operación y Mantenimiento Caldera EXPORT PEZ SASDocumento24 páginasManual de Operación y Mantenimiento Caldera EXPORT PEZ SASSantiago AriasAún no hay calificaciones
- Acumulador (Piloto) - Probar y CargarDocumento13 páginasAcumulador (Piloto) - Probar y CargarWilmer Huingo VargasAún no hay calificaciones
- TUC - Sistemas de Filtracion en Planta - PRO - 0719 - CNCDocumento33 páginasTUC - Sistemas de Filtracion en Planta - PRO - 0719 - CNCJavier DiazAún no hay calificaciones
- Visor Precios Unitarios 2014 IDUDocumento410 páginasVisor Precios Unitarios 2014 IDUFroilaco SiriacoAún no hay calificaciones
- Laboratorio 3 Procesos 2Documento13 páginasLaboratorio 3 Procesos 2Walter Crisólogo PérezAún no hay calificaciones
- ExplicacionDocumento4 páginasExplicacionMiriam HernandezAún no hay calificaciones
- Catalogo de Conceptos WalmartDocumento8 páginasCatalogo de Conceptos WalmartYesenia CastroAún no hay calificaciones