Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Caso Práctico de Cristalización
Caso Práctico de Cristalización
Cargado por
GOVENKA SUSANA PEREZ BLANCO0 calificaciones0% encontró este documento útil (0 votos)
7 vistas3 páginasEste documento presenta un caso práctico de cristalización de aspirina. Se sintetizaron 10 g de aspirina y se purificó mediante cristalización. La primera cristalización produjo un compuesto con punto de fusión de 156-157°C, lo que indica posible hidrólisis a ácido salicílico. Una segunda cristalización usando disolventes orgánicos sin agua dio como resultado 1.7 g de sólido con punto de fusión de 133-135°C, confirmando la obtención de aspirina pur
Descripción original:
Caso práctico de cristalización (1)
Título original
Caso práctico de cristalización (1)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento presenta un caso práctico de cristalización de aspirina. Se sintetizaron 10 g de aspirina y se purificó mediante cristalización. La primera cristalización produjo un compuesto con punto de fusión de 156-157°C, lo que indica posible hidrólisis a ácido salicílico. Una segunda cristalización usando disolventes orgánicos sin agua dio como resultado 1.7 g de sólido con punto de fusión de 133-135°C, confirmando la obtención de aspirina pur
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
7 vistas3 páginasCaso Práctico de Cristalización
Caso Práctico de Cristalización
Cargado por
GOVENKA SUSANA PEREZ BLANCOEste documento presenta un caso práctico de cristalización de aspirina. Se sintetizaron 10 g de aspirina y se purificó mediante cristalización. La primera cristalización produjo un compuesto con punto de fusión de 156-157°C, lo que indica posible hidrólisis a ácido salicílico. Una segunda cristalización usando disolventes orgánicos sin agua dio como resultado 1.7 g de sólido con punto de fusión de 133-135°C, confirmando la obtención de aspirina pur
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
Caso práctico de cristalización
Semestre 2023-2, QOI-G-17-Laboratorio
En el laboratorio usted sintetizó 10 g de aspirina de acuerdo a la siguiente
reacción:
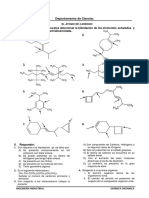
1. Si la materia prima y el producto son blancos, ¿cómo puede saber que ocurrió la
reacción?
Determina el punto de fusión del producto después de aislarlo y obtiene el siguiente
resultado pf=132-140° C.
2. ¿Qué información puede obtener de este punto de fusión del compuesto aislado?
Decide purificar el producto de la reacción y realiza pruebas de solubilidad y obtiene los
siguiente:
Disolvente hexano AcOEt Acetona EtOH MeOH Agua
frío Insoluble Soluble 2 Soluble 1 Soluble 2 Soluble 2 Insoluble
en 3 mL mL mL mL mL en 3 mL
caliente Insoluble, --- --- --- --- soluble
se evapora
el
disolvente
De acuerdo a las pruebas de solubilidad:
3. ¿Qué tipo de cristalización debe realizar? ¿Por qué?
Usted toma una muestra de 2 g y realiza la cristalización.
4. ¿Cuáles son los pasos que debe seguir de acuerdo a las impurezas que podría contener
la muestra (considere que proviene de una reacción química)?
Una vez terminada la cristalización, obtiene 1.4 g de un sólido blanco y le determina el pf y
observando el siguiente resultado:
pf AAS-1 cristalizado = 156-157° C
Al observar y analizar este punto de fusión:
5. ¿Cuál es la conclusión a la que llega?
6. ¿Se trata de un compuesto puro? ¿por qué? ¿Es ácido acetilsalicílico?
Ante este resultado, usted busca en la literatura y encuentra que los ésteres se hidrolizan
(rompimiento de un enlace por acción del agua) en medio acuoso y con catálisis ácida a
altas temperaturas y se obtiene un ácido carboxílico y un alcohol, por lo cual analiza las
estructuras del ácido acetilsalicílico (AAS) y del ácido salicílico (AS):
7. ¿Qué grupos funcionales encuentra en cada uno de estos compuestos?
Considera la posibilidad de que el AAS se haya hidrolizado en las condiciones de
cristalización y formar el AS. Para evitar esta duda lo que usted hace es cristalizar
nuevamente, pero ahora sabe que no debe tener agua mientras calienta el compuesto para
disolverlo:
8. ¿Considera la posibilidad de haber hidrolizado su producto en la cristalización? ¿por qué?
Considere las evidencias experimentales para justificar.
9. ¿Qué usaría para cristalizar nuevamente? ¿Por qué?
10.¿Cuál(es) es (son) los disolventes que usaría? ¿Por qué?
11.Describa brevemente como realizaría el proceso en está cristalización. Nuevamente
toma 2 g de la muestra y lo cristaliza, obteniendo 1.7 g de un sólido blanco al cual le
determina el pf y observa lo siguiente:
pf AAS cristalizado = 133-135° C.
12.¿Qué información obtiene de este punto de fusión? ¿es un compuesto puro? ¿Es
aspirina?
13.De acuerdo a la masa recuperada, ¿Cuál es el % de rendimiento del proceso de
cristalización?
También podría gustarte
- LABORATORIO 02. Sustancias y MezclasDocumento13 páginasLABORATORIO 02. Sustancias y MezclasYomayra Lopez Vargas0% (1)
- Calidad del agua para estudiantes de ciencias ambientalesDe EverandCalidad del agua para estudiantes de ciencias ambientalesAún no hay calificaciones
- Informe 02 de Quimica OrganicaDocumento12 páginasInforme 02 de Quimica OrganicaDenisse0% (2)
- Practica 3 RecristalizacionDocumento4 páginasPractica 3 RecristalizacionValeriaAún no hay calificaciones
- Cristalizacion 1Documento15 páginasCristalizacion 1DanteAún no hay calificaciones
- Practica 3Documento4 páginasPractica 3NathAún no hay calificaciones
- Informe 02 de Quimica OrganicaDocumento12 páginasInforme 02 de Quimica OrganicaDenisseAún no hay calificaciones
- Reporte Practica 3Documento5 páginasReporte Practica 3Yair GarciaAún no hay calificaciones
- Practica 3 OrganicaDocumento4 páginasPractica 3 OrganicaKary MacielAún no hay calificaciones
- Obtención de Alcohol (Fermentación) (1) WordDocumento5 páginasObtención de Alcohol (Fermentación) (1) WordScarlett RamirezAún no hay calificaciones
- CristalizaciónDocumento12 páginasCristalizaciónLisbeth Alvarez SantillànAún no hay calificaciones
- Guía Lab. 1 POLARIDAD DE COMPUESTOS ORGÁNICOSDocumento4 páginasGuía Lab. 1 POLARIDAD DE COMPUESTOS ORGÁNICOSAlejandra Parra SilvaAún no hay calificaciones
- Informe de Orgánica 2Documento14 páginasInforme de Orgánica 2edmundoAún no hay calificaciones
- Informe Lab Org 1Documento6 páginasInforme Lab Org 1David RojasAún no hay calificaciones
- Practica 2 QO1Documento3 páginasPractica 2 QO1Soto Samano FrydaAún no hay calificaciones
- Practica 2 Cristalizacion SimpleDocumento3 páginasPractica 2 Cristalizacion SimpleAlejandro ReyesAún no hay calificaciones
- Propiedades Coligativas SDocumento4 páginasPropiedades Coligativas SVader DarkAún no hay calificaciones
- Organica 1 Cristalizacion SimpleDocumento5 páginasOrganica 1 Cristalizacion SimpleJosé Luis FerrerAún no hay calificaciones
- Trabajo CritalizacionDocumento6 páginasTrabajo CritalizacionAnonymous 7lqdSY4Aún no hay calificaciones
- Laboratorio #4 Síntesis, Purificación y Caracterización de Acetanilida - Grupo NDocumento18 páginasLaboratorio #4 Síntesis, Purificación y Caracterización de Acetanilida - Grupo NBeatriz godoyAún no hay calificaciones
- Cuestiones Obl Qo 2023Documento24 páginasCuestiones Obl Qo 2023martaAún no hay calificaciones
- RECRISTALIZACIONDocumento4 páginasRECRISTALIZACIONJosue SilvaAún no hay calificaciones
- Práctica No. 2. Cristalización Simple. Facultad de Química UNAMDocumento4 páginasPráctica No. 2. Cristalización Simple. Facultad de Química UNAMEmilioOsioAnayaAún no hay calificaciones
- Informe 1 Formula Molecular Muestra 118Documento8 páginasInforme 1 Formula Molecular Muestra 118Mateo GallardoAún no hay calificaciones
- Laboratorio de Química Orgánica 3-UNMSMDocumento11 páginasLaboratorio de Química Orgánica 3-UNMSMSARA CHACPI ALFAROAún no hay calificaciones
- CRISTALIZACIONDocumento9 páginasCRISTALIZACIONLemon TeaAún no hay calificaciones
- Quimica Organica Lab N2 RonalDocumento6 páginasQuimica Organica Lab N2 RonalRoger Morales CiriloAún no hay calificaciones
- P2 Cristalización Simple.Documento4 páginasP2 Cristalización Simple.Alma DanielaAún no hay calificaciones
- LABORATORIO 02 TIPOS DE SUSTANCIAS Y SEPARACION DE MEZCLAS-1-1jorgedanielDocumento14 páginasLABORATORIO 02 TIPOS DE SUSTANCIAS Y SEPARACION DE MEZCLAS-1-1jorgedanielJorge Daniel Mamani CanchaAún no hay calificaciones
- Extracción Solido-Solido y LiquidoDocumento10 páginasExtracción Solido-Solido y LiquidoyonsonAún no hay calificaciones
- Cristalizacion de La AspirinaDocumento5 páginasCristalizacion de La Aspirinaailyn alejandra sanchez vergelAún no hay calificaciones
- Primer Examen de Laboratorio de Quimica OrganicaDocumento4 páginasPrimer Examen de Laboratorio de Quimica Organicaneker castilloAún no hay calificaciones
- Practica 4Documento3 páginasPractica 4CAROLINA HERRERAAún no hay calificaciones
- Práctica 2 Cristalizacion SimpleDocumento5 páginasPráctica 2 Cristalizacion SimpleAlejandro ReyesAún no hay calificaciones
- Practica 2. CristalizacionDocumento4 páginasPractica 2. CristalizacionJenniAún no hay calificaciones
- Bitacora de TrabajoP4)Documento3 páginasBitacora de TrabajoP4)Alexis GudiñoAún no hay calificaciones
- Cristalización Por Par de DisolventesDocumento5 páginasCristalización Por Par de DisolventesErickJuárezAún no hay calificaciones
- Cuestionario 1 QMC-200Documento5 páginasCuestionario 1 QMC-200marco asturizagaAún no hay calificaciones
- Practica 3 Cristalización Por Par de DisolventesDocumento5 páginasPractica 3 Cristalización Por Par de DisolventesAnonymous WtLEdM2ioAún no hay calificaciones
- Práctica 5Documento5 páginasPráctica 5Alex PirkerAún no hay calificaciones
- Practica de Laboratorio No. 4 Quimica2Documento4 páginasPractica de Laboratorio No. 4 Quimica2johan hurtadoAún no hay calificaciones
- Practica 3.5 QuimicaDocumento8 páginasPractica 3.5 QuimicaAngelica GalarzaAún no hay calificaciones
- Reporte 7 Q. O.Documento5 páginasReporte 7 Q. O.mdaniela.romuAún no hay calificaciones
- Simulacro Examen ParcialDocumento1 páginaSimulacro Examen ParcialNicole C.RAún no hay calificaciones
- Laboratorio 02 - 1266819498LLDocumento13 páginasLaboratorio 02 - 1266819498LLBryam Andre Villanuev Guillen100% (1)
- Quimica Laboratorio 09Documento11 páginasQuimica Laboratorio 09Sahori Lizeth VibusAún no hay calificaciones
- Reporte de Practica de LaboratorioDocumento5 páginasReporte de Practica de LaboratorioRamsespacAún no hay calificaciones
- Informe No5Documento7 páginasInforme No5Jazmin OshuaAún no hay calificaciones
- Reporte CristalizacionDocumento4 páginasReporte Cristalizaciondavid liraAún no hay calificaciones
- Inf 03 Destilación - V2Documento5 páginasInf 03 Destilación - V2Yoselin HcAún no hay calificaciones
- INFORME 2-Quimica OrganicaDocumento10 páginasINFORME 2-Quimica OrganicaHanaro-KunAún no hay calificaciones
- Sintesis de Un EterDocumento6 páginasSintesis de Un EterCami ChavezAún no hay calificaciones
- Informe 4Documento5 páginasInforme 4Nilú MoriAún no hay calificaciones
- Informe - 5 Química Órganica IDocumento10 páginasInforme - 5 Química Órganica Imax.trujilloAún no hay calificaciones
- Prácticas QOIII PDFDocumento19 páginasPrácticas QOIII PDFElmer CurioAún no hay calificaciones
- CHEM 2222 Protocolos de ExperimentosDocumento23 páginasCHEM 2222 Protocolos de ExperimentosJhair GodoyAún no hay calificaciones
- Práctica #2Documento7 páginasPráctica #2Mio PhamthomAún no hay calificaciones
- Informe 2Documento19 páginasInforme 2Juan Diego Jiménez FornoAún no hay calificaciones
- Práctica 15Documento7 páginasPráctica 15Adrian GuajardoAún no hay calificaciones
- Grupos Funcionales y Propiedades FísicasDocumento2 páginasGrupos Funcionales y Propiedades FísicasGOVENKA SUSANA PEREZ BLANCOAún no hay calificaciones
- TAFILOMIDADocumento2 páginasTAFILOMIDAGOVENKA SUSANA PEREZ BLANCOAún no hay calificaciones
- PRÁCTICA No 1 QOIDocumento8 páginasPRÁCTICA No 1 QOIGOVENKA SUSANA PEREZ BLANCOAún no hay calificaciones
- Cuestionario BIG BANGDocumento5 páginasCuestionario BIG BANGGOVENKA SUSANA PEREZ BLANCOAún no hay calificaciones
- Cuestionario Sobre La Química Orgánica y Su EvoluciónDocumento2 páginasCuestionario Sobre La Química Orgánica y Su EvoluciónGOVENKA SUSANA PEREZ BLANCOAún no hay calificaciones
- Diagnostico Con Oscilogramas de Los Sistemas de EncendidoDocumento17 páginasDiagnostico Con Oscilogramas de Los Sistemas de EncendidoCharlygt500100% (1)
- UNE-IsO-8589 Guia General para El Diseno de Salas de CataDocumento21 páginasUNE-IsO-8589 Guia General para El Diseno de Salas de CatasensorialAún no hay calificaciones
- Proyecto El CacaoDocumento35 páginasProyecto El CacaoMaria Maria50% (2)
- TP2 Bis - Corazon y Grandes VasosDocumento21 páginasTP2 Bis - Corazon y Grandes VasosDaniela BenencioAún no hay calificaciones
- Variedad de Papa INIAP-Gabriela (Ecuador)Documento4 páginasVariedad de Papa INIAP-Gabriela (Ecuador)Jorge Luis Alonso G.Aún no hay calificaciones
- La Materia Oscura y Los DinosauriosDocumento3 páginasLa Materia Oscura y Los DinosauriosMax RodriguezAún no hay calificaciones
- La Alcazaba de Coin y El Sistema Defensivo Del Territorio (Sierra Alpujata)Documento28 páginasLa Alcazaba de Coin y El Sistema Defensivo Del Territorio (Sierra Alpujata)AntonioAún no hay calificaciones
- Sistema de Detección y Medición de Los Factores de RiesgosDocumento9 páginasSistema de Detección y Medición de Los Factores de RiesgosVeronica Acosta MijaresAún no hay calificaciones
- Cerrejon Informe Sostenibilidad 2012Documento107 páginasCerrejon Informe Sostenibilidad 2012Yesenia Lisney Barajas VasquezAún no hay calificaciones
- El Átomo y Su EstructuraDocumento2 páginasEl Átomo y Su EstructuraJhoselin Zarela Zegarra PonteAún no hay calificaciones
- Servicio Al Cliente - Amir AvalosDocumento1 páginaServicio Al Cliente - Amir AvalosAmir Avalos RodriguezAún no hay calificaciones
- Full Face e Hilos TensoresDocumento23 páginasFull Face e Hilos TensoresIngrid Daniela Campos LeañoAún no hay calificaciones
- Perfil Losa Puente Pedrinos - Mod2 New AndyxDocumento46 páginasPerfil Losa Puente Pedrinos - Mod2 New AndyxWilly CruzAún no hay calificaciones
- Escuelas Psicológicas DinámicasDocumento2 páginasEscuelas Psicológicas Dinámicasjorge mario gonzalez arizaAún no hay calificaciones
- CAÍDA LIBRE y Temperatura y CalorDocumento8 páginasCAÍDA LIBRE y Temperatura y CalorJose Dilser Mejia RegaladoAún no hay calificaciones
- Glasswool - 28 Junio 2022Documento1 páginaGlasswool - 28 Junio 2022Enzo DinAún no hay calificaciones
- Manual Uso Horno BoschDocumento52 páginasManual Uso Horno BoschShadow50_40% (1)
- Laboratorio 3 - Mediciones ElectricasDocumento15 páginasLaboratorio 3 - Mediciones ElectricasELKIN ADRIAN ROA GALVISAún no hay calificaciones
- Semana 4 Plan Maestro de ProduccionDocumento20 páginasSemana 4 Plan Maestro de ProduccionLuis Vi llamar malvaez100% (1)
- M7 U1 S1 FFGVDocumento39 páginasM7 U1 S1 FFGVZack Fair Gonzalez VarelaAún no hay calificaciones
- Prefijos GriegosDocumento13 páginasPrefijos GriegosVivianAún no hay calificaciones
- Idea de EmpresaDocumento3 páginasIdea de Empresasandy7564Aún no hay calificaciones
- Segunda FaseDocumento4 páginasSegunda FaseJose Antonio Torres GraterolAún no hay calificaciones
- .Informe de Liquidacion de Obra San CarlosDocumento51 páginas.Informe de Liquidacion de Obra San CarlosSofia CapuñayAún no hay calificaciones
- TRATAMIENTOS TERMICOS Fuente rv1 PDFDocumento143 páginasTRATAMIENTOS TERMICOS Fuente rv1 PDFRon Jaggermeister Olmeca GuarinAún no hay calificaciones
- Ley 295 - Aseo UrbanoDocumento7 páginasLey 295 - Aseo UrbanoGrecia RiveroAún no hay calificaciones
- Oferta y Demanda 1Documento13 páginasOferta y Demanda 1cinthia huimaAún no hay calificaciones
- El Mundo Al Reves Mitología y Ritos Sincretistico Del Viernes Santo en El Ande PeruanoDocumento14 páginasEl Mundo Al Reves Mitología y Ritos Sincretistico Del Viernes Santo en El Ande PeruanoNataliaSinde87Aún no hay calificaciones
- Trifoliar de Los Valores MayasDocumento2 páginasTrifoliar de Los Valores MayasPEM en EBI con énfasis en la Cultura MayaAún no hay calificaciones
- Auditoría en Tecnologías de La InformaciónDocumento31 páginasAuditoría en Tecnologías de La InformaciónOscar Bryan Yanapa VentocillaAún no hay calificaciones