Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guia Modelo Atomico
Cargado por
Samuel Pinzon0 calificaciones0% encontró este documento útil (0 votos)
21 vistas2 páginasguia para que sus alumnos saquen 10 en la materia
Título original
Guia modelo atomico
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoguia para que sus alumnos saquen 10 en la materia
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
21 vistas2 páginasGuia Modelo Atomico
Cargado por
Samuel Pinzonguia para que sus alumnos saquen 10 en la materia
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
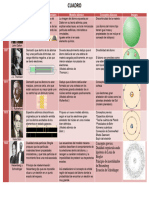
Modelo atómico de Rutherford (1911 d.C.
) Modelo atómico de Thomson Este modelo da inicio en el mundo de la física a los
La siguiente gran aportación dentro de la evolución del postulados cuánticos, por lo que se considera una
Ernest Rutherford realizó una serie de experimentos en modelo atómico fue la del ganador del Premio Nobel, transición entre la mecánica clásica y la cuántica.
1911 a partir de láminas de oro. En estos experimentos J. J. Thomson (1856 – 1940). En 1897, él retomó el El físico danés Niels Bohr propuso este modelo para
determinó que el átomo está compuesto por un núcleo modelo de Dalton, pero, a partir de una serie de explicar cómo podían los electrones tener órbitas
atómico de carga positiva (donde se concentra la mayor experimentos con rayos catódicos, descubrió estables (o niveles energéticos estables) rodeando el
parte de su masa) y los electrones, que giran libremente partículas contenidas dentro del átomo con carga núcleo. Además explica por qué los átomos tienen
alrededor de este núcleo. En este modelo se propone negativa. Estas partículas recibieron el nombre de espectros de emisión característicos.
electrones. En los espectros realizados para muchos átomos se
por primera la existencia del núcleo atómico.
Entre las características de su modelo, las más observaba que los electrones de un mismo nivel
Actualmente, la Química nos explica importantes serían: energético tenían energías diferentes. Esto demostró
la existencia del átomo y de las partículas El modelo es concebido como una esfera uniforme con que había errores en el modelo y que debían existir
subatómicas: electrón, neutrón y protón. Sin carga positiva. Dentro de esta esfera se encuentran subniveles de energía en cada nivel energético.
embargo, para llegar a estos conocimientos incrustados los electrones. Por la forma que describe, El modelo de Bohr se resume en tres postulados:
tuvieron que desarrollarse distintas teorías y también se le conoce como el “modelo de pastel de • Los electrones trazan órbitas circulares en torno
postulados, conocidos como la evolución del pasas” o de “panqué de pasas”. al núcleo sin irradiar energía.
modelo atómico. • Las órbitas permitidas a los electrones son
aquellas con cierto valor de momento angular (L)
El modelo atómico es la manera en que, a lo (cantidad de rotación de un objeto) que sea un
largo de los años, se ha representado la múltiplo entero del valor, siendo h=6.6260664×10-
estructura y el funcionamiento de los átomos 34 y n=1, 2, 3….
y de sus partículas. De acuerdo con los
avances de distintas generaciones de • Los electrones emiten o absorben energía al
científicos y filósofos, poco a poco se ha saltar de una órbita a otra y al hacerlo emiten un
construido la figura del átomo tal como la fotón que representa la diferencia de energía
entre ambas órbitas.
conocemos ahora.
Los primeros filósofos griegos de la antigüedad John Dalton (1766 – 1844), científico británico, formuló un nuevo En 1913 Bohr consiguió introducir la cuantización de La introducción de la Física Cuántica en el átomo era
fueron conocidos como naturalistas, ya que se modelo atómico a partir de distintas observaciones en 1808. Los la energía (principio básico de la Física Cuántica) en el imparable, y después de varios modelos intermedios (p.e. el
enfocaban en entender la naturaleza y los distintos postulados de Dalton se resumen de la siguiente forma: átomo. La idea era sencilla: los electrones no podían de las órbitas electrónicas elípticas de Broglie), en 1927
fenómenos que la integraban. Todos los elementos están formados por átomos, partículas muy Schrödinger propone un modelo atómico completamente
estar a cualquier distancia del núcleo, solo podían
Uno de ellos fue Demócrito de Abdera (460 – 370 a. pequeñas. cuántico en el comportamiento del electrón estaba descrito
C.), quien sostenía que todas las cosas Los átomos de un elemento poseen propiedades idénticas (masa, ocupar capas situadas a ciertas distancias permitidas, por su función de onda. En este modelo los efectos cuánticos
están compuestas por pequeñas partículas peso, etc.), pero son distintos a los átomos de otros, Por ejemplo, los el tamaño de las órbitas electrónicas estaba observados experimentalmente (p.e. cuantización de la
indivisibles. A estas partículas les dio el nombre átomos del hidrógeno son idénticos entre ellos, pero diferentes a los cuantizado. En este modelo las innovaciones energía) no surgían de exigencias exóticas como las
de ἄτομος (átomo) que literalmente significa “que no átomos de oxígeno. cuánticas cohabitaban con la Física clásica, pero la introducidas por Bohr sino de la propia naturaleza del sistema
puede cortarse”. La unión de átomos de dos o más elementos forma los compuestos mezcla funcionaba: por primera vez se podía explicar atómico. La idea feliz de Schrödinger era simple: el electrón
Entre las características del modelo atómico de químicos. el espectro discontinuo de la luz emitida por el en el átomo se comporta como una onda material que, al
Demócrito, algunas de las que destacan son: Los átomos no se pueden crear ni destruir, sino que las reacciones hidrógeno. estar confinada, solo puede vibrar de determinadas maneras.
1. Los átomos se encuentran dispersos en el químicas sólo pueden provocar el ordenamiento, combinación o Cada uno de esos estados de vibración fueron denominados
vacío. separación de los átomos. orbitales. ¡¡Un átomo era más parecido a una cuerda vibrante
2. Hay una fuerza que une a los átomos para Gracias al modelo atómico de Dalton, los científicos concibieron a los
formar la materia. átomos como la unidad básica de la materia que conservan la
3. El número de átomos determina identidad química de los elementos.
las propiedades de la materia.
Aunque más tarde otros filósofos como Platón y
Aristóteles debatieron sus postulados, pasarían
muchos años para que existiera otra aportación en
la evolución del modelo atómico.
que a un sistema planetario!!
Modelo Atómico Autor
400 a.C
1800
1900
1920
SEPTIMO – CIENCIAS NATURALES
CENTRO DON BOSCO
Nombre: ___________
___________________ 1926
___________________
Curso: _____________
También podría gustarte
- Linea de Tiempo Modelos Atomicos QuimicaDocumento2 páginasLinea de Tiempo Modelos Atomicos QuimicaLeidy Yohana Bayona Florez86% (7)
- Presentación1 Linea de TiempoDocumento1 páginaPresentación1 Linea de Tiempoluis zavala (luisito)Aún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosSamanta Trejo SalcedoAún no hay calificaciones
- Linea Del Tiempo Evolucion de Los Modelos Atomicos PDFDocumento2 páginasLinea Del Tiempo Evolucion de Los Modelos Atomicos PDFKevinSpyAún no hay calificaciones
- Investigacion Quimica Teorias Atomicas Quimica InorganicaDocumento4 páginasInvestigacion Quimica Teorias Atomicas Quimica InorganicaFaiver Arley Pacheco UribeAún no hay calificaciones
- Modulo 4 QT 2021Documento7 páginasModulo 4 QT 2021Carina BogadoAún no hay calificaciones
- Modelo AtomicoDocumento8 páginasModelo AtomicoOctavio Felipe Mendez MorenoAún no hay calificaciones
- Tarea Evidencias de Estructura AtómicaDocumento5 páginasTarea Evidencias de Estructura Atómicaalanntorres09ctrlAún no hay calificaciones
- Bloque FISICOQUIMICA 2024Documento57 páginasBloque FISICOQUIMICA 2024Jacqueline BiondiAún no hay calificaciones
- Quimica de 8 y 9 Modelos AtomicosDocumento9 páginasQuimica de 8 y 9 Modelos AtomicosAlejandra HenaoAún no hay calificaciones
- Línea Del Tiempo de Los Modelos AtómicosDocumento8 páginasLínea Del Tiempo de Los Modelos AtómicosDani MartinezAún no hay calificaciones
- Línea de Tiempo Modelos Atomicos - Velasco SantiagoDocumento3 páginasLínea de Tiempo Modelos Atomicos - Velasco SantiagoSantiago Vs100% (1)
- Modelos Del AtomoDocumento2 páginasModelos Del Atomocamiv14ygAún no hay calificaciones
- Linea Del Tiempo Ma - QuimicaDocumento2 páginasLinea Del Tiempo Ma - QuimicaFranco Rincón GiselleAún no hay calificaciones
- Tarea 1 - Estructura AtomicaDocumento11 páginasTarea 1 - Estructura Atomicajefferson guerreroAún no hay calificaciones
- Tarea2 B1 ÁtomoDocumento8 páginasTarea2 B1 ÁtomoDaniel AvantesAún no hay calificaciones
- Átomo y Tabla Periódica PDFDocumento12 páginasÁtomo y Tabla Periódica PDFJuan ZuñigaAún no hay calificaciones
- Tríptico Modelos AtómicosDocumento2 páginasTríptico Modelos AtómicosEtian JaraAún no hay calificaciones
- Cuadro Comparativo - Modelos AtomicosDocumento3 páginasCuadro Comparativo - Modelos AtomicosEuan Sánchez Gabriel EduardoAún no hay calificaciones
- Química San Agustin - 2023 - 4to SecDocumento128 páginasQuímica San Agustin - 2023 - 4to SecPROFESOR ADOLFO RAMÓNAún no hay calificaciones
- Linea de TiempoDocumento6 páginasLinea de TiempoYamilet ReyesAún no hay calificaciones
- F OLDERDocumento13 páginasF OLDERV4ltr3X C0d3Aún no hay calificaciones
- 1.-Modelos AtomicosDocumento23 páginas1.-Modelos Atomicosalanalambre2607Aún no hay calificaciones
- Teoría AtómicaDocumento23 páginasTeoría AtómicaCupul Cauich Diego RobertoAún no hay calificaciones
- Modelos Atomicos 2Documento3 páginasModelos Atomicos 2Jhoe Henrriquez0% (1)
- Infografia Historia Del Modelo AtomicoDocumento1 páginaInfografia Historia Del Modelo AtomicoCatalina Almendra Palma PintoAún no hay calificaciones
- Teoría AtómicaDocumento5 páginasTeoría AtómicaPercy PérezAún no hay calificaciones
- Cuadro Comparativo de Los Modelos AtomicosDocumento1 páginaCuadro Comparativo de Los Modelos Atomicoslautarobre10Aún no hay calificaciones
- Actividades de QuimicaDocumento7 páginasActividades de Quimicairvingfeel0409swAún no hay calificaciones
- Historia de Los Modelos Atómicosy Modelo Mecanico CuanticoDocumento20 páginasHistoria de Los Modelos Atómicosy Modelo Mecanico CuanticoDELMY ISABEL ÁLVAREZ VILLAFRANCOAún no hay calificaciones
- Modelos AtomicosDocumento15 páginasModelos AtomicosLópez García Axel UrielAún no hay calificaciones
- LMy TDocumento6 páginasLMy Tlu pnAún no hay calificaciones
- 04 - 2023-IIQ - Teoría Atomica .Documento14 páginas04 - 2023-IIQ - Teoría Atomica .Melisa CroceAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosRaulZorrillaAún no hay calificaciones
- Qui MicaDocumento235 páginasQui MicaJupiter GonzalezAún no hay calificaciones
- Modelos AtómicosDocumento6 páginasModelos AtómicosNathalia HerreraAún no hay calificaciones
- Resumen Modelos AtómicosDocumento6 páginasResumen Modelos Atómicosyour.worst.nightmare79417873Aún no hay calificaciones
- Cuadro Comparativo de Los Modelos AtómicosDocumento6 páginasCuadro Comparativo de Los Modelos AtómicosJesús Alexander MejíazAún no hay calificaciones
- Cuadro Modelos Atómicos - Roldán Marianela 6°EDocumento2 páginasCuadro Modelos Atómicos - Roldán Marianela 6°EAgusAún no hay calificaciones
- Clase 2 - QG Unidad II - 02022022Documento22 páginasClase 2 - QG Unidad II - 02022022Juan Emmanuel Flores RangelAún no hay calificaciones
- Informe de Modelos AtómicosDocumento7 páginasInforme de Modelos AtómicosDagna C3rdanoAún no hay calificaciones
- Modelos AnatomicosDocumento12 páginasModelos AnatomicosSayory Castillo CastilloAún no hay calificaciones
- QUÍMICA - MODELOS ATÓMICOS - : Cad Logr Comie Co L Decisió D IntentarlDocumento3 páginasQUÍMICA - MODELOS ATÓMICOS - : Cad Logr Comie Co L Decisió D IntentarlLa Kpoper ShippeadoraAún no hay calificaciones
- Modelos Atomicos para Grado Decimo 4 Mayo de 2020Documento20 páginasModelos Atomicos para Grado Decimo 4 Mayo de 2020Johana De La HozAún no hay calificaciones
- Estructura Atómica para Cuarto Grado de SecundariaDocumento7 páginasEstructura Atómica para Cuarto Grado de SecundariaAlberto Edwin Condori Quispe0% (1)
- 1p. Guía 2. Química. Marilu Viafara Loaiza 10.4, 10.5, 10-6Documento48 páginas1p. Guía 2. Química. Marilu Viafara Loaiza 10.4, 10.5, 10-6IsabellaAún no hay calificaciones
- Guía Química Pace Aes 2018Documento13 páginasGuía Química Pace Aes 2018Amanda Alejandra Silva FuentesAún no hay calificaciones
- 4°sec-Estructura AtomicaDocumento8 páginas4°sec-Estructura AtomicavanelizAún no hay calificaciones
- Tema n1. Teorias AtomicasDocumento21 páginasTema n1. Teorias AtomicasYovana SaavedraAún no hay calificaciones
- Modelos AtómicosDocumento10 páginasModelos AtómicosCristian BravoAún no hay calificaciones
- Modelo AtomicoDocumento4 páginasModelo AtomicoRoberto Lopez HernándezAún no hay calificaciones
- Linea de Tiempo Teoria AtomistaDocumento4 páginasLinea de Tiempo Teoria AtomistaEsperanza López MosquedaAún no hay calificaciones
- Alcances y Limitaciones de Los Modelos AtomicosDocumento4 páginasAlcances y Limitaciones de Los Modelos Atomicosmariafernanda herreramartinezAún no hay calificaciones
- Evolución de Los Modelos AtómicosDocumento7 páginasEvolución de Los Modelos AtómicosavilamarialuzAún no hay calificaciones
- Unidad V Teoria Atomico Molecular-Estructura AtomicaDocumento29 páginasUnidad V Teoria Atomico Molecular-Estructura AtomicaErik Arce AcAún no hay calificaciones
- 2 Quimica 4to y 5to Sec. Sesion 2Documento9 páginas2 Quimica 4to y 5to Sec. Sesion 2Cesar ApesteguiAún no hay calificaciones
- Modelos AtómicosDocumento19 páginasModelos AtómicosGrenorich Steven Ruiz ReyesAún no hay calificaciones
- S1 POCEROS ANGELES MIREYA - La Construcción Del Conocimiento Algunas ReflexionesDocumento3 páginasS1 POCEROS ANGELES MIREYA - La Construcción Del Conocimiento Algunas ReflexionesMireyaPocerosAAún no hay calificaciones
- Habilidades SOLUCIDocumento13 páginasHabilidades SOLUCIAlfre Sp MscalAún no hay calificaciones
- Mani en CbaDocumento468 páginasMani en CbaMaria Esther de CaroAún no hay calificaciones
- Rose El Zohar 0Documento112 páginasRose El Zohar 0Manuel Martinez100% (2)
- Ciencia Filosofia y Cosmovision 0728712Documento1 páginaCiencia Filosofia y Cosmovision 0728712EdwardAún no hay calificaciones
- Tema 1 - Intro A La EstadísticaDocumento15 páginasTema 1 - Intro A La EstadísticaCarlaAún no hay calificaciones
- Estapas Historicas de La Psicologia SocialDocumento11 páginasEstapas Historicas de La Psicologia SocialJulio C. Segura MorilloAún no hay calificaciones
- Aportaciones de La QuimicaDocumento3 páginasAportaciones de La QuimicaHernández Pérez Wendy CarolAún no hay calificaciones
- Cuadro Comparativo - Fernandez Pulido Wendy JohanaDocumento3 páginasCuadro Comparativo - Fernandez Pulido Wendy JohanaJhohanhitha FhernhandhezAún no hay calificaciones
- Analisis y Plan de Mejoramiento de La Prueba de Ciencias NaturalesDocumento9 páginasAnalisis y Plan de Mejoramiento de La Prueba de Ciencias NaturalesMaria Edith Barreiro SotoAún no hay calificaciones
- EnsayoDocumento2 páginasEnsayoFausto de la CruzAún no hay calificaciones
- Boehm - El Giro Icónico, Una CartaDocumento14 páginasBoehm - El Giro Icónico, Una CartaLorenaAún no hay calificaciones
- Mpro3 U2 A1 JotlDocumento6 páginasMpro3 U2 A1 Jotlpokemesh pokeAún no hay calificaciones
- Dialogos Con Escritores y Psicoanalistas 19Documento34 páginasDialogos Con Escritores y Psicoanalistas 19Ana RappAún no hay calificaciones
- 2 Comunicación Entre Especies. Entrevista A María Victoria SimonaDocumento14 páginas2 Comunicación Entre Especies. Entrevista A María Victoria SimonaAmarilysSolerAún no hay calificaciones
- Planificación Mensual Julio y AgostoDocumento2 páginasPlanificación Mensual Julio y AgostoZumbaGii OrtizAún no hay calificaciones
- Lectura Cientifica Grado 7Documento10 páginasLectura Cientifica Grado 7Viviana Ricaurte VallejoAún no hay calificaciones
- El Arte de Pensar, Rigoberto LanzDocumento6 páginasEl Arte de Pensar, Rigoberto Lanzluisalfredo_montesAún no hay calificaciones
- MANUAL Investigacion Autodirigida - Forma E - John HollandDocumento6 páginasMANUAL Investigacion Autodirigida - Forma E - John HollandIbpAún no hay calificaciones
- Resume NinoDocumento23 páginasResume NinoJoaquin BonoraAún no hay calificaciones
- Cuadro Comparativo de Psicologia SocialDocumento5 páginasCuadro Comparativo de Psicologia SocialZFI aduanasAún no hay calificaciones
- Instituto Tecnologico Superior de Calkini en El Estado de CampecheDocumento12 páginasInstituto Tecnologico Superior de Calkini en El Estado de CampecheAty Sarao CadenaAún no hay calificaciones
- Clase 2 Análisis de PolíticasDocumento29 páginasClase 2 Análisis de Políticasedgarallan1Aún no hay calificaciones
- Modelos de Intervencion Psicosocial 07-06-22Documento88 páginasModelos de Intervencion Psicosocial 07-06-22lucia valdebenitoAún no hay calificaciones
- Enfoques Paradigmatico de La GeografiaDocumento2 páginasEnfoques Paradigmatico de La GeografiaPaul Anthony ColladoAún no hay calificaciones
- Diseño de Inves DiapositivasDocumento8 páginasDiseño de Inves DiapositivasNatalia PerezAún no hay calificaciones
- Etica Profesional 2 ActividadDocumento6 páginasEtica Profesional 2 ActividadDaniela TRUJILLO RUIZAún no hay calificaciones
- Creatividad MusicalDocumento18 páginasCreatividad MusicalOskr Brayan Pari HAún no hay calificaciones
- ODILIA CASTRO YONDA - 1062083494 - Guía de Actividades y Rúbrica de Evaluación Fase 1 - Introducción y Aspectos Básicos de Sociologia - 100006-29 - SOCIOLOGIA - 21 de FebreroDocumento8 páginasODILIA CASTRO YONDA - 1062083494 - Guía de Actividades y Rúbrica de Evaluación Fase 1 - Introducción y Aspectos Básicos de Sociologia - 100006-29 - SOCIOLOGIA - 21 de FebreroGABRIEL hOLGUINAún no hay calificaciones
- AporteDocumento6 páginasAportesebastianAún no hay calificaciones