100% encontró este documento útil (1 voto)
189 vistas65 páginasProcesos de Reducción
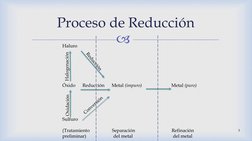
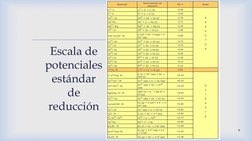
El documento describe los principios fundamentales de los procesos de reducción de óxidos, haluros, sulfuros y otros compuestos metálicos. Explica que la reducción consiste en transformar estos compuestos en metales puros mediante agentes reductores como el carbono, monóxido de carbono e hidrógeno. También cubre conceptos clave como la presión de equilibrio del oxígeno y los diagramas de energía libre-temperatura que gobiernan estas reacciones redox.
Cargado por
Daniel Eduardo Cortez GonzálezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (1 voto)
189 vistas65 páginasProcesos de Reducción
El documento describe los principios fundamentales de los procesos de reducción de óxidos, haluros, sulfuros y otros compuestos metálicos. Explica que la reducción consiste en transformar estos compuestos en metales puros mediante agentes reductores como el carbono, monóxido de carbono e hidrógeno. También cubre conceptos clave como la presión de equilibrio del oxígeno y los diagramas de energía libre-temperatura que gobiernan estas reacciones redox.
Cargado por
Daniel Eduardo Cortez GonzálezDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd