Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Números Cuánticos
Cargado por
esefany0 calificaciones0% encontró este documento útil (0 votos)
10 vistas10 páginasTítulo original
Números Cuánticos (1)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
10 vistas10 páginasNúmeros Cuánticos
Cargado por
esefanyCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 10
Números Cuánticos
Los números cuánticos
Los números cuánticos se denominan con las
letras n, m, l y s y nos indican la posición y la
energía del electrón. Ningún electrón de un
mismo átomo puede tener los mismos números
cuánticos.
Los números cuánticos son:
• Numero cuántico principal
• Numero cuántico secundario
• Numero cuántico magnético
• Numero cuántico de spin
Numero cuántico principal
Se representa con la letra n, indica el nivel de energía
donde se encuentra el electrón, asume valores
enteros positivos, del 1 al 7.
Dicho de otra manera el número cuántico principal
determina el tamaño de las órbitas, por tanto, la
distancia al núcleo de un electrón vendrá
determinada por este número cuántico.
Numero cuántico secundario
Se representa con la letra l, identifica al subnivel de
energía del electrón y se le asocia a la forma del orbital, los
cuales pueden ser s, p, d y f (0, 1, 2 y 3).
Sus valores dependen del número cuántico principal "n",
es decir, sus valores son todos los enteros entre 0 y (n-1),
incluyendo al 0. Ejemplo: n = 4; l = 0, 1, 2, 3.
Numero cuántico magnético
Se representa con la letra m, indica la orientación de los
orbitales de un mismo subnivel en el espacio. Esta
orientación espacial se representa en función de las
coordenadas x, y, z.
Asume valores del número cuántico secundario negativo
(-l) pasando por cero, hasta el número cuántico positivo
(+l). Ejemplo: Si n = 2, entonces l=n-1; l= 2-1; l= 1
l = 0, 1,
m = -1, 0, +1,
Por tanto, el orbital p, al que le corresponde la asignación
l= 1, tendrá tres orientaciones a saber: px, py , pz
Tipos de números cuántico magnético
Numero cuántico spin
Se representa con la letra s, que describe la orientación
del giro del electrón.
Un orbital puede albergar dos electrones como máximo;
por lo tanto, estos se diferencian entre sí por el sentido
del giro sobre su eje. Cuando dos electrones ocupan el
mismo orbital, sus sentidos de giro son opuestos.
Asume únicamente dos valores +1/2 y -1/2.
Distribución de los electrones en el átomo
La distribución de los electrones en los niveles y
subniveles, responde a los siguientes criterios:
• Cada tipo de nivel y subnivel puede tener un número determinado
de electrones.
• Cada subnivel tiene un determinado numero de orbitales.
• El valor de la energía de los electrones es diferente en cada
subnivel el orden es de menor a mayor energía y, por tanto, el
orden de llenado de los niveles y subniveles viene dado por las
flechas diagonales en el diagrama de Moller.
También podría gustarte
- Actividad 7 Números Cuánticos 2023Documento2 páginasActividad 7 Números Cuánticos 2023Para VpnAún no hay calificaciones
- Distribucion ElectronicaDocumento17 páginasDistribucion ElectronicaJulio TiradoAún no hay calificaciones
- 01 Distribución ElectrónicaDocumento28 páginas01 Distribución ElectrónicaDavid Calderon MamaniAún no hay calificaciones
- Mientras Que en El Modelo de Bohr Se Hablaba de Órbitas Definidas en El Modelo de Schrödinger Sólo Podemos Hablar de Las Distribuciones Probables para Un Electrón Con Cierto Nivel de EnergíaDocumento4 páginasMientras Que en El Modelo de Bohr Se Hablaba de Órbitas Definidas en El Modelo de Schrödinger Sólo Podemos Hablar de Las Distribuciones Probables para Un Electrón Con Cierto Nivel de EnergíaJesus Ramon Maravilla PeñaAún no hay calificaciones
- El Significado de Los Números Cuánticos EsDocumento1 páginaEl Significado de Los Números Cuánticos EsJuan PerezAún no hay calificaciones
- Distribucion ElectronicaDocumento17 páginasDistribucion ElectronicaVíctor Cárcamo EcheverríaAún no hay calificaciones
- El Modelo Atómico de SchrödingerDocumento4 páginasEl Modelo Atómico de SchrödingerAlberto De La Riva GarcíaAún no hay calificaciones
- Tarea Numeros CuanticosDocumento3 páginasTarea Numeros CuanticosJEISEN STIVEN CASTRO PAREDESAún no hay calificaciones
- 15 A Configuracion Electronica 1 PDFDocumento41 páginas15 A Configuracion Electronica 1 PDFusscoailAún no hay calificaciones
- Sesión 4 Números CuánticosDocumento47 páginasSesión 4 Números CuánticosJavl TW Inversiones DevalverdeAún no hay calificaciones
- Números CuánticosDocumento18 páginasNúmeros CuánticosItzel HidalgoAún no hay calificaciones
- Que Son Los Números CuánticosDocumento4 páginasQue Son Los Números CuánticosMoisesAún no hay calificaciones
- Los Números Cuánticos Se DenominanDocumento5 páginasLos Números Cuánticos Se DenominanManuel MendézAún no hay calificaciones
- Numeros Cuanticos y Orbitales AtomicosDocumento3 páginasNumeros Cuanticos y Orbitales AtomicosFaber PazAún no hay calificaciones
- Distribucion ElectronicaDocumento5 páginasDistribucion ElectronicaMillet ChasiAún no hay calificaciones
- Números CuánticosDocumento2 páginasNúmeros CuánticosJuampy Godoy GómezAún no hay calificaciones
- Los Números Cuánticos y Los OrbitalesDocumento3 páginasLos Números Cuánticos y Los OrbitalesAlison xFnxAún no hay calificaciones
- Qui MicaDocumento4 páginasQui MicaJuan BerlinAún no hay calificaciones
- Numeros Cuanticos (Clase 6)Documento5 páginasNumeros Cuanticos (Clase 6)Almonte NabilAún no hay calificaciones
- Números CuánticosDocumento2 páginasNúmeros CuánticosCarlosAlbertoArce50% (2)
- Números CuánticosDocumento4 páginasNúmeros CuánticosEduardo Zorrilla TarazonaAún no hay calificaciones
- Configuracion ElectronicaDocumento7 páginasConfiguracion ElectronicaNAHOMY ALEXANDRA MEZA ALFAROAún no hay calificaciones
- Química: Cuadro Comparativo de Números CuánticosDocumento2 páginasQuímica: Cuadro Comparativo de Números CuánticosEdgar Ramon Beltran LopezAún no hay calificaciones
- Números CuánticosDocumento16 páginasNúmeros CuánticosJuanmanuel ValderramaAún no hay calificaciones
- ADA 1 QuimicaDocumento8 páginasADA 1 QuimicaValente GunterAún no hay calificaciones
- Números Cuánticos y Configuración ElectrónicaDocumento4 páginasNúmeros Cuánticos y Configuración ElectrónicaOrozco Villegas ArlimAún no hay calificaciones
- Configuraciones Electrónicas y Los Números CuánticosDocumento5 páginasConfiguraciones Electrónicas y Los Números CuánticosKyara FrancoAún no hay calificaciones
- Orbitales y Configuración ElectrónicaDocumento7 páginasOrbitales y Configuración ElectrónicaDANIELA SIMONELLIAún no hay calificaciones
- QuimicaDocumento28 páginasQuimicaBritanny Itzury Guerrero MonroyAún no hay calificaciones
- Numeros CuanticosDocumento7 páginasNumeros CuanticosvictorAún no hay calificaciones
- Numeros CuanticosDocumento9 páginasNumeros CuanticosGabriellaAún no hay calificaciones
- Reglas de Distribución Electónica y Números CuánticosDocumento11 páginasReglas de Distribución Electónica y Números CuánticosCesar Danilo Garcia SosaAún no hay calificaciones
- Números CuánticosDocumento3 páginasNúmeros CuánticosRocío FloresAún no hay calificaciones
- Configuración ElectrónicaDocumento2 páginasConfiguración ElectrónicaWilson de LeónAún no hay calificaciones
- Los Números Cuánticos y La Configuración ElectrónicaDocumento3 páginasLos Números Cuánticos y La Configuración ElectrónicaJosé Luis RubíAún no hay calificaciones
- Configuración Electronica y Números CuánticosDocumento6 páginasConfiguración Electronica y Números Cuánticosbrayan borrayoAún no hay calificaciones
- 2 Teoria Est AtomicaDocumento9 páginas2 Teoria Est AtomicaCami Arce GariAún no hay calificaciones
- Guia de Estudio Configuración ElectronicaDocumento10 páginasGuia de Estudio Configuración ElectronicaPaula R. TarifeñoAún no hay calificaciones
- SommerfeldDocumento3 páginasSommerfeldAlberto RAAún no hay calificaciones
- N L M S: N Número Cuántico L Número Cuántico M Número Cuántico S Número CuánticoDocumento1 páginaN L M S: N Número Cuántico L Número Cuántico M Número Cuántico S Número CuánticoManAún no hay calificaciones
- Configuración ElectrónicaDocumento10 páginasConfiguración ElectrónicaJaime Borja SalazarAún no hay calificaciones
- Configuración Electrónica y Uniones Químicas PDFDocumento41 páginasConfiguración Electrónica y Uniones Químicas PDFRennaki EstudiosAún no hay calificaciones
- Adobe Scan 10 - 10 - 2022Documento8 páginasAdobe Scan 10 - 10 - 2022Hikary •Hashimoto•Aún no hay calificaciones
- Numeros CuanticosDocumento17 páginasNumeros CuanticosYesenia FernándezAún no hay calificaciones
- Niveles de EnergíaDocumento9 páginasNiveles de EnergíaDaniel Hernandez ClaroAún no hay calificaciones
- Numeros CuanticosDocumento2 páginasNumeros CuanticosMagda Lorena serranoAún no hay calificaciones
- Configuración Electrónica (O Periódica) : Modelo Atómico GeneralDocumento15 páginasConfiguración Electrónica (O Periódica) : Modelo Atómico GeneralDaimely GonzalezAún no hay calificaciones
- Clase CEDocumento4 páginasClase CEJulia FioranoAún no hay calificaciones
- Numeros CuanticosDocumento3 páginasNumeros CuanticosErick LopezAún no hay calificaciones
- Números Cuanticos y Configuración Electrónica PDVDocumento15 páginasNúmeros Cuanticos y Configuración Electrónica PDVPaula Astudillo VegaAún no hay calificaciones
- DiagonalesDocumento5 páginasDiagonalesfbian cirneAún no hay calificaciones
- Números CuánticosDocumento4 páginasNúmeros CuánticosLaura HerranzAún no hay calificaciones
- QuimicaDocumento12 páginasQuimicaAlondra PeraltaAún no hay calificaciones
- Configuracion ElectrónicaDocumento5 páginasConfiguracion ElectrónicaMercy JadiraAún no hay calificaciones
- Relación de La Ecuación de Schrodinger Con Los NúmerosDocumento2 páginasRelación de La Ecuación de Schrodinger Con Los NúmerosManuel Farrera67% (3)
- Sem 02 - Ses - 03 - Números Cuánticos y CEDocumento31 páginasSem 02 - Ses - 03 - Números Cuánticos y CEKARINA MILAGROS ALVARADO PEREZAún no hay calificaciones
- Configuracion ElectronicaDocumento11 páginasConfiguracion ElectronicaEusebio CaamalAún no hay calificaciones
- Tema 8 Numeros CuanticosDocumento11 páginasTema 8 Numeros CuanticosLópez Toral Alan OmarAún no hay calificaciones
- Unidad 2: Enlace Químico: IntroducciónDocumento19 páginasUnidad 2: Enlace Químico: IntroducciónMiguel Aaron Mascorro HernandezAún no hay calificaciones
- New Ex Princ Quimica I, 2023Documento1 páginaNew Ex Princ Quimica I, 2023esefanyAún no hay calificaciones
- Estructuras de ProgramaciónDocumento4 páginasEstructuras de ProgramaciónesefanyAún no hay calificaciones
- Investigacion Formativa - 3er ParcialDocumento1 páginaInvestigacion Formativa - 3er ParcialesefanyAún no hay calificaciones
- Pla MI ADocumento3 páginasPla MI AesefanyAún no hay calificaciones
- Matemática I - U - Iv - Calculo Diferencial - Varias VariablesDocumento16 páginasMatemática I - U - Iv - Calculo Diferencial - Varias VariablesesefanyAún no hay calificaciones
- Informe Fisica IsmaelDocumento6 páginasInforme Fisica IsmaelesefanyAún no hay calificaciones
- 620 Sel. Múltiple 02Documento83 páginas620 Sel. Múltiple 02esefanyAún no hay calificaciones
- PROGRAMACIONDocumento4 páginasPROGRAMACIONesefanyAún no hay calificaciones
- Resolución de Sistemas de Ecuaciones Lineales y Secuencias de Instrucción Basadas en Un Contexto de Soluciones QuímicasDocumento10 páginasResolución de Sistemas de Ecuaciones Lineales y Secuencias de Instrucción Basadas en Un Contexto de Soluciones QuímicasesefanyAún no hay calificaciones
- Trinomio Cuadrado Perfecto TCPDocumento1 páginaTrinomio Cuadrado Perfecto TCPesefanyAún no hay calificaciones
- Informe Grupo N°6 Viscosidad y DensidadDocumento14 páginasInforme Grupo N°6 Viscosidad y DensidadesefanyAún no hay calificaciones
- Prodcuto VectorialDocumento4 páginasProdcuto VectorialesefanyAún no hay calificaciones
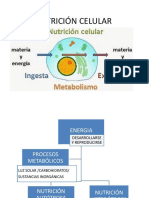
- Nutrición y Respiración CelularDocumento11 páginasNutrición y Respiración CelularesefanyAún no hay calificaciones
- FODADocumento15 páginasFODAesefanyAún no hay calificaciones
- Proyecto de VidaDocumento41 páginasProyecto de VidaesefanyAún no hay calificaciones
- CI17-Movimiento RectilíneoDocumento7 páginasCI17-Movimiento RectilíneoesefanyAún no hay calificaciones
- Operaciones Combinadas - Jerarquias de OperacionesDocumento1 páginaOperaciones Combinadas - Jerarquias de OperacionesesefanyAún no hay calificaciones
- Kendall Ryan - Roomates - 2. - The Play Mate PDFDocumento160 páginasKendall Ryan - Roomates - 2. - The Play Mate PDFesefanyAún no hay calificaciones
- Sexto Calentamiento GlobalDocumento1 páginaSexto Calentamiento GlobalesefanyAún no hay calificaciones
- Movimiento ParabolicoDocumento7 páginasMovimiento ParabolicoesefanyAún no hay calificaciones
- Ejercicios Análisis Dimensional CI-17Documento4 páginasEjercicios Análisis Dimensional CI-17esefanyAún no hay calificaciones
- Relacion y Funciones QDocumento4 páginasRelacion y Funciones QesefanyAún no hay calificaciones
- Producto EscalarDocumento3 páginasProducto EscalaresefanyAún no hay calificaciones
- Definición Característica y Estructura Textos AcadémicosDocumento39 páginasDefinición Característica y Estructura Textos AcadémicosesefanyAún no hay calificaciones
- Tierras RarasDocumento2 páginasTierras RarasesefanyAún no hay calificaciones
- Tessa Bailey - Line of Duty - 1.5. - Protecting Whta's TheirsDocumento46 páginasTessa Bailey - Line of Duty - 1.5. - Protecting Whta's TheirsesefanyAún no hay calificaciones
- Ecuaciones Lineales - Enteras y Fraccionarias, Literales, IrracionalesDocumento2 páginasEcuaciones Lineales - Enteras y Fraccionarias, Literales, IrracionalesesefanyAún no hay calificaciones
- ISOTOPOSDocumento1 páginaISOTOPOSesefanyAún no hay calificaciones
- 1.clase de Propiedades de Compuestos Orgánicos-Hibridación Del CarbonoDocumento34 páginas1.clase de Propiedades de Compuestos Orgánicos-Hibridación Del CarbonoJosué AraucoAún no hay calificaciones
- Color Olor y SaborDocumento5 páginasColor Olor y SaborAzul YotiAún no hay calificaciones
- Marco Teórico de Fréjol 2Documento10 páginasMarco Teórico de Fréjol 2Ari AVAún no hay calificaciones
- PSO Practicas Seguras de OperacionDocumento12 páginasPSO Practicas Seguras de OperacionDavid Zuñiga navarroAún no hay calificaciones
- AVITERA Brilliant Scarlet SEDocumento2 páginasAVITERA Brilliant Scarlet SEruestchivaAún no hay calificaciones
- AC500 2 84163 Part3 - EsDocumento436 páginasAC500 2 84163 Part3 - EsFlavio SignorelliAún no hay calificaciones
- Sesion 4 Ejercicios TermicosDocumento2 páginasSesion 4 Ejercicios TermicosGinoPizarroArellano100% (1)
- Terminal Maritimo MonteverdeDocumento5 páginasTerminal Maritimo MonteverdeAndrès Monge -JEANMIXER-Aún no hay calificaciones
- Manejo de La Fertirrigacion en ArandanoDocumento6 páginasManejo de La Fertirrigacion en Arandanogaso99Aún no hay calificaciones
- Introduccion A La Mecanica de Materiales - EjemplosDocumento27 páginasIntroduccion A La Mecanica de Materiales - EjemplosJuan Pablo GonzalezAún no hay calificaciones
- Cuidado de Columnas de HPLCDocumento50 páginasCuidado de Columnas de HPLCRulo Risculese100% (2)
- Resumen BiologiaDocumento37 páginasResumen BiologiavivianaAún no hay calificaciones
- Pasatiempos 7Documento5 páginasPasatiempos 7gema arribas lorenzoAún no hay calificaciones
- Ciencias de Los Materiales Clase 3Documento45 páginasCiencias de Los Materiales Clase 3Nancy VerdesotoAún no hay calificaciones
- Cromatografía Con Intercambio Iónico 1Documento12 páginasCromatografía Con Intercambio Iónico 1Victor CorreaAún no hay calificaciones
- Los Compuestos Qu MicosDocumento34 páginasLos Compuestos Qu MicosEdinson LaraAún no hay calificaciones
- Lab - 06 2017-1 Ensayos de MaterialesDocumento14 páginasLab - 06 2017-1 Ensayos de MaterialesClaudio Mateo Torres LizárragaAún no hay calificaciones
- TESISDocumento143 páginasTESISNICOLEASCAún no hay calificaciones
- Producto Académico #1 Ingenieria de MaterialesDocumento3 páginasProducto Académico #1 Ingenieria de MaterialesWilliam Walas Huillcara0% (1)
- Gasóleo B CepsaDocumento113 páginasGasóleo B Cepsanom cognomAún no hay calificaciones
- Ingmed - Manejo Recurso Agua en Ind CerveceraDocumento17 páginasIngmed - Manejo Recurso Agua en Ind Cerveceraluis andradeAún no hay calificaciones
- Quimica IV Sexto GranjitasDocumento7 páginasQuimica IV Sexto GranjitasMarco SuarezAún no hay calificaciones
- Medidas para Disminuir La Absorción de TóxicosDocumento5 páginasMedidas para Disminuir La Absorción de TóxicosKarina Jácome RuizAún no hay calificaciones
- AlotropíaDocumento15 páginasAlotropíaCarlos EliasAún no hay calificaciones
- Ley de La Conservación de La MateriaDocumento5 páginasLey de La Conservación de La MateriaRodrigo ACAún no hay calificaciones
- Cuestionario Agua Del SueloDocumento4 páginasCuestionario Agua Del SueloKathy CórdovaAún no hay calificaciones
- El CarbonDocumento35 páginasEl Carbonbrosben28Aún no hay calificaciones
- Calidad Lab 1 Normas de Seguridad Del Laboratorio de Calidad Del AguaDocumento13 páginasCalidad Lab 1 Normas de Seguridad Del Laboratorio de Calidad Del AguaJared AcostaAún no hay calificaciones
- Taller Edison Vs TeslaDocumento3 páginasTaller Edison Vs TeslaLeandro Agudelo GrisalesAún no hay calificaciones
- Paginas - PRÁCTICAS DE FARMACOGNOSIADocumento17 páginasPaginas - PRÁCTICAS DE FARMACOGNOSIALuis RamosAún no hay calificaciones
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (201)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Neurocuántica: La nueva frontera de la neurocienciaDe EverandNeurocuántica: La nueva frontera de la neurocienciaCalificación: 5 de 5 estrellas5/5 (1)
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Alimentación antiinflamatoria: Primeros pasos para poner en práctica una alimentación saludableDe EverandAlimentación antiinflamatoria: Primeros pasos para poner en práctica una alimentación saludableCalificación: 4.5 de 5 estrellas4.5/5 (119)
- Cardiología y enfermedades cardiovascularesDe EverandCardiología y enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDe EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)