0% encontró este documento útil (0 votos)
614 vistas10 páginasValidación HPLC de Atenolol
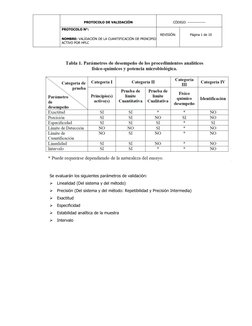
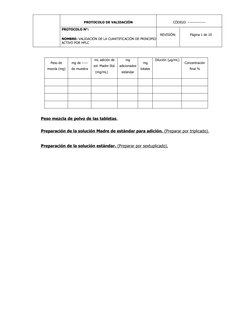
Este protocolo describe la validación del método cromatográfico de líquidos de alta resolución (HPLC) para cuantificar el principio activo atenolol en tabletas. Se evaluarán parámetros como la linealidad, precisión, exactitud y especificidad siguiendo criterios de aceptación establecidos. Se prepararán muestras sin adición y con adiciones estándar al 60%, 100% y 140% para determinar la linealidad, precisión y exactitud del método.
Cargado por
Florent TobarDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
614 vistas10 páginasValidación HPLC de Atenolol
Este protocolo describe la validación del método cromatográfico de líquidos de alta resolución (HPLC) para cuantificar el principio activo atenolol en tabletas. Se evaluarán parámetros como la linealidad, precisión, exactitud y especificidad siguiendo criterios de aceptación establecidos. Se prepararán muestras sin adición y con adiciones estándar al 60%, 100% y 140% para determinar la linealidad, precisión y exactitud del método.
Cargado por
Florent TobarDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd