Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Práctica 5. Determinacion Del Pka Del Ácido Acetilsalicílico
Cargado por
Kevin Alexis Madrigal HernandezDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Práctica 5. Determinacion Del Pka Del Ácido Acetilsalicílico
Cargado por
Kevin Alexis Madrigal HernandezCopyright:
Formatos disponibles
Determinación del pKa del ácido
acetilsalicílico
Resumen. Se realizaron experimentos para observar los factores que afectan en las reacciones químicas que
consisten en determina el pKa del ácido acetilsalicílico estableciendo experimentalmente la relación e
importancia del pKa en el proceso de absorción de un fármaco mediante la utilización de las 6 soluciones a
diferentes pH y su blanco respectivo, y se completó a 2ml posteriormente se determinó la absorbancia de cada
una de las 6 soluciones. El método consiste en determinar la relación entre la especie ionizada y la no
ionizada utilizando soluciones amortiguadoras a diferentes pH, con respecto al pH de partición las membranas
biológicas son permeables a la forma no ionizada del fármaco si ésta es lo suficientemente liposoluble, pero
son no permeables a la especie ionizada, de manera que sólo el fármaco no ionizado podrá pasar a través de la
membrana mediante un proceso de difusión pasiva y al alcanzar el equilibrio.
Palabras clave: pKa, ácido acetilsalicílico, pH, fármaco.
Introducción disocian parcialmente. Cuando un ácido
se disocia, libera un protón para hacer que
La constante pKa es una medida de la
la solución sea ácida, pero los ácidos
acidez de una sustancia obtenida a partir
débiles tienen tanto un estado disociado
del logaritmo negativo de su constante de
(A -) como un estado no disociado (AH)
disociación ácida Ka. El valor pKa es una
que coexisten de acuerdo con la siguiente
versión útil de la constante Ka ya que
ecuación de equilibrio de disociación
evita el uso de potencias de diez
(Shimadzu, 2019). El método consiste en
(Quimicas, 2015). Cuanto menor es el
determinar la relación entre la especie
valor de pKa, más fuerte es el ácido. Un
ionizada y la no ionizada utilizando
ejemplo es el pKa del ácido acético (4.8),
soluciones amortiguadoras a diferentes
mientras que el pKa del ácido láctico es
pH. Para ello es necesario establecer la
3.8. Usando los valores de pKa, se puede
longitud de onda de máxima absorción
ver que el ácido láctico es un ácido más
del fármaco para determinar sus valores
fuerte que el ácido acético. El pKa se
de absorbancia en las soluciones
utiliza porque describe la disociación
amortiguadoras y así calcular la relación
ácida usando números decimales
entre las especies. En el caso de ácido
pequeños. El mismo tipo de información
acetilsalicílico se trata de un ácido débil
se puede obtener de los valores de Ka,
cuyo equilibrio ácido-base y el balance de
pero normalmente son números
masa está interpretado por:
extremadamente pequeños dados en
notación científica que son difíciles de HA = A- + H-
entender para la mayoría de las personas
Cuya constante es:
(Marie, 2019). Los ácidos incluyen ácidos
fuertes, que se disocian completamente en Ka = [A-] [H-]
agua, y ácidos débiles, que solo se
[HA] 5 200 µl ---
6 200 µl ---
Por lo que pH: Blanco 1 0 200µl
pH = pKa + log [A-] Blanco 2 0 120µl
Blanco 3 0 40 µl
[HA] Blanco 4 0 ---
Blanco 5 0 ---
En el caso de que [A-] = [HA], el pH =
Blanco 6 0 ---
pKa
Objetivos
Para las soluciones de trabajo se utilizó la
Determinar el pKa del ácido solución de KCl 2M previamente
acetilsalicílico. preparada para las demás soluciones se
realizó lo siguiente:
Establecer experimentalmente la
relación en importancia del pKa Tabla 2
en el proceso de absorción de un Solución pH Solución pH NaOH
fármaco. 4.6 9.2 0.1M
--- --- ---
Hipótesis --- --- ---
--- --- ---
Mediante espectrofotometría UV se
200 µl --- ---
determinada el pKa del ácido
200 µl --- 120 µl
acetilsalicílico reportado en la literatura
--- 200 µl ---
que es 3.5
--- --- ---
Metodología --- --- ---
--- --- ---
Se utilizo 6 soluciones a diferentes pH 200 µl --- ---
con su blanco respectivo, de acuerdo con 200 µl --- 120 µl
la tabla 1, y se completar a 2ml. --- 200 µl ---
Posteriormente se leyó en el
espectrofotómetro, y los espectros UV-
Vis de la solución 1 (forma ácida con pH
de 2.0) y de la solución 6 (forma básica Tabla 3
con pH 8.4) ajustado con sus blancos
KCl 2M Agua dest. pH final
respectivos.
1000µl 600 µl 2
Tabla1 1000µl 680 µl 2.4
1000µl 760 µl 3.1
Solución AAS HCL 0.1M
1000µl 600 µl 4.6
250ug/ml
1 200µl 200µl 1000µl 480 µl 5
2 200 µl 120µl 1000µl 600 µl 8.4
3 200 µl 40 µl 1000µl 800 µl 2
4 200 µl --- 1000µl 880 µl 2.4
1000µl 960 µl 3.1
1000µl 800 µl 4.6 3 0.215
1000µl 680 µl 5 4 0.281
1000µl 800 µl 8.4 5 0.150
Se encendió 30 minutos antes el
espectrofotómetro UV-Vis. Luego de ese
tiempo se leyeron los espectros de la
solución 1 y 6, ajustando con sus
respectivos blancos, las longitudes de
onda para las lecturas fueron de 250, 260,
270, 280, 290, 300, 310 y 320 nm.
Después se eligió la longitud de onda
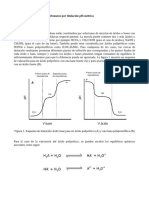
máxima de absorción, esta fue de 250 nm. Figura 2. Esquema de pH vs absorbancia de cada
solución.
Al final se ajustó el espectrofotómetro en
la longitud de onda máxima que Aplicando la siguiente formula se obtiene
previamente se eligió para determinar la el valor de pH del acido acetilsalicílico.
absorbancia de las soluciones 2, 3, 4 y 5. Únicamente se extrapola el valor de la
absorbancia con el pH en la figura 2.
Resultados
el cual corresponde al valor del pKa del
ácido acetilsalicílico
( absorbanciade laespecie ácida +absorbacia de la espeic
A=
2
0.156 +0.371
A= =0.26
2
Absorbancia a la cual se encuentra el 50%
Figura 1. Espectro de absorción de la solución 1 y en forma ionizada y no ionizada
6. *Nota. La línea azul pertenece a la solución 1 y la respectivamente, por lo que el pH es igual
naranja a la solución 6.
al pKa.
Las lecturas de absorbancia de las
siguientes soluciones se realizarán en 250 Discusión
nm debido a que es la longitud de onda El método consiste en determinar la
máxima de absorción. relación entre la especie ionizada y la no
Tabla 4 ionizada utilizando soluciones
amortiguadoras a diferentes pH. Para ello
Valores de absorbancia a 250 nm de las es necesario establecer la longitud de
soluciones restantes onda de máxima absorción del fármaco
Solución Absorbancia para determinar sus valores de
2 0.315 absorbancia en las soluciones
amortiguadoras y así calcular la relación factores para poder homogenizar y así
entre las especies. En el caso de ácido mismo obtener resultados concretos y
acetilsalicílico se trata de un ácido débil seguros, factores como tiempo de toma
cuyo equilibrio ácido-base. El pKa de muestras , tipo de fármaco o marca o
determinado experimentalmente fue de 5 vía de administración, cantidad de
y no como lo reporta la literatura de 3.5, medicamentos que se va a administrar , y
esto no causa ningún problema por que el analizar si el paciente a ingerido
pka 5 aun sigue dentro del rango de ácido previamente otros medicamentos que
débil, esta variación puede deberse a puedan afectar o intervenir en el proceso
factores como: usar un medicamento de absorción o metabolismo de
similar a la aspirina de Bayer® o algún medicamento en concreto estudiado y así
medicamento que puede contener otro mismo afectar la muestra obtenida por el
principio activo como la cafiaspirina. paciente, así mismo prevenir los factores
Para aquellos medicamentos en que los fisiológicos que modifican el LADME.
principios activos son sales de ácidos o
Cuestionario
bases fuertes, su elevada ionización es un
obstáculo para su difusión a través de la ¿Qué es el pka?
membrana, por el contrario, en los ácidos
El pKa de una sustancia es el pH al que
o bases débiles poco ionizados, la
una sustancia tiene la mitad de sus
difusión dependerá de su liposolubilidad
moléculas ionizadas y la otra mitad sin
y de la forma ionizada.
ionizar. Es una situación estable que nos
Conclusión da información sobre la capacidad del
fármaco para atravesar de forma pasiva
Con respecto al pH de partición las
las membranas.
membranas biológicas son permeables a
la forma no ionizada del fármaco si ésta ¿Qué relación hay entre pKa y pH?
es lo suficientemente liposoluble, pero
Un ácido fuerte presenta un valor de pKa
son no permeables a la especie ionizada,
bajo.
de manera que sólo el fármaco no
ionizado podrá pasar a través de la Un ácido débil presenta un valor de pKa
membrana mediante un proceso de alto.
difusión pasiva y al alcanzar el equilibrio.
El método consiste en determinar la
relación entre la especie ionizada y la no
ionizada utilizando soluciones
amortiguadoras a diferentes pH. Es de
igual importancia poder controlar los Bibliografía
Marie, A. (11 de noviembre de 2019). marzo de 2021, de pKa Definition
ThoughtCo. Recuperado el 13 de in Chemistry:
https://www.thoughtco.com/what- Shimadzu. (2019). Shimadzu Excellence
is-pka-in-chemistry-605521 in Science. Recuperado el 13 de
marzo de 2021, de pKa and
Quimicas. (mayo de 2015). Químicas.
Dissociation Equilibrium:
Recuperado el 13 de marzo de
https://www.shimadzu.com/an/ser
2021, de Definición de pKa:
vice-support/technical-support/ana
https://www.quimicas.net/2015/05
lysis-basics/basic/29/29intro.html
/definicion-de-pka.html
También podría gustarte
- Guia de Trabajos Practicos 01 - Introduccion A Transferencia de MasaDocumento4 páginasGuia de Trabajos Practicos 01 - Introduccion A Transferencia de MasaXiime WalburgAún no hay calificaciones
- Numero de ReynoldsDocumento9 páginasNumero de ReynoldsibbsAún no hay calificaciones
- ReporteDocumento6 páginasReportejazdany santanaAún no hay calificaciones
- Problemario 2 Capítulo 7 y 12Documento3 páginasProblemario 2 Capítulo 7 y 12Karim 'SolizAún no hay calificaciones
- EjerciciosDocumento2 páginasEjerciciosLuisa TorresAún no hay calificaciones
- Estudio de fenómenos de sólidos expuestos a condiciones ambientalesDocumento9 páginasEstudio de fenómenos de sólidos expuestos a condiciones ambientalesDewin Marquez PoloAún no hay calificaciones
- Práctica 7 Cromatografia Santiago Tamayo y Estefania RojasDocumento5 páginasPráctica 7 Cromatografia Santiago Tamayo y Estefania RojasEstefania Rojas RayoAún no hay calificaciones
- Práctica No. 8 Estudio Farmacocinético de Safranina Mediante La Utilización de Un Modelo Físico Representativo de Administración IntravenosaDocumento5 páginasPráctica No. 8 Estudio Farmacocinético de Safranina Mediante La Utilización de Un Modelo Físico Representativo de Administración IntravenosaKevin Alexis Madrigal HernandezAún no hay calificaciones
- Informe EntalpiaDocumento16 páginasInforme EntalpiaMary_Coll03Aún no hay calificaciones
- Práctica 3. Cinética Farmacológica Absorción Del Ácido AcetilsalicílicoDocumento6 páginasPráctica 3. Cinética Farmacológica Absorción Del Ácido AcetilsalicílicoKevin Alexis Madrigal HernandezAún no hay calificaciones
- P3 - FQFDocumento3 páginasP3 - FQFDalia Candela SalazarAún no hay calificaciones
- LABORATORIO 1 Cromatografia de Exclusión BQ IDocumento2 páginasLABORATORIO 1 Cromatografia de Exclusión BQ IJaviera CaneloAún no hay calificaciones
- Simulación de Preparación de Una Rata Anestesiada en Diferentes Condiciones y Administración de Diferentes Fármacos Con Efecto Sobre Sistema CardiovascularDocumento5 páginasSimulación de Preparación de Una Rata Anestesiada en Diferentes Condiciones y Administración de Diferentes Fármacos Con Efecto Sobre Sistema CardiovascularKevin Alexis Madrigal HernandezAún no hay calificaciones
- CARTEL de La Práctica 4, NRC 13959Documento1 páginaCARTEL de La Práctica 4, NRC 13959Berenice Sanchez GalindoAún no hay calificaciones
- (QO3) Práctica 3 - Síntesis de Fenolftaleína (20-20)Documento4 páginas(QO3) Práctica 3 - Síntesis de Fenolftaleína (20-20)Vanessa SamaniegoAún no hay calificaciones
- Validación de hierro en aguaDocumento5 páginasValidación de hierro en aguaJhoam S CorreaAún no hay calificaciones
- Separación de aminoácidos por cromatografía en capa finaDocumento3 páginasSeparación de aminoácidos por cromatografía en capa finaMariaFernandaAcevedoOrtizAún no hay calificaciones
- Reporte DepuracionDocumento6 páginasReporte DepuracionJose Raul Lizardi ResendizAún no hay calificaciones
- Pract 3 AaaDocumento8 páginasPract 3 AaaDavid GarciaAún no hay calificaciones
- Benzo Cain ADocumento11 páginasBenzo Cain ALaura Vera SarriaAún no hay calificaciones
- Laboratorio 3 QS - Sintesis AspirinaDocumento7 páginasLaboratorio 3 QS - Sintesis AspirinaBren AcAún no hay calificaciones
- Cuestionario Quimica Analitica 2Documento29 páginasCuestionario Quimica Analitica 2ttattalittaAún no hay calificaciones
- Experimento de ChaplinDocumento5 páginasExperimento de ChaplinCrisSotoAún no hay calificaciones
- 2 - DET CAFEÍNAespectrosUV-VisDocumento30 páginas2 - DET CAFEÍNAespectrosUV-VisMariana PerezAún no hay calificaciones
- La AcetanilidaDocumento5 páginasLa Acetanilidadilmer salcedo0% (1)
- Apuntes y Tablas Técnicas EspectroscópicasDocumento16 páginasApuntes y Tablas Técnicas EspectroscópicasjulioAún no hay calificaciones
- Laboratorio #5 EstereoisomeríaDocumento19 páginasLaboratorio #5 EstereoisomeríaLeticia Arauz50% (2)
- Determinación de Indices en Grasas y Aceites Modificada 22-05-014Documento5 páginasDeterminación de Indices en Grasas y Aceites Modificada 22-05-014Santiago GomezAún no hay calificaciones
- Informe Practica 2 CromatografiaDocumento4 páginasInforme Practica 2 CromatografiaEstefa ValenciaAún no hay calificaciones
- AlmidónDocumento15 páginasAlmidónNathalia MojicaAún no hay calificaciones
- Práctica 10. FisicoquímicaDocumento10 páginasPráctica 10. FisicoquímicaEfraínAún no hay calificaciones
- Practica FinalDocumento3 páginasPractica FinalMILENKA YOMAR MONTEALEGRE SARZURIAún no hay calificaciones
- Informe N°1 Fisicoquimica 2Documento8 páginasInforme N°1 Fisicoquimica 2quimicoAún no hay calificaciones
- Fabricación y control de tabletasDocumento4 páginasFabricación y control de tabletasJose Luis AroAún no hay calificaciones
- Ooooorganica de AlquilosDocumento1 páginaOoooorganica de AlquilosElizabeth AngaritaAún no hay calificaciones
- 359060-Article Text-517304-1-10-20190705Documento9 páginas359060-Article Text-517304-1-10-20190705SinaiTresAún no hay calificaciones
- PRACTICA NO 4 Soluciones ReguladorasDocumento16 páginasPRACTICA NO 4 Soluciones ReguladorasManuel GorgônioAún no hay calificaciones
- Laboratorio 1. Fraccionamiento de Tejidos (Versión Final) - Agroindustrial PDFDocumento4 páginasLaboratorio 1. Fraccionamiento de Tejidos (Versión Final) - Agroindustrial PDFAndres Hurtado Saenz0% (4)
- Fabricación de Gel de Benzocaina y MentolDocumento3 páginasFabricación de Gel de Benzocaina y MentolEfrero RochyAún no hay calificaciones
- Problemas para Resolver (2008) 1-3-4-5-7-9-10-12-13-14-1Documento5 páginasProblemas para Resolver (2008) 1-3-4-5-7-9-10-12-13-14-1MAGYTACAISAPANTAAún no hay calificaciones
- Preparacion de Las Practicas de Laboratiorio Inorganica Ii PDFDocumento34 páginasPreparacion de Las Practicas de Laboratiorio Inorganica Ii PDFMONROY RAMIREZ ANDRES FELIPEAún no hay calificaciones
- Micromeritic ADocumento6 páginasMicromeritic A'Clära AcevedoAún no hay calificaciones
- QM AmoxicilinaDocumento14 páginasQM AmoxicilinaGerifalte100% (1)
- Métodos Generales de AnálisisDocumento3 páginasMétodos Generales de AnálisisItz CorAún no hay calificaciones
- Trimetoprima SulfametoxazolDocumento4 páginasTrimetoprima SulfametoxazolJacky DeanAún no hay calificaciones
- Hidrólisis Enzimática Del Gluten de Trigo Por Proteasas y Propiedades de Los Hidrolizados Resultantes - ScienceDirectDocumento12 páginasHidrólisis Enzimática Del Gluten de Trigo Por Proteasas y Propiedades de Los Hidrolizados Resultantes - ScienceDirectKatherine Rocio Obeid ManjarrezAún no hay calificaciones
- Capacidad Dielectrica de Algunos DisolventesDocumento3 páginasCapacidad Dielectrica de Algunos DisolventesLionerys Niels Diaz MarinAún no hay calificaciones
- Destilacion A Presion ReducidaDocumento4 páginasDestilacion A Presion ReducidaCarlos0% (1)
- Control de Calidad de Ácido FólicoDocumento2 páginasControl de Calidad de Ácido FólicoAQüa Serënaa RogaäAún no hay calificaciones
- Informe de Laboratorio - Titulación de Soluciones - Equipo 2Documento16 páginasInforme de Laboratorio - Titulación de Soluciones - Equipo 2Adrian BautistaAún no hay calificaciones
- Informe de Instrumental Vit CDocumento8 páginasInforme de Instrumental Vit CCristian HernándezAún no hay calificaciones
- Determinación de calcio en cáscara de huevo mediante titulación con EDTADocumento2 páginasDeterminación de calcio en cáscara de huevo mediante titulación con EDTAlaura zabalaAún no hay calificaciones
- Fenol AguaDocumento5 páginasFenol AguaBRISA YAMILETH COLIN JIMENEZAún no hay calificaciones
- Taller Poblacion BacterianaDocumento3 páginasTaller Poblacion BacterianaLAURA DANIELA BUSTOS ZAMBRANOAún no hay calificaciones
- 5Documento9 páginas5anon_351735045Aún no hay calificaciones
- Problemas de soluciones ácidas y básicas para Análisis FarmacéuticoDocumento68 páginasProblemas de soluciones ácidas y básicas para Análisis FarmacéuticoEstefany GuerreroAún no hay calificaciones
- Análisis de carbonatos y bicarbonatos por titulación pH-métricaDocumento4 páginasAnálisis de carbonatos y bicarbonatos por titulación pH-métricaFranklin Pastrana ArteagaAún no hay calificaciones
- Titulación potenciométrica de haluros usando Ag+ para determinar KCl y KIDocumento7 páginasTitulación potenciométrica de haluros usando Ag+ para determinar KCl y KICamilo DiazAún no hay calificaciones
- Curvas de Titulación de AminoácidosDocumento3 páginasCurvas de Titulación de AminoácidosGuaris Abreu Hernández100% (14)
- P2 - Determinación de PkaDocumento4 páginasP2 - Determinación de PkaAquiles CastroAún no hay calificaciones
- Informe Azul de BromotimolDocumento10 páginasInforme Azul de BromotimolJuan Andrés O. PérezAún no hay calificaciones
- Curvas de Titulacion de Aminoacidos Determinacion de Valores de PKDocumento8 páginasCurvas de Titulacion de Aminoacidos Determinacion de Valores de PKadan2010Aún no hay calificaciones
- Virtual CatDocumento5 páginasVirtual CatKevin Alexis Madrigal HernandezAún no hay calificaciones
- Simulación de Respuestas Farmacológicas de Explantes y Órganos de Diverso Origen en Condiciones de CultivoDocumento4 páginasSimulación de Respuestas Farmacológicas de Explantes y Órganos de Diverso Origen en Condiciones de CultivoKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 7 Determinación Del Factor de Similitud A Partir Del Perfil de Disolución Del Ácido Acetilsalicílico en Tabletas Comerciales de 500 MGDocumento5 páginasPráctica No. 7 Determinación Del Factor de Similitud A Partir Del Perfil de Disolución Del Ácido Acetilsalicílico en Tabletas Comerciales de 500 MGKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica 2. Vías de AdministraciónDocumento5 páginasPráctica 2. Vías de AdministraciónKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica 4. Cinética Farmacológica Excresion Del Ácido AcetilsalicílicoDocumento5 páginasPráctica 4. Cinética Farmacológica Excresion Del Ácido AcetilsalicílicoKevin Alexis Madrigal HernandezAún no hay calificaciones
- Practica 6. Determinacion Del Coeficiente de Particion Del Salicilato de SodioDocumento6 páginasPractica 6. Determinacion Del Coeficiente de Particion Del Salicilato de SodioKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 8 Balance Hidroeléctrico y Equilibrio Acido-BaseDocumento3 páginasPráctica No. 8 Balance Hidroeléctrico y Equilibrio Acido-BaseKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 11 Determinación Sérica de Urea.Documento2 páginasPráctica No. 11 Determinación Sérica de Urea.Kevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica 1. Conocimiento de La Norma Oficial Mexicana NOM-062-ZOO-1999Documento7 páginasPráctica 1. Conocimiento de La Norma Oficial Mexicana NOM-062-ZOO-1999Kevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 5 Proteínas PlasmáticasDocumento4 páginasPráctica No. 5 Proteínas PlasmáticasKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No.10 Perfil Del Funcionamiento CardiovascularDocumento2 páginasPráctica No.10 Perfil Del Funcionamiento CardiovascularKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No.9 Valoración Bioquímica de La Función Hepática y BiliarDocumento3 páginasPráctica No.9 Valoración Bioquímica de La Función Hepática y BiliarKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 6 Alteraciones Del Metabolismo de Los CarbohidratosDocumento6 páginasPráctica No. 6 Alteraciones Del Metabolismo de Los CarbohidratosKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 7 Lipoproteínas PlasmáticasDocumento3 páginasPráctica No. 7 Lipoproteínas PlasmáticasKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 3 Estudio de La Variación en Condiciones de RutinaDocumento4 páginasPráctica No. 3 Estudio de La Variación en Condiciones de RutinaKevin Alexis Madrigal HernandezAún no hay calificaciones
- Práctica No. 4 Toma y Manejo de Muestras de LaboratorioDocumento6 páginasPráctica No. 4 Toma y Manejo de Muestras de LaboratorioKevin Alexis Madrigal HernandezAún no hay calificaciones
- Q - AESM - Dom - Sem 05Documento2 páginasQ - AESM - Dom - Sem 05Eduardo Herrera XDAún no hay calificaciones
- Formacion de EspumaDocumento3 páginasFormacion de EspumaSaul VelizAún no hay calificaciones
- Grupo 14 de La Tabla PeriodicaDocumento26 páginasGrupo 14 de La Tabla PeriodicaDaniela Barrera100% (1)
- Cuarta PracticaDocumento3 páginasCuarta PracticaWillan Cueva Rodriguez100% (1)
- TPE Geometria Molecular GrabaciónDocumento60 páginasTPE Geometria Molecular GrabaciónGerardo PelAún no hay calificaciones
- Semana 4 5 Termodinamica Ley Cero 1ra Ley de La Termodinamica Entalpia Trabajo Energia InternaDocumento79 páginasSemana 4 5 Termodinamica Ley Cero 1ra Ley de La Termodinamica Entalpia Trabajo Energia InternaDavid AriasAún no hay calificaciones
- 5to Repaso 48Documento9 páginas5to Repaso 48Celeste SalvatierraAún no hay calificaciones
- Composición Centesimal para Primero de SecundariaDocumento3 páginasComposición Centesimal para Primero de SecundariaAnonymous wQ4ReuHAún no hay calificaciones
- Química I U2Documento40 páginasQuímica I U2On Binjuu xdAún no hay calificaciones
- AlcanosDocumento24 páginasAlcanosJuan Gallardo GarcíaAún no hay calificaciones
- Semana 4. Nomenclatura FAEDISDocumento14 páginasSemana 4. Nomenclatura FAEDISMateo LopezAún no hay calificaciones
- Semana 9 - Electroquímica y Celda GalvánicaDocumento15 páginasSemana 9 - Electroquímica y Celda GalvánicathaliaAún no hay calificaciones
- Practica N°8Documento10 páginasPractica N°8AdrianoAún no hay calificaciones
- Balance energético de procesos bioquímicosDocumento4 páginasBalance energético de procesos bioquímicosDiana CamposAún no hay calificaciones
- Actividad Integradora 1 Modulo 12Documento5 páginasActividad Integradora 1 Modulo 12yo jeirersAún no hay calificaciones
- 8 Determinacion de Gamma Del AireDocumento6 páginas8 Determinacion de Gamma Del AireMauricio Montaño Saavedra50% (4)
- C Previo12Documento7 páginasC Previo12Andres ocampo alvarezAún no hay calificaciones
- Ley de Henry y Ley de FickDocumento10 páginasLey de Henry y Ley de FickAna HernándezAún no hay calificaciones
- Caldera de Pie Elba Dual Es - NeutroDocumento6 páginasCaldera de Pie Elba Dual Es - NeutroCoco GalindoAún no hay calificaciones
- Ley Energía TermodinámicaDocumento5 páginasLey Energía TermodinámicaA.Aún no hay calificaciones
- Prácticas Q.I DescriptivaDocumento36 páginasPrácticas Q.I DescriptivaBrayan Alexis CeballosAún no hay calificaciones
- Clase 1 (Dr. Ponce) - Fisicoquímica IIDocumento14 páginasClase 1 (Dr. Ponce) - Fisicoquímica IIWilliam EspinozaAún no hay calificaciones
- Tema 4 3 CALCULO DE EVAPORADORES DE UN SOLO EFECTODocumento5 páginasTema 4 3 CALCULO DE EVAPORADORES DE UN SOLO EFECTOCarlos Av.Aún no hay calificaciones
- Destilación SimpleDocumento15 páginasDestilación SimpleALBA GUTIÉRREZ MELLADOAún no hay calificaciones
- Química - Semana 1 - PDocumento6 páginasQuímica - Semana 1 - PNILTON HUAMANAún no hay calificaciones
- Taller Enlace QuimicoDocumento6 páginasTaller Enlace QuimicoKatakuri CaceresAún no hay calificaciones
- Ficha Tecnica Truper 0.5 Tipo LDocumento2 páginasFicha Tecnica Truper 0.5 Tipo LChristian PumaAún no hay calificaciones
- Preguntas Fenomenos de TransporteDocumento2 páginasPreguntas Fenomenos de Transportemauricio ortegaAún no hay calificaciones
- Ejercicios para ResolverDocumento5 páginasEjercicios para ResolverHakuna MatataAún no hay calificaciones