Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Calculos Mateo
Cargado por
Laura Arias Manco0 calificaciones0% encontró este documento útil (0 votos)
12 vistas2 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
12 vistas2 páginasCalculos Mateo
Cargado por
Laura Arias MancoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
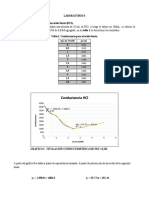
CALCULOS
50 ml de agua potable 50 ml de agua potable
pH=10 pH=12 NaOH (1ml)
Indicador N.E.T Indicador murexida
Dureza total CaC O3
n
M= → n=M ∗V
V
n EDTATotal =M∗V =( 0.1 M ) ( 5 ×10 L ) =5 ×10 moles totales de EDTA para consumir los iones de Ca
2+ ¿¿
−4 −5 2+¿ y Mg ¿
Para la segunda muestra se le agrega NaOH, para precipitar al Mg y en la muestra solo va a
quedar Ca2+¿ ¿.
Aquí como la relación de EDTA y Ca2+¿ ¿ van a ser igual tenemos:
n EDTA =n Ca
2+¿ ¿
= M∗V =( 0.1 M ) ( 1 ×10−4 L ) =1× 10−5 moles Ca2+¿ ¿
Para hallar las n de Mg 2+¿¿, tenemos:
−5 −5 −5 2+¿ ¿
2+ ¿=5 ×10 −1 ×10 =4 ×10 moles Mg ¿
2+¿=nTotal −n Ca ¿
n Mg
Para calcular la dureza total tenemos:
mgCaC O3 V EDTA∗M ∗100000
=
L V muestra
mgCaC O 3 ( 0.5 ml )∗( 0.1 )∗(100000) mgCaC O3
= =100
L 50 L
mgCaC O 3
Se puede decir que dicha agua no es pesada, ya que no pasa de 300
L
Dureza cálcica Ca2+¿ ¿
Murexida + Ca + EDTA → EDTA-Ca + Murexida
Rosado Morado
mgCaC O3 V EDTA∗M EDTA∗100000
=
L V muestra
mgCaC O 3 ( 0.1 ml )∗( 0.1 )∗(100000) mgCaC O3
= =2 0
L 50 L
También podría gustarte
- Laboratorio Nº9 - Valoración y Preparación EDTA 0.01000M - Nestor Sanchez AlfaroDocumento10 páginasLaboratorio Nº9 - Valoración y Preparación EDTA 0.01000M - Nestor Sanchez AlfaroNéstor Juan Sánchez Alfaro0% (1)
- Determinacion de CA en Una Calisa (Dirigido A Bacteriologia)Documento7 páginasDeterminacion de CA en Una Calisa (Dirigido A Bacteriologia)Kevin MuñozAún no hay calificaciones
- DETERMINACION DE Ca EN UNA CALIZADocumento4 páginasDETERMINACION DE Ca EN UNA CALIZASOFIA MELENDEZ RODRIGUEZAún no hay calificaciones
- Evidencia 8 Respuesta A Preguntas Sobre Volumetrías de Formación de ComplejosDocumento3 páginasEvidencia 8 Respuesta A Preguntas Sobre Volumetrías de Formación de ComplejosDavid Cubillos GómezAún no hay calificaciones
- Laboratorio 3Documento12 páginasLaboratorio 3CAROLINA SALCEDO PORTILLAAún no hay calificaciones
- Problemas Resueltos 06 Volumet ComplejosDocumento12 páginasProblemas Resueltos 06 Volumet ComplejosMar YAún no hay calificaciones
- Practica N°9 (Lab. Química Analitica)Documento18 páginasPractica N°9 (Lab. Química Analitica)jacqueline mamaniAún no hay calificaciones
- Calculos Analitica 5 Ultima Edicion Rrr-1Documento9 páginasCalculos Analitica 5 Ultima Edicion Rrr-1Laura Arias MancoAún no hay calificaciones
- Laboratorio No. 5Documento7 páginasLaboratorio No. 5Jose Santodomingo PoloAún no hay calificaciones
- 1 Informe EdtaDocumento9 páginas1 Informe EdtaAnita UshiñaAún no hay calificaciones
- 1 Informe EdtaDocumento9 páginas1 Informe EdtaAnita UshiñaAún no hay calificaciones
- ISOTERMASDocumento10 páginasISOTERMASangeloAún no hay calificaciones
- Determinación de La Dureza Del Agua.Documento11 páginasDeterminación de La Dureza Del Agua.Keren Parejo YepesAún no hay calificaciones
- Info 8 AnaliticaDocumento3 páginasInfo 8 AnaliticaAndres QuinteroAún no hay calificaciones
- Info 8 AnaliticaDocumento3 páginasInfo 8 AnaliticaAndres QuinteroAún no hay calificaciones
- Vol Complejometría EjjerciciDocumento6 páginasVol Complejometría EjjerciciPiter Ortega MuñozAún no hay calificaciones
- Lab 6Documento5 páginasLab 6Johanna GalanAún no hay calificaciones
- Informe 1 Cuanti 2Documento7 páginasInforme 1 Cuanti 2Less ÁvilaAún no hay calificaciones
- DETERMINACIÓN DE CALCIO POR COMPLEXOMETRIA (Grupo 2) NOTADocumento5 páginasDETERMINACIÓN DE CALCIO POR COMPLEXOMETRIA (Grupo 2) NOTASOFIA MELENDEZ RODRIGUEZAún no hay calificaciones
- Practica 3 PREPARACION Y VALORACION DEL TITULANTEDocumento2 páginasPractica 3 PREPARACION Y VALORACION DEL TITULANTEAntonio HernandezAún no hay calificaciones
- Cálculo DurezaDocumento3 páginasCálculo DurezaMaria FernandaAún no hay calificaciones
- Informe de AlcalimetríaDocumento12 páginasInforme de AlcalimetríaAlejandraAún no hay calificaciones
- Datos Calculos y Resultados P9Documento7 páginasDatos Calculos y Resultados P9Torres Mark AntonioAún no hay calificaciones
- Objetivos:: Determinacion de La Dureza Del AguaDocumento4 páginasObjetivos:: Determinacion de La Dureza Del AguaCr CrAún no hay calificaciones
- Informe N°9 Quimica Analitica Cuantitativa Dureza Del AguaDocumento14 páginasInforme N°9 Quimica Analitica Cuantitativa Dureza Del Aguaemilyvivancocuba100% (1)
- T4 Tarea Indv. 1Documento3 páginasT4 Tarea Indv. 1Alexis CushicondorAún no hay calificaciones
- Determinacion de Calcio y MagnesioDocumento6 páginasDeterminacion de Calcio y MagnesioIzumi IshigamiAún no hay calificaciones
- Calculos Analitica 5 Ultima Edicion RRRDocumento8 páginasCalculos Analitica 5 Ultima Edicion RRRLaura Arias MancoAún no hay calificaciones
- Determinacion de Dureza en El AguaDocumento18 páginasDeterminacion de Dureza en El AguaKarol ArcilaAún no hay calificaciones
- Dureza Del AguaDocumento3 páginasDureza Del AguaMaria Jose NavarroAún no hay calificaciones
- Practica 9 QA CE (18 de 20)Documento7 páginasPractica 9 QA CE (18 de 20)Pablo Contreras100% (1)
- Unidadvi Calculos Valoraciones ComplejometricasDocumento4 páginasUnidadvi Calculos Valoraciones ComplejometricasarielAún no hay calificaciones
- Problemas Ii FaseDocumento13 páginasProblemas Ii FaseVILCHEZ RIOS JAVIER VICTOR MANUELAún no hay calificaciones
- Calculos EDTADocumento3 páginasCalculos EDTAjuan jose calvacheAún no hay calificaciones
- Pineda Vanessa - CONDUCTIMETRÍADocumento5 páginasPineda Vanessa - CONDUCTIMETRÍAVanessa Del Carmen Pineda CastañedaAún no hay calificaciones
- Informe 03 Lab de Analisis1Documento7 páginasInforme 03 Lab de Analisis1JOSE MIGUEL CONDORI SUPOAún no hay calificaciones
- Dureza Del AguaDocumento10 páginasDureza Del AguaMaria Fernanda RualesAún no hay calificaciones
- Complexiometria 1Documento7 páginasComplexiometria 1Juan MfzAún no hay calificaciones
- Examen Final 2021-1 Solucionario ORCEDocumento4 páginasExamen Final 2021-1 Solucionario ORCENavarro ValeriaAún no hay calificaciones
- ComplejometríaDocumento13 páginasComplejometríaRonaldo Cañas BarreiroAún no hay calificaciones
- APORTE1Documento6 páginasAPORTE1ABOGADA JOHANA GALLEGOAún no hay calificaciones
- Determinacion de Dureza en AguaDocumento5 páginasDeterminacion de Dureza en AguaelizabethAún no hay calificaciones
- Bloque RedoxDocumento17 páginasBloque Redoxethanalejos2002Aún no hay calificaciones
- Determinacion de CaCO3 Por Titulacion Directa y RetoinversaDocumento8 páginasDeterminacion de CaCO3 Por Titulacion Directa y RetoinversaCarlos Uriel Sevilla Agustín0% (1)
- Informe QuelatometriaDocumento13 páginasInforme QuelatometriaANGIE PAOLA RODELO PANZAAún no hay calificaciones
- IntegrantesDocumento6 páginasIntegrantesJorge Andrés AriasAún no hay calificaciones
- VSPW DurezaDocumento4 páginasVSPW DurezaValeria PovedaAún no hay calificaciones
- Titulaciones ComplejométricasDocumento3 páginasTitulaciones ComplejométricasTorres Mark Antonio100% (1)
- Informe de OxalatosDocumento4 páginasInforme de OxalatosAlexandra LunaAún no hay calificaciones
- Laboratorio de Formación de Complejos...Documento8 páginasLaboratorio de Formación de Complejos...ijil87Aún no hay calificaciones
- Informe N°7 - Valoraciones de Formación de ComplejosDocumento5 páginasInforme N°7 - Valoraciones de Formación de ComplejosAngela M. Coaguila Pari100% (2)
- Dureza Del Agua InformeDocumento4 páginasDureza Del Agua InformeCarlos LancherosAún no hay calificaciones
- Problemario 2do DepartamentalDocumento16 páginasProblemario 2do DepartamentalRosmery Gonzales50% (2)
- Det de La Dureza Del Agua 1Documento9 páginasDet de La Dureza Del Agua 1Isamar Jimenez VegaAún no hay calificaciones
- ANALITICADocumento10 páginasANALITICAWrayhan RomeroAún no hay calificaciones
- Pract 6 DisolucionesDocumento5 páginasPract 6 DisolucionesMarQuizzéAún no hay calificaciones
- Actividad pc3 - AnalisisDocumento7 páginasActividad pc3 - Analisisveranniajuarez09Aún no hay calificaciones
- Informe de DurezaDocumento9 páginasInforme de Durezawilmer foreroAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- CUANTICADocumento9 páginasCUANTICALaura Arias MancoAún no hay calificaciones
- Cuadro Comparativo ModelosDocumento3 páginasCuadro Comparativo ModelosLaura Arias MancoAún no hay calificaciones
- Cuantica #4Documento9 páginasCuantica #4Laura Arias MancoAún no hay calificaciones
- Calculos Analitica 5 Ultima Edicion Rrr-1Documento9 páginasCalculos Analitica 5 Ultima Edicion Rrr-1Laura Arias MancoAún no hay calificaciones
- CuestionarioDocumento2 páginasCuestionarioLaura Arias MancoAún no hay calificaciones
- Manual Practicas Fisicoquimica IIDocumento52 páginasManual Practicas Fisicoquimica IILaura Arias MancoAún no hay calificaciones
- Cuadro Comparativo de Los Modelos Heteroestructural PortadaDocumento1 páginaCuadro Comparativo de Los Modelos Heteroestructural PortadaLaura Arias MancoAún no hay calificaciones
- TALLER 2. Qca CuanticaDocumento7 páginasTALLER 2. Qca CuanticaLaura Arias MancoAún no hay calificaciones
- Tema 7Documento2 páginasTema 7Laura Arias MancoAún no hay calificaciones
- Calculos Analitica 5 Ultima Edicion RRRDocumento8 páginasCalculos Analitica 5 Ultima Edicion RRRLaura Arias MancoAún no hay calificaciones
- Informe Casi TerminadoDocumento8 páginasInforme Casi TerminadoLaura Arias MancoAún no hay calificaciones
- Articulo Laboratorio N°2Documento8 páginasArticulo Laboratorio N°2Laura Arias MancoAún no hay calificaciones
- Informe #8 FQ1Documento14 páginasInforme #8 FQ1Laura Arias MancoAún no hay calificaciones
- Calculos FisicoquimicaDocumento3 páginasCalculos FisicoquimicaLaura Arias MancoAún no hay calificaciones
- Borrador Informe de OrgánicaDocumento6 páginasBorrador Informe de OrgánicaLaura Arias MancoAún no hay calificaciones
- Quimica Cuántica Cohorte 2Documento85 páginasQuimica Cuántica Cohorte 2Laura Arias MancoAún no hay calificaciones
- Proyecto V SemestreDocumento110 páginasProyecto V SemestreLaura Arias MancoAún no hay calificaciones
- Cuestionario FisicoquimicaDocumento2 páginasCuestionario FisicoquimicaLaura Arias MancoAún no hay calificaciones
- Intervalos de Confianza para Muestras PareadasDocumento7 páginasIntervalos de Confianza para Muestras PareadasLaura Arias MancoAún no hay calificaciones
- Laboratorio N°3 Gravimetria de PrecipitaciónDocumento7 páginasLaboratorio N°3 Gravimetria de PrecipitaciónLaura Arias MancoAún no hay calificaciones
- Bases TeoricasDocumento1 páginaBases TeoricasLaura Arias MancoAún no hay calificaciones
- Cambios Termicos de Un SistemaDocumento14 páginasCambios Termicos de Un SistemaLaura Arias MancoAún no hay calificaciones
- Terminología CulinariaDocumento46 páginasTerminología CulinariaManuela MarinAún no hay calificaciones
- Full Skin QuitoDocumento31 páginasFull Skin QuitoVeronica RolandelliAún no hay calificaciones
- Contaminacion en PaitaDocumento104 páginasContaminacion en PaitaLuis SosaAún no hay calificaciones
- Plantel Educem Campus MazatlánDocumento5 páginasPlantel Educem Campus MazatlánAbraham Grande100% (1)
- Atención de Parto NormalDocumento17 páginasAtención de Parto NormalValerio MolinaAún no hay calificaciones
- Veterinaria: GradoDocumento4 páginasVeterinaria: GradoAlejandra VisbalAún no hay calificaciones
- CRISTALESDocumento6 páginasCRISTALESKoko Beauty0% (1)
- Protocolo 09 01 2023 357Documento2 páginasProtocolo 09 01 2023 357Mili ArquielAún no hay calificaciones
- Técnica MonomaxilarDocumento3 páginasTécnica MonomaxilarDaniela MassolinAún no hay calificaciones
- 2021-750 Auto Declara Falta de CompetenciaDocumento3 páginas2021-750 Auto Declara Falta de Competenciakaren LealAún no hay calificaciones
- Informe PlasmodiumDocumento5 páginasInforme PlasmodiumKaren CorreaAún no hay calificaciones
- Posproducción Porcinos TerminadoDocumento23 páginasPosproducción Porcinos TerminadoDiego RangelAún no hay calificaciones
- Pruebas Diagnósticas.Documento6 páginasPruebas Diagnósticas.Fátima LuCa100% (2)
- Desagregados EppDocumento1 páginaDesagregados EppJavier Ismael Belito ÑahuiAún no hay calificaciones
- El Poder de La Alabanza 1 AlabanzaDocumento3 páginasEl Poder de La Alabanza 1 AlabanzapaccaAún no hay calificaciones
- Caso 4 DE NUEVODocumento2 páginasCaso 4 DE NUEVOManuel Martinez0% (1)
- Métodos de Separación y Extracción de AnalitosDocumento5 páginasMétodos de Separación y Extracción de AnalitosAthenas A.PAún no hay calificaciones
- Diseño de Mezcla - 140Documento2 páginasDiseño de Mezcla - 140Jesus Ravello SanchezAún no hay calificaciones
- Guia ArrozDocumento15 páginasGuia ArrozMaria victoria PachecoAún no hay calificaciones
- MI-PIS-SSO-CRO-FOR-95 Evaluación de Desempeño en SSOMA Del ContratistaDocumento1 páginaMI-PIS-SSO-CRO-FOR-95 Evaluación de Desempeño en SSOMA Del Contratistajimmie tristan arroyoAún no hay calificaciones
- TPN 4 Caída de Tensión-1Documento1 páginaTPN 4 Caída de Tensión-1Dacia Rocio GuerreroAún no hay calificaciones
- Produccion Conjunta Unidad 7Documento7 páginasProduccion Conjunta Unidad 7Liliana MartinezAún no hay calificaciones
- Unmsm 1990Documento4 páginasUnmsm 1990Juanchos Josecito CMAún no hay calificaciones
- Plan Anual de Capacitación Centro Materno Infantil Miguel GrauDocumento4 páginasPlan Anual de Capacitación Centro Materno Infantil Miguel Graujhanelin0% (1)
- Copa de Vino. Historia.Documento11 páginasCopa de Vino. Historia.AdolfoSotoSaez100% (2)
- SDOMDocumento16 páginasSDOMScarley Ramirez LauriAún no hay calificaciones
- Xenobioticos 2017Documento40 páginasXenobioticos 2017Syovis HopeAún no hay calificaciones
- DERECHO CIVIL I TAREA No. 5 NELYSDocumento6 páginasDERECHO CIVIL I TAREA No. 5 NELYSJenrryGonzalezAún no hay calificaciones
- Convocatoria Festival de Oratoria y DeclamaciónDocumento2 páginasConvocatoria Festival de Oratoria y DeclamaciónDayan Ferrufino FloresAún no hay calificaciones
- Gc-Fo-Gc-007 Reporte Individual de Incidente o Evento Adverso PDFDocumento1 páginaGc-Fo-Gc-007 Reporte Individual de Incidente o Evento Adverso PDFjuan davidAún no hay calificaciones