Documentos de Académico
Documentos de Profesional
Documentos de Cultura
EstereoisomeriaaminoacidosBioqui Mica lasbasesmolecularesdelavidaPDFDrive
Cargado por
ᴅᴀʀᴋꜱᴛᴏʀᴍ TMDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
EstereoisomeriaaminoacidosBioqui Mica lasbasesmolecularesdelavidaPDFDrive
Cargado por
ᴅᴀʀᴋꜱᴛᴏʀᴍ TMCopyright:
Formatos disponibles
5.
1 Aminoácidos 115
O I I
O FIGURA 5.5
+
H3N CH2 CH2 CH2 C O− Algunos derivados de aminoácidos
HO O CH2 CH C O−
GABA
+NH
I I 3
+
HO CH2 CH2 NH3 Tiroxina
O
N
CH2 C OH
H
Serotonina
O
N
C
H3C NH H
Ácido indolacético
CH2
CH2
H3C O
H
Melatonina
O O
Aminoácidos modificados en las proteínas +
H3N CH C
+
O− H3N CH C O−
Muchas proteínas contienen derivados de aminoácidos que se forman tras la síntesis
de la cadena polipeptídica. Entre estos aminoácidos modificados se encuentra el áci- CH2 CH2
do ␥-carboxiglutámico (fig. 5.7), un residuo de aminoácido que se une al calcio que
CH2 CH2
se encuentra en la protrombina, una proteína utilizada en el proceso de coagulación
de la sangre. La 4-hidroxiprolina y la 5-hidroxilisina son componentes estructurales CH2 CH2
importantes del colágeno, la proteína más abundante del tejido conjuntivo. Suele uti-
lizarse la fosforilación de los aminoácidos que contienen grupos hidroxilo, como la NH +NH
3
serina, la treonina y la tirosina, para regular la actividad de las proteínas. Por ejemplo, C O
la síntesis del glucógeno está muy restringida cuando la enzima glucógeno sintetasa
está fosforilada. En el capítulo 19 se consideran otros dos aminoácidos modificados, NH2
la selenocisteína y la pirolisina.
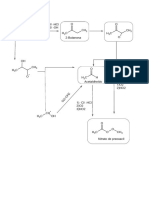
Citrulina Ornitina
Estereoisómeros de los aminoácidos FIGURA 5.6
Debido a que los carbonos ␣ de 19 de los 20 aminoácidos estándar están unidos a cua- Citrulina y ornitina
tro grupos diferentes (p. ej., a un hidrógeno, a un grupo carboxilo, a un grupo amino
y a un grupo R), se denominan carbonos asimétricos o quirales. La glicina es
O O
O NH CH C NH CH C
O
C CH2 CH2
NH CH C
N CH
O CH2 CH2 O
CH2 CH2
−O C CH CH OH −O P O
H OH
C O CH2 O−
+NH
O− 3
γ-carboxiglutamato 4-hidroxiprolina 5-hidroxilisina o-fosfoserina
FIGURA 5.7
Algunos residuos de aminoácidos modificados que se encuentran en los polipéptidos
05 Chapter 05_McKee_5R.indd 115 04/12/13 13:59
116 CAPÍTULO 5 Aminoácidos, péptidos y proteínas
FIGURA 5.8 una molécula simétrica puesto que su carbono ␣ está
Dos enantiómeros unido a dos hidrógenos. Las moléculas con carbonos
quirales pueden existir como estereoisómeros, mo-
La l-alanina y la
léculas que sólo se diferencian en la disposición es-
d-alanina son imágenes
especulares una de otra.
pacial de sus átomos. En la figura 5.8 se muestran las
(Nitrógeno = esfera azul representaciones tridimensionales de los estereoisó-
grande; hidrógeno = meros del aminoácido alanina. Obsérvese en la figura
esfera gris pequeña; que los átomos de los dos isómeros están unidos en el
carbono = esfera negra; L-Alanina D-Alanina mismo patrón excepto por la posición del grupo amo-
oxígeno = esfera roja.) nio y del átomo de hidrógeno. Estos dos isómeros son
imágenes especulares de sí mismos. Moléculas así, denominadas enantiómeros, no
pueden superponerse una sobre otra. Las propiedades físicas de los enantiómeros son
H H idénticas, excepto que desvían la luz polarizada en un plano en direcciones opuestas.
C O C O
(La luz polarizada en un plano, se produce haciendo pasar la luz sin polarizar a través
de un filtro especial, las ondas luminosas sólo vibran en un plano.) Las moléculas que
H C OH HO C H poseen esta propiedad se denominan isómeros ópticos.
El gliceraldehído es el compuesto de referencia para los isómeros ópticos (fig.
CH2OH CH2OH 5.9). Un isómero del gliceraldehído desvía el haz de luz en el sentido de las ma-
necillas del reloj y se denomina dextrógiro (se distingue por el signo +). El otro
D-Gliceraldehído L-Gliceraldehído isómero del gliceraldehído, denominado levógiro (que se distingue por el signo −),
desvía el haz en la dirección opuesta en el mismo grado. A los isómeros ópticos se
FIGURA 5.9 les suele denominar d o l (p. ej., d-glucosa, l-alanina) para indicar la similitud de la
d- y l-Gliceraldehído disposición de los átomos alrededor de un carbono asimétrico de una molécula con
Estas moléculas son imágenes especu- la de los átomos alrededor del carbono asimétrico de cualquiera de los isómeros del
lares una de otra. gliceraldehído.
Debido a que muchas biomoléculas tienen más de un carbono quiral, las letras d y
l sólo se refieren a las relaciones estructurales de una molécula con cualquiera de los
isómeros del gliceraldehído, no con la dirección en la que desvían la luz polarizada
en un plano. La mayoría de las moléculas asimétricas que se encuentran en los seres
CONCEPTOS CLAVE vivos se presentan en una sola forma estereoisomérica, d o l bien. Por ejemplo, con
• Las moléculas con un átomo de pocas excepciones, en las proteínas sólo hay aminoácidos l.
carbono asimétrico o quiral difieren La quiralidad ha tenido un efecto importante sobre las propiedades estructurales
sólo en la disposición espacial de los y funcionales de las biomoléculas. Por ejemplo, las hélices ␣ que giran a la derecha
átomos unidos al carbono. que se observan en las proteínas son consecuencia de la presencia de aminoácidos l.
• Las formas especulares (imágenes en Los polipéptidos que se sintetizan en el laboratorio con una mezcla de aminoácidos d
el espejo) de una molécula se deno- y l no forman hélices. Además, como las enzimas son moléculas quirales, la mayoría
minan enantiómeros. se une a moléculas de sustrato en una sola forma enantiómera o enantiomérica. Las
• En los seres vivos la mayoría de las proteasas, enzimas que degradan proteínas al hidrolizar los enlaces peptídicos, no
moléculas asimétricas posee sólo pueden degradar polipéptidos artificiales formados por aminoácidos d.
una forma estereoisomérica.
PREGUNTA 5.2
Determinadas especies bacterianas poseen capas externas formadas por polímeros de
aminoácidos d. Las células del sistema inmunitario, cuya tarea es atacar y destruir a
las células externas, no pueden destruir estas bacterias. Sugiera una razón para este
fenómeno.
Titulación de los aminoácidos
Debido a que los aminoácidos contienen grupos ionizables (cuadro 5.2), la forma
iónica predominante de estas moléculas en solución depende del pH. La titulación
de un aminoácido ilustra el efecto del pH sobre su estructura (fig. 5.10a). La titula-
ción también es una herramienta útil para determinar la reactividad de las cadenas
laterales de los aminoácidos. Considérese la alanina, un aminoácido sencillo con dos
grupos titulables. Durante la titulación con una base fuerte como el NaOH, la alanina
pierde dos protones de forma escalonada. En una solución muy ácida (p. ej., a pH 0),
casi todas las moléculas de alanina se encuentran en la forma en la que el grupo
05 Chapter 05_McKee_5R.indd 116 04/12/13 13:59
También podría gustarte
- Wuolah-Free-Lineas Equipotenciales en Un Cable CoaxialDocumento9 páginasWuolah-Free-Lineas Equipotenciales en Un Cable CoaxialDaniel AtienzaAún no hay calificaciones
- Tabla de Los 20 AminoácidosDocumento1 páginaTabla de Los 20 Aminoácidoscesar alarcon hernandezAún no hay calificaciones
- Catalogo Omnilife Peru 2021Documento34 páginasCatalogo Omnilife Peru 2021Ricardo Manosalva0% (1)
- Alejandro Raiter - Psicolingüística - Capítulo 1Documento16 páginasAlejandro Raiter - Psicolingüística - Capítulo 1karen rojas100% (2)
- Chapter 6 Purves NT and RDocumento35 páginasChapter 6 Purves NT and RMaryjose BarretoAún no hay calificaciones
- Aminoacidos Peptidos y ProteinasDocumento55 páginasAminoacidos Peptidos y ProteinasLiz Claudina Caceres MoyaAún no hay calificaciones
- Hemoglobina y BilirrubinaDocumento26 páginasHemoglobina y BilirrubinaBernardo Calle DominguezAún no hay calificaciones
- Unidad 4 Proteinas 4 - 2021Documento4 páginasUnidad 4 Proteinas 4 - 2021Carolina Longoria SAún no hay calificaciones
- Unidad 4 Proteinas 4 - 2021Documento4 páginasUnidad 4 Proteinas 4 - 2021Carolina Longoria SAún no hay calificaciones
- Tarea # 4 Polisacáridos y Glucoconjugados ClaveDocumento6 páginasTarea # 4 Polisacáridos y Glucoconjugados Clavejorge100% (1)
- Semana 15 ProteinasDocumento60 páginasSemana 15 ProteinasLeticia MoriAún no hay calificaciones
- Urea PDFDocumento53 páginasUrea PDFJeison Cabos SanchezAún no hay calificaciones
- Ejercicios 1-1Documento6 páginasEjercicios 1-1eutectic1992Aún no hay calificaciones
- TEMA X Amino AcidosDocumento46 páginasTEMA X Amino AcidosNenniae C'alladhanAún no hay calificaciones
- 14 AminoacidosDocumento24 páginas14 AminoacidosMariana ValladaresAún no hay calificaciones
- Farmacoquimica 10 NeurotransmisoresDocumento58 páginasFarmacoquimica 10 NeurotransmisoresDavid Carlos Bertolotto HuamaníAún no hay calificaciones
- Taller AminoacidosDocumento4 páginasTaller AminoacidosKaren RestrepoAún no hay calificaciones
- Aminoacidos y ProteinasDocumento39 páginasAminoacidos y ProteinasFeliciano BernuiAún no hay calificaciones
- 11 - Degradación de AminoácidosDocumento7 páginas11 - Degradación de AminoácidosLeonardo HuariAún no hay calificaciones
- Temas 6-8Documento51 páginasTemas 6-8luisAún no hay calificaciones
- Taller Aminoácidos II 2020Documento3 páginasTaller Aminoácidos II 2020catailnaAún no hay calificaciones
- Cuestionario 4,4-Nitro-2-Picolin-N-OxidoDocumento1 páginaCuestionario 4,4-Nitro-2-Picolin-N-OxidoJuan Antonio de la RosaAún no hay calificaciones
- Investigación Previa - Sintesis de 2,4-Dietoxicarbonil-3,5-DimetilpirrolDocumento9 páginasInvestigación Previa - Sintesis de 2,4-Dietoxicarbonil-3,5-DimetilpirrolDaniel Granados JuárezAún no hay calificaciones
- Resumen Prácticas de LaboratorioDocumento10 páginasResumen Prácticas de LaboratorioJhon OrqueraAún no hay calificaciones
- Diapos Del Grupo Hemo ArregladoDocumento15 páginasDiapos Del Grupo Hemo ArregladoWENDY ANALÍ SANCHEZ MONJAAún no hay calificaciones
- Unidadii Aminoacidos Peptidos Proteinas 21268 PDFDocumento52 páginasUnidadii Aminoacidos Peptidos Proteinas 21268 PDFColín Poblete BaezaAún no hay calificaciones
- Ep 2019-IiDocumento4 páginasEp 2019-Iithiara brenetAún no hay calificaciones
- Proteínas KesiaDocumento56 páginasProteínas KesiaDulce mariaAún no hay calificaciones
- Laboratorio de Aminoácidos y ProteínasDocumento8 páginasLaboratorio de Aminoácidos y ProteínasKaren RestrepoAún no hay calificaciones
- Químicaorgánica:Gruposfuncionales: Gradosuniversitarios AlbalópezvalenzuelaDocumento2 páginasQuímicaorgánica:Gruposfuncionales: Gradosuniversitarios Albalópezvalenzuelapablo martin perezAún no hay calificaciones
- 5 FICHA 1 - Aminoácidos, Péptidos y ProteínasDocumento2 páginas5 FICHA 1 - Aminoácidos, Péptidos y ProteínasDiego MechelkAún no hay calificaciones
- Ejercicios de Heterociclos de 5 Miembros Con Un HeteroátomoDocumento8 páginasEjercicios de Heterociclos de 5 Miembros Con Un HeteroátomoIván Narváez AguilarAún no hay calificaciones
- Q.o3-Obtención de Chalconas 2 PDFDocumento1 páginaQ.o3-Obtención de Chalconas 2 PDFFabian RamirezAún no hay calificaciones
- Metabolismo de Aminoácidos. Catabolismo (9-09-11)Documento91 páginasMetabolismo de Aminoácidos. Catabolismo (9-09-11)Gabriel MejiaAún no hay calificaciones
- Guia de Nomenclatura y Reacciones de AlcoholesDocumento5 páginasGuia de Nomenclatura y Reacciones de AlcoholesKevin ObandoAún no hay calificaciones
- Investigación Previa - Modificación de La Síntesis de Paal-Knorr para La Obtención de PirrolesDocumento12 páginasInvestigación Previa - Modificación de La Síntesis de Paal-Knorr para La Obtención de PirrolesDaniel Granados JuárezAún no hay calificaciones
- PIRIMIDINASDocumento1 páginaPIRIMIDINASHermosita lilAún no hay calificaciones
- 3 Formación de PéptidosDocumento3 páginas3 Formación de PéptidoslafarmaciadelmercadonaturaAún no hay calificaciones
- Aminoacidos MAINDocumento52 páginasAminoacidos MAINElián LópezAún no hay calificaciones
- Ejercicios OrganicaDocumento21 páginasEjercicios OrganicasanquimicoAún no hay calificaciones
- Grupos FuncionalesDocumento2 páginasGrupos FuncionalesLeidy MaRtinezAún no hay calificaciones
- Reporte 2 LSCODocumento4 páginasReporte 2 LSCOErnesto FloresAún no hay calificaciones
- FQI - Material Lectura 08 - Anastesicos LocalesDocumento4 páginasFQI - Material Lectura 08 - Anastesicos LocalesAndy Neciosup TapiaAún no hay calificaciones
- A) Piridina Vs 3-Cloropiridina: 1.1 ¿Cuál Es Más Básico?Documento1 páginaA) Piridina Vs 3-Cloropiridina: 1.1 ¿Cuál Es Más Básico?Jubitza Maribel Izaguirre HernandezAún no hay calificaciones
- Farmacoquimica Ii Pract. N°8Documento5 páginasFarmacoquimica Ii Pract. N°8Samira NamiAún no hay calificaciones
- Primer Parcial Parte en CasaDocumento6 páginasPrimer Parcial Parte en CasawilsonAún no hay calificaciones
- Investigación Previa - Síntesis de Fischer para IndolesDocumento13 páginasInvestigación Previa - Síntesis de Fischer para IndolesDaniel Granados JuárezAún no hay calificaciones
- TallerDocumento3 páginasTallerAndres HoyosAún no hay calificaciones
- Teoria AcidosDocumento4 páginasTeoria AcidosJefry SeguraAún no hay calificaciones
- Resolucion Ejercicios Unidad 1 y 2Documento4 páginasResolucion Ejercicios Unidad 1 y 2karlavieyvaAún no hay calificaciones
- 4 Proteinas 5 - 31901Documento54 páginas4 Proteinas 5 - 31901Adriana Díaz GuevaraAún no hay calificaciones
- Sintesis de Acetil CoADocumento3 páginasSintesis de Acetil CoAJOSE DANIEL PEREZ GONZALEZAún no hay calificaciones
- Moleculas 5Documento2 páginasMoleculas 5Eloy Morales perezAún no hay calificaciones
- Act 5Documento11 páginasAct 5akksAún no hay calificaciones
- Temas 9-10Documento34 páginasTemas 9-10luisAún no hay calificaciones
- Ejercicios Quimica OrganicaDocumento24 páginasEjercicios Quimica Organica3jotasykas100% (1)
- Tema 12 Aminoacidos Uned J L Garrido LaraDocumento46 páginasTema 12 Aminoacidos Uned J L Garrido LaraJosé Luis Garrido LaraAún no hay calificaciones
- Anestesicos Locales - Informe GeneralDocumento14 páginasAnestesicos Locales - Informe GeneralPLANTADAVISAún no hay calificaciones
- Laboratorio de Quimica Organica II: Aldehidos y CetonasDocumento10 páginasLaboratorio de Quimica Organica II: Aldehidos y CetonasArnaldo ValdiviaAún no hay calificaciones
- Chapter 6.en - Es TRADUCIDODocumento13 páginasChapter 6.en - Es TRADUCIDOPerla López RacillaAún no hay calificaciones
- Practica 2Documento13 páginasPractica 2neyderAún no hay calificaciones
- Lab N°1 - Ensayo N°2-Peso UnitarioDocumento17 páginasLab N°1 - Ensayo N°2-Peso UnitarioJorge RodriguezAún no hay calificaciones
- Ava River - Hasta Que La Muerte Nos SepareDocumento357 páginasAva River - Hasta Que La Muerte Nos SepareLeonardoAún no hay calificaciones
- Manual Manufactura IntDocumento169 páginasManual Manufactura IntKarime BenitezAún no hay calificaciones
- 11â° Sa-Atencion PrenatalDocumento37 páginas11â° Sa-Atencion PrenatalGino Huallanca Coronado100% (1)
- Modelo Convocatoria Directores 2022Documento12 páginasModelo Convocatoria Directores 2022TeofiIo CopaAún no hay calificaciones
- Manual para Hacer Un Purificador de Agua Con Luz Ultravioleta y CondensaciónDocumento25 páginasManual para Hacer Un Purificador de Agua Con Luz Ultravioleta y Condensaciónpuercomorado88% (8)
- Cap 3 DeshidratacionDocumento107 páginasCap 3 DeshidratacionAdemar Cruz MancillaAún no hay calificaciones
- Planeacion 5Documento3 páginasPlaneacion 5jesus piñaAún no hay calificaciones
- Marmolina Rodillo R 1Documento2 páginasMarmolina Rodillo R 1Eduardo ValenciaAún no hay calificaciones
- Syllabus Del Curso Investigación en Ciencias SocialesDocumento14 páginasSyllabus Del Curso Investigación en Ciencias SocialesMaira Alejandra Robles DuranAún no hay calificaciones
- Guia NBA 2016 PDFDocumento67 páginasGuia NBA 2016 PDFmaifra2Aún no hay calificaciones
- Informe GeoestadisticaDocumento7 páginasInforme GeoestadisticaFabri Leiva ZavalaAún no hay calificaciones
- PE22 - TP6. Modularidad - FuncionesDocumento5 páginasPE22 - TP6. Modularidad - FuncionesPalacios MarcoAún no hay calificaciones
- Taller Decreto 1571 de 1993Documento3 páginasTaller Decreto 1571 de 1993Angie RinconAún no hay calificaciones
- Diseño de Un Autómata Con Transiciones VacíasDocumento3 páginasDiseño de Un Autómata Con Transiciones VacíasLeydi Euan Martinez100% (2)
- Indicadores para PreescolarDocumento31 páginasIndicadores para PreescolarMaykelis Yeinimar Chirinos Brito100% (2)
- Plan Perfecto de DiosDocumento2 páginasPlan Perfecto de DiosDavid RiveraAún no hay calificaciones
- El Folclore ÑUC A LLACTADocumento1 páginaEl Folclore ÑUC A LLACTAgaudi cordovaAún no hay calificaciones
- Ficha #03 Religion 09-12-21Documento3 páginasFicha #03 Religion 09-12-21jeni campos ramosAún no hay calificaciones
- Laboratorio IiiDocumento27 páginasLaboratorio IiiYhon Polanco AimitumaAún no hay calificaciones
- ART43880 006 - Rev A WebDocumento140 páginasART43880 006 - Rev A WebnackersoftscribdAún no hay calificaciones
- Medicina YorubaDocumento4 páginasMedicina YorubavitryAún no hay calificaciones
- Metalurgia IDocumento67 páginasMetalurgia IYash Palomino SantosAún no hay calificaciones
- San Juan Mixtepec. Una Comunidad Transna PDFDocumento142 páginasSan Juan Mixtepec. Una Comunidad Transna PDFMiguelBenítezMoránAún no hay calificaciones
- Seleccionados OEA-EADIC Conv 1 2016Documento28 páginasSeleccionados OEA-EADIC Conv 1 2016DI333GAún no hay calificaciones
- Tarea 3 de Contabilidad 5Documento10 páginasTarea 3 de Contabilidad 5Johanny Reyes BonillaAún no hay calificaciones