Documentos de Académico
Documentos de Profesional
Documentos de Cultura
CARTEL de La Práctica 5, NRC 13959
Cargado por
Berenice Sanchez GalindoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
CARTEL de La Práctica 5, NRC 13959
Cargado por
Berenice Sanchez GalindoCopyright:
Formatos disponibles
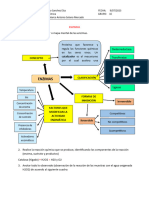
PRACTICA 5.
ACTIVIDAD ENZIMATICA
hjjh
PRACTICA
EQUIPO 1: DIONICIO BALDERAS ANGEL EDUARDO, HERNANDEZ CARRASCO 5. ACTIVIDAD
JONATHAN ENZIMATICA
DAVID, SÁNCHEZ GALINDO BERENICE; Leticia García Albarrán, Lunes 14-4 pm, NRC: 13959, otoño 2021
EQUIPO 1: DIONICIO BALDERAS ANGEL EDUARDO, HERNANDEZ CARRASCO JONATHAN DAVID, SÁNCHEZ GALINDO BERENICE; Leticia García Albarrán, Lunes 14-4 pm, NRC: 13959, otoño 2021
¿Se puede determinar la actividad de la enzima Catalasa por la cantidad de Oxigeno liberado?
CONCEPTOS RESULTADOS
Resultados
DEFINICIÓN DE ENZIMA: son proteínas que catalizan reacciones químicas en los seres vivos. Los enzimas son catalizadores, es decir, sustancias que, sin consumirse RESULTADOS
en una reacción, aumentan notablemente su velocidad. No hacen factibles las reacciones imposibles, sino que solamente aceleran las que espontáneamente Discusión de resultados
podrían producirse. Ello hace posible que en condiciones fisiológicas tengan lugar reacciones que sin catalizador requerirían condiciones extremas de presión,
temperatura o pH. OBJETIVOS DISCUSIÓN DE RESULTADOS
CONCLUSIÓN
CARACTERÍSTICAS DE LAS ENZIMAS: l. Son proteínas; II. Son los catalizadores más eficientes que se conocen. La mayor parte de las reacciones celulares ocurren a
una velocidad alrededor de un millón de veces más alta de lo que serían en ausencia de enzimas; III. La mayoría de las enzimas se distinguen por su especificidad, lo
que significa que cada conversión de un reactivo (llamado sustrato) en un producto es catalizada por una enzima determinada; IV. Quizá una de las más notables Evalúa la actividad de la enzima Catalasa de diferentes CONCLUSIÓN
Procedimiento
características es que las acciones de muchas enzimas están reguladas de modo que pueden cambiar de un estado de baja actividad a uno de alta actividad, fuentes biológicas, comparando el efecto de la
dependiendo de las condiciones celulares en las que se encuentren. temperatura y de algunos inhibidores como el Pb y el CN PROCEDIMIENTO
Clasificación de las enzimas.
N. Clase NOMBRE REACCIÓN QUE CATALIZAN
Catalizan reacciones de óxido-reducción
1 OXIDORREDUCTASAS
Catalizan reacciones de transferencia de grupos
MATERIAL
MATERIAL REACTIVO
Y REACTIVOS
2 TRANFERASAS
Catalizan ruptura de enlaces químicos con adición de agua.
3 HIDROLASAS MATERIAL: El alumno deberá traer:
Catalizan la ruptura de enlaces químicos sin participación de agua (adición a dobles enlaces). 12 tubos de ensaye
4 LIASAS -H2O2
Catalizan reacciones de isomerización. 1 gradilla -Papa *
5 ISOMERASAS
Catalizan reacciones que consisten en unir dos moléculas. Reacción acoplada con la intervención de enlaces Baño María 100ºC -Hígado de pollo*
6 LIGASAS O SINTETASAS fosfato de ATP (consumen energía) Papel absorbente -Manzana *
SITIO ACTIVO.- Es la agrupación ordenada espacialmente pero estructuralmente asimétrica de un pequeño número de residuos aminoacídicos responsables Cuchillo * todo crudo
de la actividad catalítica de la enzima. El sitio activo recibe también el nombre de Sitio Catalítico o Centro Activo REACTIVOS: 2 goteros
COENZIMA: Una coenzima se define como molécula orgánica que ate a los sitios activos de ciertas enzimas para ayudar a la catálisis de una reacción. Más
concretamente, las coenzimas se pueden funcionar como las ondas portadoras intermedias de electrones durante estas reacciones o transferir entre las enzimas
Cianuro de sodio al 5% Pinzas pequeñas.
como grupos funcionales; COFACTOR: Es una molécula pequeña necesaria para la actividad de muchas enzimas. Los cofactores son iones metálicos o Nitrato de plomo al 5%
moléculas orgánicas que participan con las enzimas en la realización de una actividad enzimática.
FACTORES QUE AFECTAN LA ACTIVIDAD DE LAS ENZIMAS: 1. Concentración de enzima: Manteniendo la concentración de sustrato constante la velocidad
de reacción es directamente proporcional a la concentración de la enzima; 2. Temperatura: La temperatura afecta a las reacciones químicas. Las
reacciones enzimáticas no son la excepción. Pero debido a que las enzimas son proteínas se presenta una desnaturalización térmica; 3. Ph; el pH óptimo FICHAS DE SEGURIDAD
de una enzima no es necesariamente idéntico al pH de su entorno intracelular normal. Esto probablemente sea una de las maneras de controlar la
actividad enzimática; 4. Concentración de sustrato: La velocidad máxima se presenta debido a la ocupación del sitio activo de TODAS las enzimas
presentes es decir se han SATURADO los sitios activos; 5. Efectores (Activadores e Inhibidores): La pérdida de actividad de una enzima se puede
lograr por desnaturalización, ya que se trata de una proteína y por lo tanto le afectan pH, temperatura, agitación vigorosa, por citar algunos agentes Otra
forma de hacer que la actividad de una enzima se pierda o disminuya es a través del uso de INHIBIDORES.
comp salu inflama peligro de peli peligros pictogramas Con formato
Desnaturalización: a la pérdida de la conformación nativa se le conoce como DESNATURALIZACIÓN e implica cambios en los niveles estructurales
uesto d bilidad inestabili gro relación a: Pá
caracterizados por la presencia de enlaces no covalentes es decir, el secundario, terciario y cuaternario.
dad esp CUESTIONARIO
Inhibidor: inhibidor competitivo se une al sitio activo e impide su unión al sustrato. El inhibidor no competitivo se une a un sitio diferente de la enzima, no Párrafo
bloquea la unión del sustrato pero produce otros cambios en la enzima de forma que ya no puede catalizar la reacción eficientemente. ecial
es
TIPOS DE INHIBICIÓN REVERSIBLE: Competitiva: Las sustancias que se comportan como inhibidores Peroxi 3 0 1 Al contacto con otro material puede causar Con formato
competitivos, suelen tener una estructura semejante a la del sustrato; Acompetitiva: El inhibidor sólo se une al do de fuego, puede ser dañino si es ingerido, puede relación a: Pá
complejo enzima – sustrato, y no a la enzima libre; No competitiva: suele observarse en las reacciones en las que hidrog causar efectos en el sistema nervisos central,
las enzimas unen más de un sustrato o en las que requiere un cofactor ya que el inhibidor suele unirse a él. Párrafo
eno anormalidades en la sangre
La catalasa es una enzima perteneciente a la categoría de las oxidorreductasas (clase 1) que cataliza la Tabla con fo
Cianur 3 0 0 Letal al contacto con la piel, Causa irritación
descomposición del peróxido de hidrógeno (H2O2) hacia oxígeno y agua. Esta enzima utiliza como cofactor un Con formato
grupo porfirínico de hierro. o de cutánea, Letal si se inhala, Muy tóxico para los
Con relación
sodio organismos acuáticos, Al entrar en contacto con
sustancias ácidas libera gases muy tóxicos. a: Párrafo
Tipo de inhibidores son el CN y el plomo
CN:La acción de la catalasa es por vía de la reacción directa del ión Fe(III) con el oxígeno, para liberar el peróxido y formar agua. La elevada constante de Con formato
Nitrat 3 0 3 Irritación, ardor en los ojos y posible
formación de complejos de hierro trivalente y divalente con aniones cianuro es debida al fuerte enlace sinérgico originado por la suma de dos efectos: relación a: Pá
o de conjuntivitis, Se absorbe por piel, los síntomas
❖ Donación de e: por parte del ligando en enlace s; ❖ Retrodonación de e: por parte del metal en enlace p. plomo de envenenamiento son los mismos de la Párrafo
Ya que el cianuro se une por enlaces covalentes al grupo funcional de la enzima, su inhibición es irreversible. ingestión. El contacto dérmico, causa irritación y Con formato
Plomo: El plomo ejerce sus efectos a través de su unión con grupos sulfhidrilos de proteínas y en las enzimas produce una inhibición de enzimas asociadas ardor, Irritación en las vías tracto respiratorias. relación a: Pá
a membranas, La unión del plomo a la catalasa se da en los grupos sulfhidrilo libres de las cisteínas que contiene la enzima, de forma covalente, por lo que
Párrafo
su inhibición sobre la enzima es Irreversible.
Con formato
FUNDAMENTOS compuesto formula peso molecular densidad punto de solubilidad Con relación
ebullición a: Párrafo
Reacción que cataliza la enzima Catalasa Peroxido de hidrogeno H2O2 34.0147 g/mol a 20°c 1.245 115 °C miscible en agua
Con formato
g/cm3 relación a: Pá
La catalasa es una enzima que cataliza la descomposición del peróxido de hidrógeno (H2O2) en oxígeno y agua. Esta enzima utiliza
como cofactor al grupo hemo. 2 H2O2 -- 2 H2O + O2 Cianuro de sodio NaCN 49.01 g/mol N/A 1496ºC soluble en agua Párrafo
Nitrato de plomo Pb(NO3)2 331,98 g/mol. 4,53 g/cm3 470ºC en agua a 20°C 52 g Con formato
La reacción química se produce en dos etapas: la catalasa es oxidada por el peróxido siendo el resultado una molécula de agua y el
en 100 ml relación a: Pá
compuesto I, intermediario de la reacción global y formado por un grupo ferroxilo y un radical catiónico de porfirina. H2O2 + Fe (III)-
E → H2O + O=Fe (IV)-E La otra molécula de peróxido restante reduce al complejo I, es decir devuelve a la catalasa a su forma Párrafo
original. De esta reducción se origina una molécula de agua y otra de oxígeno. H2O2 + O=Fe (IV)-E → H2O + Fe (III)-E + O2
BIBLIOGRAFÍA
Tabla con fo
Efecto de la temperatura sobre la enzima Catalasa, con rangos de temperatura.
BIBLIOGRAFÍA
Los efectos de la catalasa como en la mayoría de las enzimas están relacionada con la temperatura. La velocidad de una reacción enzimática incrementara
al aumentar su temperatura dentro de un rango comprendido de 35 a 37°C, de esa manera alcanza su máxima actividad enzimática a una temperatura
optima de 37°C. La temperatura afecta a la estructura de la catalasa como a los enlaces de hidrógenos que están diseñados para escindir. A medida que la
temperatura este aumentando hacia su punto óptimo, los enlaces de hidrogeno estarán perdiendo rigidez facilitando que la catalasa actúa sobre las Aguilar, P. Avila, R. Davila, R. Flores, G. Garcia, L. Gonzalez, F. Lazcano, M.
moléculas del peróxido de hidrogeno. Si la temperatura llegara a sobrepasar su punto óptimo esta se desnaturalizará y su estructura se alterará. Mena, A. Morales, L. Rode, A. Perez, I. Ramos, E. Vera, O. Ayudas
Que tipos de inhibidores son el Cianuro y el Plomo y a que parte de la estructura química de la enzima Didácticas de Bioquímica 1 (2010).Departamento bioquímica-alimentos.
Catalasa se unen.
Los compuestos que contienen metales pesados como plomo, mercurio, cobre o plata son metales venenosos. Esto
ocurre debido a que los iones de estos metales son inhibidores no competitivos de varias de las enzimas. En donde el
PB- actúa sobre los grupos -SH de la enzima indispensable para realizar su actividad.
El cianuro actuará como un inhibidor no competitivo de la catalasa a niveles bajos de las concentraciones de H2O2 (<0,1M)
se volverá competitivo solo en concentraciones bajas. El grupo CN formara quelatos con el cofactor de la encima catalasa
el cual es FE 3+
También podría gustarte
- Cartel Bioquimica EnzimasDocumento1 páginaCartel Bioquimica EnzimasLolita TorresAún no hay calificaciones
- Cartel Enzimas ImprimirDocumento1 páginaCartel Enzimas ImprimirKarla HernandezAún no hay calificaciones
- Cartel BQ 5Documento1 páginaCartel BQ 5ChincoyaFAún no hay calificaciones
- Integrantes: Quirarte Sainz Maryan Lizetth, Ruelas Verduzco Valeria, Tarín Sosa Asignatura: Procesos Metabólicos. Periodo: 2022-2Documento8 páginasIntegrantes: Quirarte Sainz Maryan Lizetth, Ruelas Verduzco Valeria, Tarín Sosa Asignatura: Procesos Metabólicos. Periodo: 2022-2Iván VazquezAún no hay calificaciones
- Succinato DeshidrogenasaDocumento1 páginaSuccinato DeshidrogenasaDianaAún no hay calificaciones
- Actividad EnzimaticaDocumento1 páginaActividad Enzimaticanathaly molinaAún no hay calificaciones
- Cartel EnzimasDocumento1 páginaCartel EnzimasHector Diaz F.LAún no hay calificaciones
- Gráfico Diagrama de Flujo de Procesos Profesional Simple MulticolorDocumento2 páginasGráfico Diagrama de Flujo de Procesos Profesional Simple MulticolorRamon ValdesAún no hay calificaciones
- Práctica 1 de QI.Documento3 páginasPráctica 1 de QI.Alexander C.CAún no hay calificaciones
- "Titulación Redox"-5Documento6 páginas"Titulación Redox"-5Jhon MármolAún no hay calificaciones
- ¿Se Puede Determinar La Actividad de La Enzima Catalasa Por La Cantidad de Oxígeno LiberadoDocumento1 página¿Se Puede Determinar La Actividad de La Enzima Catalasa Por La Cantidad de Oxígeno LiberadoSheila CruzAún no hay calificaciones
- Guía S2 Biología-octavo-3P.Documento4 páginasGuía S2 Biología-octavo-3P.Andrés Arias QuinteroAún no hay calificaciones
- Practica 4 InorganicaDocumento9 páginasPractica 4 InorganicaIng. Santos BlackAún no hay calificaciones
- INFORME Actividad Enzimática de HidrolasasDocumento6 páginasINFORME Actividad Enzimática de HidrolasasJeaneFatAún no hay calificaciones
- Actividad EnzimáticaDocumento1 páginaActividad EnzimáticaPerla Berenice GCAún no hay calificaciones
- Guia para Practica Aldehidos y CetonasDocumento2 páginasGuia para Practica Aldehidos y CetonasBBAún no hay calificaciones
- Practica No 2 Organica-Eteres y EpoxidosDocumento5 páginasPractica No 2 Organica-Eteres y EpoxidosOscar Leonel González de LeónAún no hay calificaciones
- Cartel Practica 6 FinalDocumento1 páginaCartel Practica 6 Finallizette seynos lopezAún no hay calificaciones
- Cartel 5 Bioquimica (B)Documento1 páginaCartel 5 Bioquimica (B)ChincoyaFAún no hay calificaciones
- ENZIMASDocumento5 páginasENZIMASJade AGAún no hay calificaciones
- Laboratorio de Yacimiento (Soluciones Salinas) PDFDocumento1 páginaLaboratorio de Yacimiento (Soluciones Salinas) PDFEleannys Jose Peinado CedeñoAún no hay calificaciones
- Sesión 01 - EnzimasDocumento28 páginasSesión 01 - EnzimasFiorella Reyes GonzalezAún no hay calificaciones
- Informe S4 - FarmacologíaprácticoDocumento10 páginasInforme S4 - FarmacologíaprácticoGuianela PoloAún no hay calificaciones
- Reactividad y Caracterización de HidrocarburosDocumento5 páginasReactividad y Caracterización de HidrocarburosNATHALIA VANESA BELALCAZAR CAICEDOAún no hay calificaciones
- Informe EnzimasDocumento4 páginasInforme EnzimasElzy PeredoAún no hay calificaciones
- EnzimasDocumento49 páginasEnzimasCamilo HerediaAún no hay calificaciones
- Informe de Laboratorio NDocumento7 páginasInforme de Laboratorio Nlaura neiraAún no hay calificaciones
- Fosfatasa Alcalina BRDocumento2 páginasFosfatasa Alcalina BRMayra SanchezAún no hay calificaciones
- Metodo Lactato DeshidrogenasaDocumento2 páginasMetodo Lactato DeshidrogenasaGrace YuquilemaAún no hay calificaciones
- 3 EnzimasDocumento41 páginas3 EnzimasRuben CabreraAún no hay calificaciones
- Clase 2 BioquimicaDocumento79 páginasClase 2 BioquimicaMichael MüllerAún no hay calificaciones
- Informe - Práctica N°6, Actividad Enzimática en Organismos VivosDocumento18 páginasInforme - Práctica N°6, Actividad Enzimática en Organismos VivosMaría Angel100% (1)
- CARTEL de La Práctica 4, NRC 13959Documento1 páginaCARTEL de La Práctica 4, NRC 13959Berenice Sanchez GalindoAún no hay calificaciones
- CARTEL de La Práctica 3, NRC 13959Documento1 páginaCARTEL de La Práctica 3, NRC 13959Berenice Sanchez GalindoAún no hay calificaciones
- Ciencias. Respiracion Aerobica y AnaerobicaDocumento5 páginasCiencias. Respiracion Aerobica y AnaerobicaPEDRO SANCHEZAún no hay calificaciones
- Determinación de La Actividad Enzimática de La Peroxidasa Extraída de Hojas de PlantaDocumento6 páginasDeterminación de La Actividad Enzimática de La Peroxidasa Extraída de Hojas de PlantaSiju NaraAún no hay calificaciones
- Laboratorio 2Documento30 páginasLaboratorio 2Luis Anthonny Fernandez Soriano33% (3)
- CE83 - Lab02 - Grupo 1ADocumento8 páginasCE83 - Lab02 - Grupo 1AMichael MendozaAún no hay calificaciones
- Qué Es Una Reacción QuímicaDocumento7 páginasQué Es Una Reacción QuímicaEmanuel alvarado lopezAún no hay calificaciones
- Enzimas 3Documento61 páginasEnzimas 3Ana María Castro NavaAún no hay calificaciones
- Laboratorio.3 BioquimicaDocumento8 páginasLaboratorio.3 BioquimicaNahomis PerezAún no hay calificaciones
- Quimica I LapsoDocumento3 páginasQuimica I LapsoJulio ColmenaresAún no hay calificaciones
- Centro de Imnovacion Tecnologica de Energia RenovableDocumento8 páginasCentro de Imnovacion Tecnologica de Energia RenovableNataly Stephanie Ibarra BautistaAún no hay calificaciones
- Cartel 4Documento1 páginaCartel 4Lolita TorresAún no hay calificaciones
- U2. Práctica Experimental. EnzimasDocumento21 páginasU2. Práctica Experimental. EnzimasJuly JassoAún no hay calificaciones
- Análisis Cualitativo de EnzimasDocumento7 páginasAnálisis Cualitativo de EnzimasMontse RcAún no hay calificaciones
- Pre-Laboratorio 2 de Fisicoquímica de AlimentosDocumento6 páginasPre-Laboratorio 2 de Fisicoquímica de AlimentosDarea X Noriega VAún no hay calificaciones
- Tesis M. Luis Esquivel, María Cancino PDFDocumento101 páginasTesis M. Luis Esquivel, María Cancino PDFluisAún no hay calificaciones
- Nomenclaura PDFDocumento8 páginasNomenclaura PDFLuis Alberto Guzman GalindoAún no hay calificaciones
- HistoenzimologíaDocumento57 páginasHistoenzimologíaDaniel Apaza SolanoAún no hay calificaciones
- Informe Acetominofén DesarrolloDocumento13 páginasInforme Acetominofén DesarrolloJorge Angeles100% (1)
- S3-Trabajo Práctico Experimental - 1Documento11 páginasS3-Trabajo Práctico Experimental - 1GIANCARLOS ISAAC PADILLA FALCONIAún no hay calificaciones
- Práctica - 6 y 7Documento1 páginaPráctica - 6 y 7Fernanda RonquilloAún no hay calificaciones
- Práctica 12Documento2 páginasPráctica 12abrahamAún no hay calificaciones
- Laboratorio N. 6 ACTIVIDAD ENZIMATICADocumento6 páginasLaboratorio N. 6 ACTIVIDAD ENZIMATICALaura TorresAún no hay calificaciones
- Informe de Monitoreo Cerro AzulDocumento34 páginasInforme de Monitoreo Cerro AzulCORDOVA GALLEGOS LEONCIOAún no hay calificaciones
- Informe 1Documento14 páginasInforme 1Cristina PaezAún no hay calificaciones
- Practica #02 Reacciones Redox - DesarrolladaDocumento10 páginasPractica #02 Reacciones Redox - DesarrolladaBC NandoAún no hay calificaciones
- Manual de prácticas de Ingeniería de Alimentos: Propiedades, operaciones y bioprocesosDe EverandManual de prácticas de Ingeniería de Alimentos: Propiedades, operaciones y bioprocesosAún no hay calificaciones
- U1-3cadena EpidemiológicaDocumento7 páginasU1-3cadena EpidemiológicaBerenice Sanchez GalindoAún no hay calificaciones
- ENTEROBACTERDocumento2 páginasENTEROBACTERBerenice Sanchez GalindoAún no hay calificaciones
- U2-1funciones Del Farmaceutico en La Salud PúblicaDocumento16 páginasU2-1funciones Del Farmaceutico en La Salud PúblicaBerenice Sanchez Galindo0% (1)
- CARTEL de La Práctica 3, NRC 13959Documento1 páginaCARTEL de La Práctica 3, NRC 13959Berenice Sanchez GalindoAún no hay calificaciones
- Cartel 2Documento1 páginaCartel 2Berenice Sanchez GalindoAún no hay calificaciones
- CARTEL de La Práctica 4, NRC 13959Documento1 páginaCARTEL de La Práctica 4, NRC 13959Berenice Sanchez GalindoAún no hay calificaciones
- Cartel 1Documento3 páginasCartel 1Berenice Sanchez GalindoAún no hay calificaciones
- Cambios de estados-TP3.docx - Documentos de GoogleDocumento6 páginasCambios de estados-TP3.docx - Documentos de GoogleLaura BaezAún no hay calificaciones
- Detonador ElectronicoDocumento4 páginasDetonador ElectronicojoscartueroAún no hay calificaciones
- Desulfuración BiológicaDocumento4 páginasDesulfuración BiológicaYan Carlos VilleroAún no hay calificaciones
- Practica 01 EXTRACIÓN DE ACEITE ESENCIALDocumento6 páginasPractica 01 EXTRACIÓN DE ACEITE ESENCIALJudith Laura CentenoAún no hay calificaciones
- Resumen Polimeros Benceno.Documento5 páginasResumen Polimeros Benceno.Noelia SayedAún no hay calificaciones
- 4.1 Especificaciones Tecnicas de ArquitecturaDocumento21 páginas4.1 Especificaciones Tecnicas de ArquitecturaBk Carhuapoma VegaAún no hay calificaciones
- ENE.-JUN. 2020: Materia: Producción Más LimpiaDocumento15 páginasENE.-JUN. 2020: Materia: Producción Más LimpiaJose Luis PerezAún no hay calificaciones
- Mecánica de Materiales ProblemasDocumento9 páginasMecánica de Materiales ProblemasRaul LugarAún no hay calificaciones
- Analisis de Precios UnitariosDocumento62 páginasAnalisis de Precios UnitariosJair Trzynadlowski100% (3)
- Actividad (Compuestos Org.)Documento2 páginasActividad (Compuestos Org.)Yuber RomañaAún no hay calificaciones
- Asentamientos Inmediatos o ElasticosDocumento17 páginasAsentamientos Inmediatos o ElasticosCarlos Eduardo Cadena Rivera100% (2)
- Transferencia de Calor Informe 1Documento7 páginasTransferencia de Calor Informe 1Russell AgamaAún no hay calificaciones
- Plano Sala 01 01-02Documento1 páginaPlano Sala 01 01-02Paolo SuazoAún no hay calificaciones
- Análisis de Costos Unitarios - MDHDocumento100 páginasAnálisis de Costos Unitarios - MDHSergioAún no hay calificaciones
- Informe de Sub Tableros Casa Andina PiuraDocumento94 páginasInforme de Sub Tableros Casa Andina PiuraSergio MenachoAún no hay calificaciones
- Debemos Recordar: K C + 273 C K - 273 F 1.8 C + 32 C F-32/1.8Documento6 páginasDebemos Recordar: K C + 273 C K - 273 F 1.8 C + 32 C F-32/1.8Valeria CalvaAún no hay calificaciones
- Tesis Revisada Huaman Rodriguez FinalllllllDocumento39 páginasTesis Revisada Huaman Rodriguez FinalllllllgiomarAún no hay calificaciones
- Exposicion Residuos Hospitalarios - Riesgos BiologicosDocumento29 páginasExposicion Residuos Hospitalarios - Riesgos BiologicosAlejandra EstupiñanAún no hay calificaciones
- 13 Acu de Forestacion y Reforestacion de LaderasDocumento132 páginas13 Acu de Forestacion y Reforestacion de LaderasFidel FidelomvAún no hay calificaciones
- NTC 1979 Industria Alimentaria. Ácido CítricoDocumento13 páginasNTC 1979 Industria Alimentaria. Ácido Cítricoredvelve_t100% (1)
- Cristalografía Recreativa - Parte1Documento36 páginasCristalografía Recreativa - Parte1Diego Alejandro Perdomo HerreraAún no hay calificaciones
- Yodometria - YodoDocumento5 páginasYodometria - YodoAlexander MeraAún no hay calificaciones
- Minerales No MetalicosDocumento7 páginasMinerales No MetalicosFernando BestAún no hay calificaciones
- Hse-Pr-25 Procedimiento Trabajo en Caliente Con Soldadura y OxicorteDocumento6 páginasHse-Pr-25 Procedimiento Trabajo en Caliente Con Soldadura y Oxicortejenifer narvaezAún no hay calificaciones
- EQUILIBRIO IÓNICO Ariel CorderoDocumento16 páginasEQUILIBRIO IÓNICO Ariel CorderoAriel Cordero100% (3)
- Infografia Minerales RocasDocumento2 páginasInfografia Minerales RocasWilmer VillamizarAún no hay calificaciones
- Practica de Solubilidad de Las Aminas.Documento17 páginasPractica de Solubilidad de Las Aminas.Alejandra Palacios100% (1)
- QMC - Lab 2Documento7 páginasQMC - Lab 2Nsisnsin NwiwnsbdbAún no hay calificaciones
- METALURGIA - RECUPERATIVA.Prof. Walter Pardavé PDFDocumento75 páginasMETALURGIA - RECUPERATIVA.Prof. Walter Pardavé PDFSonia Luz Bermudez LozanoAún no hay calificaciones
- FlexografíaDocumento196 páginasFlexografíaelizabeth gordillo100% (3)