Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Miscibilidad, Solubilidad y Temperatura
Cargado por
PAULA ALEJANDRA PLATA LOPEZTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Miscibilidad, Solubilidad y Temperatura
Cargado por
PAULA ALEJANDRA PLATA LOPEZCopyright:
Formatos disponibles
Informe de Laboratorio de Química I Fecha: Febrero 10 del 2022
Miscibilidad, Solubilidad y Temperatura
Luisa Fernanda Cardona Gómez luisa.cardona3@udea.edu.co
Paula Alejandra Plata López paula.plata@udea.edu.co
Resumen: La práctica del laboratorio consistió en comparar la miscibilidad del Yodo en varios solventes, también de diversos
líquidos en hexano, para ello utilizamos varios tubos de ensayos y tapones de caucho con el fin de que al agitar la solución no se
derramara, por otra parte realizamos la solubilidad del nitrato de potasio y el cloruro de potasio en agua, por medio del baño maría
utilizando un termómetro para tomar la temperatura de la solución cuando el soluto estuviera disuelto completamente y al
momento de presentarse turbidez, según la cantidad y volumen especificados en la guia.
Keywords: Baño maría, solubilidad, mezcla, solventes, temperatura, miscibilidad.
1)
4) Datos y cálculos
2) Objetivos
a. Comparar la miscibilidad de algunos solutos en Parte A
varios solventes.
b. Analizar la influencia de la polaridad en la Miscibilidad del yodo en varios solventes
miscibilidad de una sustancia en otra.
c. Estudiar cómo varía la solubilidad en agua de un Sustancias:
Agua+ Etanol Hexano+ Ciclohexano
compuesto puro, con la temperatura. Yodo +Yodo Yodo +Yodo
Miscibilidad 1 5 4 4
d. Relacionar la solubilidad con el equilibrio que se Color Amarillo Cafe Rojo tinto Violeta
establece entre el soluto disuelto y el soluto sin
disolver en el momento de la saturación.
Miscibilidad de diversos líquidos en hexano
3) Diagrama de flujo
Hexano+ Hexano Hexano+ Hexano+Ciclo
Fases Agua +Etanol Glicerol hexano
Número 2 1 2 1
Adición de etanol a las mezclas binarias
Número de fases Altura de la fase
Sustancia Al Inferior
Al final Superior (mm)
principio (mm)
Agua 2 2 10 mm 15 mm
Glicerol 2 3 11 mm 15 mm
Ciclohexano 1 1 12.5 mm 17 mm
Parte B
Solubilidad en agua de algunas sales
KNO3 KCl
V (mL) T (°C) S V (mL) T (°C) S
3,0 79.2 °C 61 °C 12,0 95.1 °C 40.8°C
4,0 75.2 °C 59.4 °C 13,0 54.7 °C 29.5 °C
5,0 66.5 °C 51.8 °C
6,0 62.5 °C 49.1 °C
7,0 60.0 °C 48.2 °C
8,0 65.0 °C 39.2 °C
Para calcular la solubilidad se usó la siguiente ecuación:
𝑔𝑟𝑎𝑚𝑜𝑠 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜
δ= 𝑔𝑟𝑎𝑚𝑜𝑠 𝑑𝑒 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒
𝑥 100
4.00𝑔 𝐾𝑁𝑂3
δ= 3.00 𝑔 𝐻2𝑂
𝑥 100 = 133. 3%
Laboratorio de Química 1 v.2021-2
Laboratorio de Química 1 v.2021-2 2 of 2
5) Análisis de resultados
El comportamiento de la solución nos habla de una
Al realizar la práctica en condiciones de T y P reacción endotérmica, esta necesito calor para lograr la
constantes, los factores a analizar de las sustancias en difusión del soluto y la gráfica de solubilidad vs
solución serán los concernientes a la naturaleza de cada temperatura tiende a ser descendiente. Los datos
uno de los elementos en participación. En el primer tomados arrojan una pequeña curva/desviación que se
ejercicio de la parte A encontramos al yodo, un puede deber a un error en la toma de datos pues se
molécula apolar, al entrar en contacto con el agua, un esperaría que el comportamiento de la solución sea
compuesto polar, no se disuelve; la naturaleza disímil constante, a menor porcentaje de solubilidad la
de ambos no favorece la unión de sus moléculas, sus temperatura requerida para la difusión es menor.
estructuras moleculares tienen ángulos distintos, y no
se da la formación de puentes de hidrógeno. En el 6) Conclusiones
etanol, a pesar de ser una molécula polar, logró disolver
el yodo, esto por que aunque tiene el grupo el etanol En la práctica de hoy se logró comparar la miscibilidad
cuenta con OH, el resto de su estructura cuenta con de algunos solidos en varios solventes puesto que
unos enlaces de características apolares permitiéndole analizamos la influencia de la polaridad en el momento
al yodo integrarse con la molécula del etanol. en cuanto de mezclarse una sustancia en otra, por otra parte
al yodo con el hexano y el ciclohexano, este debió también se pudo realizar la solubilidad de una
disolverse por completo ya que los tres son moléculas sustancia pura que puede variar debido a su
apolares, tienen afinidad y logran enlazarse entre sí, no temperatura. La solubilidad de sólidos en líquidos
obstante, la cantidad de yodo administrada en ambos aumenta al aumentar la temperatura, ya que estos
tubos no fue la adecuada para la cantidad de solvente procesos de disolución son por lo general endotérmicos
utilizado, esto afectó la difusión completa del soluto. porque hay absorción de calor.
*Se considera la miscibilidad del yodo en el agua en un
valor de 1, pues si bien este no se disuelve, si tiene una Cuando se realizó la solubilidad de hexano en los
reacción con el solvente. diferentes solventes (agua , glicerol y ciclohexano) en la
este comportamiento lo vemos también en las pruebas única sustancia que se observó una mezcla homogénea
con el hexano y los distintos solventes. Las con una sola fase fue el ciclohexano, lo que significa que
características del etanol, anteriormente mencionadas, ambas sustancias son apolares.
permiten la difusión de las moléculas del hexano. La
mezcla de hexano en ciclohexano se da en una fase, lo
que responde a la similitud de ambas moléculas. Al
agregar el etanol en la mezcla con agua no aumenta la
cantidad de fases debido a que este logra su difusión
con el agua, a diferencia de este con la glicerina, pues
ninguno de los tres compuestos tiene afinidad para la
interacción con los demás, aumentando las fases de la
mezcla.
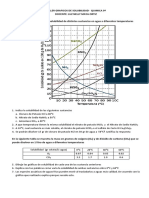
➔ Gráfica Solubilidad KNO3 vs Temperatura
También podría gustarte
- Simulacro #1 Udea RespuestasDocumento10 páginasSimulacro #1 Udea RespuestasAna Maria Astudillo100% (1)
- Para Responder Este Examen Dispones de 240 Minutos en TotalDocumento24 páginasPara Responder Este Examen Dispones de 240 Minutos en TotalMiguel NaranjoAún no hay calificaciones
- Evaluación densidad cubos flotaciónDocumento5 páginasEvaluación densidad cubos flotaciónMaria Pilar Vio Jeanneret20% (5)
- Simulacro H11 Sesión 2Documento4 páginasSimulacro H11 Sesión 2santi rosasAún no hay calificaciones
- Informe SolubilidadDocumento5 páginasInforme SolubilidadMike GonzalesAún no hay calificaciones
- Expansión Térmica: Dilatación de Sólidos, Líquidos y GasesDocumento12 páginasExpansión Térmica: Dilatación de Sólidos, Líquidos y GasesRosmery RodriguezAún no hay calificaciones
- Ejercicios de Aplicación SolucionesDocumento7 páginasEjercicios de Aplicación SolucionesCall Center Direccion de Salud EscolarAún no hay calificaciones
- Informe 3 DensidadDocumento5 páginasInforme 3 DensidadJaimie GardnerAún no hay calificaciones
- Cromatografia Sobre PapelDocumento29 páginasCromatografia Sobre PapelLuis Alberto Rueda FunesAún no hay calificaciones
- Informe de Laboratorio de MedicionesDocumento4 páginasInforme de Laboratorio de MedicionesSANTIAGO FRANCO LONDOÑOAún no hay calificaciones
- Guia de BiologiaDocumento3 páginasGuia de BiologiaDiana Palomino LopezAún no hay calificaciones
- Examen DiazMiguelDocumento4 páginasExamen DiazMiguelMigudp15Aún no hay calificaciones
- 10 Física Competencia I TrimestreDocumento5 páginas10 Física Competencia I TrimestreAida ArciniegasAún no hay calificaciones
- Taller GraficasDocumento7 páginasTaller GraficasJuan Sebastian Elvira GiraldoAún no hay calificaciones
- Laboratorios 7 CarbohidratosDocumento8 páginasLaboratorios 7 Carbohidratossofia arroyo castilloAún no hay calificaciones
- resultados prueba estudiante isabela carvajalDocumento4 páginasresultados prueba estudiante isabela carvajalIsabela Carvajal osorioAún no hay calificaciones
- BIOLOGIADocumento35 páginasBIOLOGIANatalia SalcedoAún no hay calificaciones
- MagnitudesDocumento3 páginasMagnitudeschachunnittahAún no hay calificaciones
- Taller tipo parcial capitulos 3, 4 ,5 ,6Documento5 páginasTaller tipo parcial capitulos 3, 4 ,5 ,6Sofía ViteriAún no hay calificaciones
- Taller de Quimica Formula Empirica y Formula MolecularDocumento1 páginaTaller de Quimica Formula Empirica y Formula MolecularFabricio RodriguezAún no hay calificaciones
- Preinforme de Laboratorio Balance de Materia UnadDocumento10 páginasPreinforme de Laboratorio Balance de Materia UnadJuan Carlos Restrepo SalcedoAún no hay calificaciones
- Taller 2 Segundo Semestre 2021 QuimicaDocumento4 páginasTaller 2 Segundo Semestre 2021 QuimicaSEBASTIAN ACEVEDOAún no hay calificaciones
- Anexo 3 - Datos Cinética Enzimática de La Lactasa en Una Industria LácteaDocumento4 páginasAnexo 3 - Datos Cinética Enzimática de La Lactasa en Una Industria LácteaAndres HerrerasAún no hay calificaciones
- Taller de Químic1Documento6 páginasTaller de Químic1Edirley EscalanteAún no hay calificaciones
- Informe PDFDocumento9 páginasInforme PDFluisa niñoAún no hay calificaciones
- Guía de Trabajo Cifras Significativas C&DDocumento3 páginasGuía de Trabajo Cifras Significativas C&DAndresDavidSolarteVidalAún no hay calificaciones
- Leyes de Los Gases - EjerciciosDocumento8 páginasLeyes de Los Gases - EjerciciosOscar Leonel Torres CruzAún no hay calificaciones
- Simulacro H11 Sesión 1Documento4 páginasSimulacro H11 Sesión 1Andres100% (2)
- Unidadesfisicasdeconcentracionensoluciones 120504173747 Phpapp01Documento8 páginasUnidadesfisicasdeconcentracionensoluciones 120504173747 Phpapp01Mejía DuránAún no hay calificaciones
- T1 (Alvaro Cantillo-Gabriel Rueda)Documento5 páginasT1 (Alvaro Cantillo-Gabriel Rueda)ALVARO ENRIQUE CANTILLO GUZMANAún no hay calificaciones
- Titulación Con PotenciométroDocumento7 páginasTitulación Con PotenciométroPaula JimenezAún no hay calificaciones
- Punto de ebullición constanteDocumento4 páginasPunto de ebullición constanteluz stella Delgado PicoAún no hay calificaciones
- Propiedades de los líquidos y densidadDocumento5 páginasPropiedades de los líquidos y densidadjorge eliecer carrillo vargasAún no hay calificaciones
- Guia de Aplicación Iii PeriodoDocumento9 páginasGuia de Aplicación Iii Periodomaria del mar TrianaAún no hay calificaciones
- Funciones de los carbohidratos y fenómenos relacionados con la luzDocumento8 páginasFunciones de los carbohidratos y fenómenos relacionados con la luzJhosua Ricardo pachecoAún no hay calificaciones
- Taller de Refuerzo Icfes QuimicaDocumento9 páginasTaller de Refuerzo Icfes QuimicaSarara Villegas 21Aún no hay calificaciones
- Determinacion de Acidez FinalDocumento9 páginasDeterminacion de Acidez FinalKristian Nn'ga JulcaAún no hay calificaciones
- Pauta de Corrección Taller Disoluciones II MEDIODocumento3 páginasPauta de Corrección Taller Disoluciones II MEDIOMaría TemucoAún no hay calificaciones
- Ejercicios Fisicoquimica 1Documento6 páginasEjercicios Fisicoquimica 1Jefersson Asis LunarejoAún no hay calificaciones
- Práctica 12 Efecto FotoelectricoDocumento8 páginasPráctica 12 Efecto FotoelectricoTania AguileraAún no hay calificaciones
- Propiedades líquidos sólidosDocumento16 páginasPropiedades líquidos sólidosisrael salazarAún no hay calificaciones
- Taller de HidrostaticaDocumento4 páginasTaller de HidrostaticaKarenAún no hay calificaciones
- INFORME-5 - Viscosidad MetanolDocumento6 páginasINFORME-5 - Viscosidad MetanolErika GabrielaAún no hay calificaciones
- Práctica 4. Ley de Enfriamiento de NewtonDocumento6 páginasPráctica 4. Ley de Enfriamiento de NewtonCitlalli BautistaAún no hay calificaciones
- Practica de Laboratorio... Acidez Del VinagreDocumento7 páginasPractica de Laboratorio... Acidez Del VinagreJunior Galvez VenegasAún no hay calificaciones
- Cálculo aumento ebulloscópico y descenso crioscópico solución sacarosaDocumento5 páginasCálculo aumento ebulloscópico y descenso crioscópico solución sacarosa1lvaro1javier1mej1a1100% (2)
- Estequiometría química problemas resueltosDocumento8 páginasEstequiometría química problemas resueltosPablo LemaAún no hay calificaciones
- Quimica (1) K, VDocumento2 páginasQuimica (1) K, Vorlidis espitia avilaAún no hay calificaciones
- Quimica 165Documento5 páginasQuimica 165Mariana Ortegon100% (1)
- Prueba Lectura Español10Documento5 páginasPrueba Lectura Español10JESUS PADILLA75% (4)
- Ejercicio 1, Agentes QuímicosDocumento12 páginasEjercicio 1, Agentes QuímicosLeison Ocoró CarabalíAún no hay calificaciones
- Si en Estados Unidos Se Empleara Todo El MetanoDocumento6 páginasSi en Estados Unidos Se Empleara Todo El MetanoISABELLA COBO VARGASAún no hay calificaciones
- Determinación de La Densidad Con Diferentes Figuras de AluminioDocumento4 páginasDeterminación de La Densidad Con Diferentes Figuras de AluminioBrayan Esteban Guerrero Hermida100% (1)
- Simulacro H12 Sesión 1Documento4 páginasSimulacro H12 Sesión 1G.A. Rodríguez100% (1)
- Solubilidad sustancias agua temperaturaDocumento1 páginaSolubilidad sustancias agua temperaturaLuz Nelly Maya OrtizAún no hay calificaciones
- Balanceo de EcuacionesDocumento2 páginasBalanceo de EcuacionesAngelica Murillo100% (1)
- GUIA # 1 2 SEMESTRE CLEI 6 Luis JoséDocumento7 páginasGUIA # 1 2 SEMESTRE CLEI 6 Luis JoséAna JoleanisAún no hay calificaciones
- Balance de MateriaDocumento10 páginasBalance de MateriaOmar Roy CB50% (6)
- MiscibilidadDocumento5 páginasMiscibilidadDANIELA GARCIA POSADAAún no hay calificaciones
- Practica 5 - Solubilidad de Compuestos OrganicosDocumento10 páginasPractica 5 - Solubilidad de Compuestos OrganicosJhostin Niño100% (1)
- Taller 3 QDocumento1 páginaTaller 3 QPAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Rutina alimentaria saludableDocumento74 páginasRutina alimentaria saludablePAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Alimentos Naturales MacronutrientesDocumento8 páginasAlimentos Naturales MacronutrientesPAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Guía Recetas - Gratuita RTMDocumento32 páginasGuía Recetas - Gratuita RTMPAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Tickets 1336765364Documento2 páginasTickets 1336765364PAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Safari - 19 - 06 - 2022, 4:42 P. M.Documento1 páginaSafari - 19 - 06 - 2022, 4:42 P. M.PAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Examen Fundamentación - Física. Lunes 31-01-2022Documento2 páginasExamen Fundamentación - Física. Lunes 31-01-2022PAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Copia de Actividad - 2Documento1 páginaCopia de Actividad - 2PAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- FenolftaleínaDocumento8 páginasFenolftaleínaDev LoynesAún no hay calificaciones
- Química I Laboratorio Densidad Sólidos Tres MétodosDocumento2 páginasQuímica I Laboratorio Densidad Sólidos Tres MétodosPAULA ALEJANDRA PLATA LOPEZAún no hay calificaciones
- Copia de Actividad3Documento2 páginasCopia de Actividad3Maria Camila Giraldo CarmonaAún no hay calificaciones
- Catalogo de Somta en EspanolDocumento225 páginasCatalogo de Somta en EspanolSergio Menchù100% (2)
- Plan de Gestión de Residuos TipoDocumento9 páginasPlan de Gestión de Residuos TipoandresgouldAún no hay calificaciones
- Fuerzas Sobre Las ChumacerasDocumento5 páginasFuerzas Sobre Las ChumacerasRenzo Sebastián Salazar ArévaloAún no hay calificaciones
- Problemas Reforzamiento MM1 I II UnidadDocumento6 páginasProblemas Reforzamiento MM1 I II UnidadhellenAún no hay calificaciones
- 10.3 Detalles Del Diseño de ColumnasDocumento10 páginas10.3 Detalles Del Diseño de ColumnasMario Joel GNAún no hay calificaciones
- Diseño de estructura de concreto armadoDocumento15 páginasDiseño de estructura de concreto armadoAna Mayerli Zamora TobarAún no hay calificaciones
- 5 Ta Tarea Tema Oxidos y AnhidridosDocumento1 página5 Ta Tarea Tema Oxidos y AnhidridosCesar DelgadoAún no hay calificaciones
- Guía de estequiometría en reacciones químicasDocumento4 páginasGuía de estequiometría en reacciones químicasAriel Soza SepulvedaAún no hay calificaciones
- QUIMICADocumento5 páginasQUIMICAmonica consueloAún no hay calificaciones
- CLASE 6 - TermodinámicaDocumento7 páginasCLASE 6 - TermodinámicaDiego JimenezAún no hay calificaciones
- Cap 5 Moldes y Modelos para AlDocumento106 páginasCap 5 Moldes y Modelos para AlLibros ArgónAún no hay calificaciones
- NTC 2206 EléctricoDocumento26 páginasNTC 2206 EléctricoantorvezadiazAún no hay calificaciones
- NORMA E.100: BambúDocumento55 páginasNORMA E.100: BambúAlexanderDanielloAún no hay calificaciones
- Traducción de Microsegregación y MacrosegregaciónDocumento14 páginasTraducción de Microsegregación y Macrosegregacióncoreano63100% (1)
- Examen Suficiencia Top - Esp.i.q.serv - Ind - 2023Documento6 páginasExamen Suficiencia Top - Esp.i.q.serv - Ind - 2023CarlosAún no hay calificaciones
- Protocolo de Emergencia Fuga de CloroDocumento6 páginasProtocolo de Emergencia Fuga de CloroKatherine100% (1)
- Cal y Yeso MonografiaDocumento36 páginasCal y Yeso MonografiaAlejandro GarciaAún no hay calificaciones
- Monografia Determinacion Del Zinc Ley BajaDocumento30 páginasMonografia Determinacion Del Zinc Ley BajaEdson Hurtado0% (1)
- Nomenclatura 2017Documento23 páginasNomenclatura 2017esmeralda GAITANAún no hay calificaciones
- Lincol Electric PEUDocumento2 páginasLincol Electric PEUMirian PGAún no hay calificaciones
- 7.2 Estudio de SuelosDocumento77 páginas7.2 Estudio de SuelosCami BaskesAún no hay calificaciones
- Trabajos de Investigación (OSINERGMIN)Documento349 páginasTrabajos de Investigación (OSINERGMIN)VíctorBerrospiEusebio100% (1)
- AbelsonitaDocumento2660 páginasAbelsonitajuan aldair garcia del angelAún no hay calificaciones
- Word Proyecto FinalDocumento24 páginasWord Proyecto FinalElias MoralesAún no hay calificaciones
- Proyecto de Reciclaje de PlásticosDocumento8 páginasProyecto de Reciclaje de PlásticosJoaquin Valdez Fernandez100% (1)
- PROCEDIMIENTO TRABAJOS EN CALIENTE OkDocumento8 páginasPROCEDIMIENTO TRABAJOS EN CALIENTE OkjhazAún no hay calificaciones
- Configuracion Electronica de Los Elementos de TranscisionDocumento8 páginasConfiguracion Electronica de Los Elementos de TranscisionleidyAún no hay calificaciones
- Calorimetría y TermodinámicaDocumento5 páginasCalorimetría y TermodinámicaMaria Del RosarioAún no hay calificaciones