Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Solventes Proticos y Aproticos
Cargado por
Fabian Melinao0 calificaciones0% encontró este documento útil (0 votos)
7 vistas2 páginassolventes
Título original
Solventes Proticos y Aproticos Docx
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentosolventes
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
7 vistas2 páginasSolventes Proticos y Aproticos
Cargado por
Fabian Melinaosolventes
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
Dentro de los solventes polares, se encuentran:
1) los que son próticos
2) los que son apróticos.
Un solvente polar prótico, es aquel que es capaz de estabilizar las cargas al
formar puentes de hidrógeno con ellas. Por otro lado, uno aprótico y polar, es
aquel que es capaz de formar una capa fuerte de solvatación solo alrededor de un
catión, sin formar puente de hidrógeno.
El solvente prótico es capaz de solvatar cationes y aniones puesto que ambos
polos de su dipolo están fácilmente disponibles. En el ejemplo de más abajo, que
corresponde a una molécula de alcohol, el protón que es la parte positiva del
dipolo del solvente, es muy pequeño y produce muy poco impedimento estérico al
oxígeno que es la parte negativa del dipolo.
los dos polos del dipolo
están fácilmente disponibles
disponible
R
RR O
C O
H
R dificilmente disponible
por impedimento estérico
PRÓTICO APRÓTICO
En el caso de un solvente aprótico (el ejemplo corresponde a una molécula
de acetona), el oxígeno que es el polo negativo del dipolo, esta disponible para
solvatar una carga positiva. Sin embargo el polo positivo del solvente, que es el
carbono en este caso, queda oculto e impedido por el oxígeno y por los grupos
alquilo voluminosos. El polo positivo del solvente entonces no será capaz de
acercarse al ión negativo y solvatarlo. Por esta razón, los solventes polares
apróticos son capaces de solvatar sólo las cargas positivas o cationes.
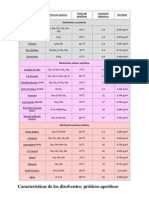
En la siguiente lista de solventes comunes, se cubre un rango de
polaridades y se los cataloga como de tipo prótico o apróticos:
Solvente Fórmula Cte. Dieléctrica Tipo polar
Agua H2O 78,5 Prótico
Ácido Fórmico HCOOH 59,0 Prótico
Dimetilsulfóoxido CH3SOCH3 49,0 Aprótico
Dimetilformamida HCON(CH3)2 36,7 Aprótico
Acetonitrilo CH3CN 36,2 Aprótico
Metanol CH3OH 32,6 Prótico
Hexametilfosforamida ((CH3)2N)3PO 30,0 Aprótico
Etanol CH3CH2OH 24,0 Prótico
Acetona CH3COCH3 20,7 Aprótico
Ácido Acético CH3COOH 6,0 Prótico
También podría gustarte
- Reporte Práctica 8 - Síntesis de Colorantes AzoicosDocumento15 páginasReporte Práctica 8 - Síntesis de Colorantes AzoicosAndy Aldama100% (2)
- Sintesis de Naranja de MetiloDocumento8 páginasSintesis de Naranja de MetiloJAVIER EDUARDO HERNANDEZ SANCHEZ0% (1)
- DisolventeDocumento4 páginasDisolventejuliob412Aún no hay calificaciones
- Informe Punto Isosbestico.Documento13 páginasInforme Punto Isosbestico.Jesus Gerardo Lopez ColmanAún no hay calificaciones
- Guia de Quimica Organica-Intermediarios de ReaccionDocumento7 páginasGuia de Quimica Organica-Intermediarios de ReaccionJose Hernandz0% (2)
- Efecto o Desplazamiento BatocrómicoDocumento3 páginasEfecto o Desplazamiento BatocrómicoMakiiz Castillo García100% (3)
- Influencia de PH en RedoxDocumento16 páginasInfluencia de PH en RedoxAragón RicardoAún no hay calificaciones
- Formato Estudio IluminaciónDocumento12 páginasFormato Estudio IluminaciónFabiola Juárez100% (1)
- Preparacion y Purificacion de ColoidesDocumento1 páginaPreparacion y Purificacion de Coloides.:("*"BLacK BuLLeT"*"):.50% (2)
- Solucionario Quimica Organica Bruice 5dDocumento433 páginasSolucionario Quimica Organica Bruice 5dLauroGarcía93% (59)
- Reporte de Destilación Fraccionada FES ZDocumento8 páginasReporte de Destilación Fraccionada FES ZIan Cervantes100% (1)
- Ley de Lambert - BeerDocumento57 páginasLey de Lambert - BeerChincoyaFAún no hay calificaciones
- Cetonas y Aldehidos ConclDocumento3 páginasCetonas y Aldehidos ConclRubén Rodríguez GonzálezAún no hay calificaciones
- BRIGADA CONTRAINCENDIO Manual Del ParticDocumento42 páginasBRIGADA CONTRAINCENDIO Manual Del ParticSayuki PaucarAún no hay calificaciones
- Los Compuestos de Coordinación y Su Importancia Biológica e IndustrialDocumento4 páginasLos Compuestos de Coordinación y Su Importancia Biológica e IndustrialMaribel Bolivar Viza0% (1)
- Informe de Laboratorio de Química Orgánica II: Nitración Del Benzoato de MetiloDocumento7 páginasInforme de Laboratorio de Química Orgánica II: Nitración Del Benzoato de MetiloCarolina Sánchez63% (8)
- P-Bromoacetanilida PRACTICA PDFDocumento3 páginasP-Bromoacetanilida PRACTICA PDFJahuey Unalesco50% (4)
- Ley de Aditividad de AbsorbanciasDocumento4 páginasLey de Aditividad de AbsorbanciasMariana Corzo80% (5)
- Cuestionario Cromatografia PDFDocumento3 páginasCuestionario Cromatografia PDFBlanca LechugaAún no hay calificaciones
- Practica 6 Peso Molecular Por Metodo de RastDocumento6 páginasPractica 6 Peso Molecular Por Metodo de RastJavier RG100% (2)
- Destilacion Acetona FraccionadaDocumento10 páginasDestilacion Acetona FraccionadaMaurilio Hu50% (2)
- Extraccion de Eugenol A Partir de Clavo de OlorDocumento10 páginasExtraccion de Eugenol A Partir de Clavo de OlorWil Mon0% (1)
- Extracción Con Disolventes ActivosDocumento9 páginasExtracción Con Disolventes ActivosPablo Ramírez75% (4)
- Def Taller BioestaDocumento8 páginasDef Taller BioestaWILLIAM ANDRES OVALLE VILLARRAGAAún no hay calificaciones
- Condensación Aldólica Cruzada o MixtaDocumento2 páginasCondensación Aldólica Cruzada o Mixtalaura_pascual_1Aún no hay calificaciones
- Práctica-2 (Cuestionario)Documento4 páginasPráctica-2 (Cuestionario)Rodolfo Torres50% (4)
- Diagrama de FlujoDocumento2 páginasDiagrama de FlujoAtzhiri Guevara0% (1)
- Previo Sintesis de B-NerolinaDocumento13 páginasPrevio Sintesis de B-NerolinaRicardo Martinez Jimenez50% (2)
- Práctica 7. Síntesis de CiclohexenoDocumento3 páginasPráctica 7. Síntesis de CiclohexenoRoberto Viramontes25% (4)
- Estructura Quimica de Las Ftalainas y Sus Miembros Mas ImportantesDocumento2 páginasEstructura Quimica de Las Ftalainas y Sus Miembros Mas ImportantesbrenchhhAún no hay calificaciones
- DERIVADOS HALOGENADOS (Obtencion de Cloruro de CiclohexiloDocumento12 páginasDERIVADOS HALOGENADOS (Obtencion de Cloruro de Ciclohexilo.:("*"BLacK BuLLeT"*"):.100% (3)
- Calor de Hidrogenación en La Estabilidad de AlquenosDocumento4 páginasCalor de Hidrogenación en La Estabilidad de AlquenosAnthony100% (1)
- Acidez de Hidrógenos AlfaDocumento2 páginasAcidez de Hidrógenos AlfaBeymar ContrerasAún no hay calificaciones
- Ácido FenoxiaceticoDocumento2 páginasÁcido FenoxiaceticoGammaCSAún no hay calificaciones
- Práctica 1. Isomería Cis - TransDocumento8 páginasPráctica 1. Isomería Cis - TransAndres Ordoñez100% (2)
- Cromatografia Bidimensional PDFDocumento5 páginasCromatografia Bidimensional PDFArgelia Camacho50% (2)
- El Grafico A Continuación Corresponde A La Valoración Conductimétrica de Un Ácido FuerteDocumento3 páginasEl Grafico A Continuación Corresponde A La Valoración Conductimétrica de Un Ácido FuerteFabian RegaladoAún no hay calificaciones
- Práctica 10 Síntesis de BenciloDocumento5 páginasPráctica 10 Síntesis de BenciloValezAún no hay calificaciones
- Diazotación y CopulaciónDocumento30 páginasDiazotación y CopulaciónAnonymous f2jfkXRkO78% (9)
- Mecanismo de La Reacción de CannizzaroDocumento8 páginasMecanismo de La Reacción de CannizzaroKaterin Liliana Núñez PiñerezAún no hay calificaciones
- Manual de Practicas de Organica IIDocumento42 páginasManual de Practicas de Organica IIEverardo Zamudio Hernandez67% (3)
- Punto Estequiométrico TocanoDocumento2 páginasPunto Estequiométrico TocanoFanny AlevaAún no hay calificaciones
- Acido Picrico ObtencionDocumento4 páginasAcido Picrico ObtencionCatalino de la MAún no hay calificaciones
- Practica No 4 Obtencion de Un Eter Sintesis Del B Metoxinaftaleno Nerolina Sintesis de Williamson PDFDocumento26 páginasPractica No 4 Obtencion de Un Eter Sintesis Del B Metoxinaftaleno Nerolina Sintesis de Williamson PDFBerenice Atzin100% (2)
- Metodos para Determinar Punto de FusionDocumento2 páginasMetodos para Determinar Punto de FusionFabiola Gonzales Castillo100% (1)
- Práctica 2Documento6 páginasPráctica 2AdelmoRosasAnayaAún no hay calificaciones
- Aplicaciones de Los Complejos en Quimica AnaliticaDocumento1 páginaAplicaciones de Los Complejos en Quimica AnaliticaFranz Danylo MachadoAún no hay calificaciones
- Calif: 8.0: Benemérita Universidad Autónoma de PueblaDocumento6 páginasCalif: 8.0: Benemérita Universidad Autónoma de PueblaMonserrat HernandezAún no hay calificaciones
- 1.sintesis Bromuro de N-ButiloDocumento6 páginas1.sintesis Bromuro de N-Butilojuancho95400Aún no hay calificaciones
- Destilación A Presión ReducidaDocumento8 páginasDestilación A Presión ReducidaPablo Ramírez92% (13)
- 1.extraccion de PB Con DitizonaDocumento5 páginas1.extraccion de PB Con DitizonaLa Kochera Asociación JuvenilAún no hay calificaciones
- Epoxidos Informe 4 FaltaDocumento26 páginasEpoxidos Informe 4 FaltaLuis Blanco PiñellaAún no hay calificaciones
- Diazotación o DiazoaciónDocumento8 páginasDiazotación o DiazoaciónMiguel Angel Reyes Vasquez100% (1)
- Práctica 7. Halogenuros de AlquiloDocumento7 páginasPráctica 7. Halogenuros de AlquiloReimary Gusman0% (1)
- Tratamiento para Los Cuerpos de Ebullición Piedritas de Tezontle.Documento1 páginaTratamiento para Los Cuerpos de Ebullición Piedritas de Tezontle.Duulce Anaai100% (1)
- 11 Aldehidos y CetonasDocumento15 páginas11 Aldehidos y Cetonasedson0% (1)
- Examen Parcial de Quimica 2 Fia-Uni (Masguito)Documento9 páginasExamen Parcial de Quimica 2 Fia-Uni (Masguito)Ricardo ChuraAún no hay calificaciones
- Parcial SolucionDocumento4 páginasParcial Soluciondarkwolf1003Aún no hay calificaciones
- Aldehidos y CetonasDocumento39 páginasAldehidos y CetonasKEVIN SMITH SURICHAQUI PARHUAYAún no hay calificaciones
- Identificación Aldehídos, Cetonas y Ácidos CarboxílicosDocumento32 páginasIdentificación Aldehídos, Cetonas y Ácidos CarboxílicosAndres SantiagoAún no hay calificaciones
- Laboratorio Quimica OrganicaDocumento43 páginasLaboratorio Quimica OrganicaRyo Poma100% (1)
- Acidez en Moléculas OrganicasDocumento109 páginasAcidez en Moléculas OrganicasAlicia SanchezAún no hay calificaciones
- Fuentes Emisoras de SonidoDocumento2 páginasFuentes Emisoras de SonidoMilagros GonzalezAún no hay calificaciones
- Corrientes MarinasDocumento21 páginasCorrientes MarinasGeymer Silva CubasAún no hay calificaciones
- Ejercicios de HidrostáticaDocumento6 páginasEjercicios de HidrostáticaPaco Medina CondorAún no hay calificaciones
- Balanceo RedoxDocumento3 páginasBalanceo RedoxAndrea GonzálezAún no hay calificaciones
- Taller de Flujo PDFDocumento2 páginasTaller de Flujo PDFIsaac Oviedo RinconAún no hay calificaciones
- Manual ERV1050x600x500Documento27 páginasManual ERV1050x600x500Luis Pinto RojasAún no hay calificaciones
- Transformada de Una Integral y de Una División Entre TDocumento3 páginasTransformada de Una Integral y de Una División Entre TVictor Angel Guevara LarreaAún no hay calificaciones
- Echavarria, M - Echeverria, A Informe 5Documento13 páginasEchavarria, M - Echeverria, A Informe 5Antonia Echeverría RingelingAún no hay calificaciones
- A. MEMORIA DE CÁLCULODocumento13 páginasA. MEMORIA DE CÁLCULOCARLO GONCHI UNOAún no hay calificaciones
- Pregunta 2: Enunciado de La PreguntaDocumento11 páginasPregunta 2: Enunciado de La PreguntaKaren AriasAún no hay calificaciones
- Uso Del Teodolito Electrónico en La Ing Civil (Titulame)Documento23 páginasUso Del Teodolito Electrónico en La Ing Civil (Titulame)Pakoo FedererAún no hay calificaciones
- SandaliasDocumento6 páginasSandaliasyucetrogrupreAún no hay calificaciones
- T P N 3 Cinematica 2020 ResultDocumento2 páginasT P N 3 Cinematica 2020 ResultLuciano DanieleAún no hay calificaciones
- Tarea I Cálculo VectorialDocumento7 páginasTarea I Cálculo VectorialStalyn EncarnacionAún no hay calificaciones
- HoEo JARDINES DE PENTADocumento13 páginasHoEo JARDINES DE PENTAJorgito PacaraAún no hay calificaciones
- Desgaste en Bombas-CorrosionDocumento10 páginasDesgaste en Bombas-CorrosionEduardo Alex Julca OrdoñezAún no hay calificaciones
- 10 Cuestionario Matematicas 10Documento9 páginas10 Cuestionario Matematicas 10Alejandro CerraAún no hay calificaciones
- Cuestionario 2o Parcial Otoñ2020Documento2 páginasCuestionario 2o Parcial Otoñ2020ToñoAún no hay calificaciones
- 1 - Lab AmpDocumento3 páginas1 - Lab Ampjulioa.prietorAún no hay calificaciones
- Investigacion Unidad1Documento24 páginasInvestigacion Unidad1Zay VictorianoAún no hay calificaciones
- Borrador Informe TCTBADocumento13 páginasBorrador Informe TCTBAAlejandro MartinezAún no hay calificaciones
- Guía Laboratorio 5 PDFDocumento2 páginasGuía Laboratorio 5 PDFFausto ArandaAún no hay calificaciones
- Trabajo Autonomo 2.2Documento3 páginasTrabajo Autonomo 2.2Danny CruzAún no hay calificaciones
- Guia 2 Fisica 2 MedioDocumento9 páginasGuia 2 Fisica 2 Mediopablo antonio cuellar aguileraAún no hay calificaciones
- Laboratorio 6 - Electricidad 1Documento8 páginasLaboratorio 6 - Electricidad 1Diego GomezAún no hay calificaciones
- Proyecto NR 4Documento2 páginasProyecto NR 4JHARPA NHYNHAAún no hay calificaciones
- RejillasDocumento31 páginasRejillasMARIAAún no hay calificaciones
- Monografia FinalDocumento21 páginasMonografia FinalAdrian VegaAún no hay calificaciones