0% encontró este documento útil (0 votos)
147 vistas14 páginasReacciones Químicas: Práctica I y II
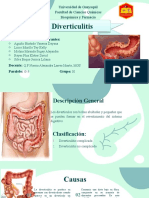
REACCIONES QUÍMICAS I Y II: Definir qué es una reacción química y conocer distintas formas de clasificar las reacciones químicas a través de la realización de algunas reacciones químicas de interés para poder valorar la importancia que tienen las reacciones químicas y por tanto la necesidad de su estudio y conocimiento.
Cargado por
Sugey MolinaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
147 vistas14 páginasReacciones Químicas: Práctica I y II
REACCIONES QUÍMICAS I Y II: Definir qué es una reacción química y conocer distintas formas de clasificar las reacciones químicas a través de la realización de algunas reacciones químicas de interés para poder valorar la importancia que tienen las reacciones químicas y por tanto la necesidad de su estudio y conocimiento.
Cargado por
Sugey MolinaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd