0% encontró este documento útil (0 votos)
1K vistas14 páginasPRÁCTICA #4 Hidrocarburos Aromáticos
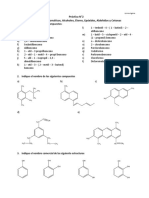
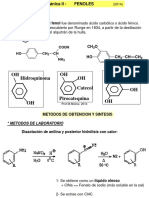
Este documento presenta los objetivos y procedimientos de una práctica de química orgánica sobre hidrocarburos aromáticos. Los estudiantes aprenderán sobre la obtención y propiedades del benceno, estructuras aromáticas como el fenol y tolueno, y usarán un editor molecular para crear moléculas como el 3-isopropil-2-vinilfenol y el 4alil-2-metilcumeno. Completarán tablas sobre compuestos aromáticos y sus usos industriales. El documento proporciona el
Cargado por
JoseLuis CardichDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
1K vistas14 páginasPRÁCTICA #4 Hidrocarburos Aromáticos
Este documento presenta los objetivos y procedimientos de una práctica de química orgánica sobre hidrocarburos aromáticos. Los estudiantes aprenderán sobre la obtención y propiedades del benceno, estructuras aromáticas como el fenol y tolueno, y usarán un editor molecular para crear moléculas como el 3-isopropil-2-vinilfenol y el 4alil-2-metilcumeno. Completarán tablas sobre compuestos aromáticos y sus usos industriales. El documento proporciona el
Cargado por
JoseLuis CardichDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd