Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe Determinacion de Antiacidos Comerciales
Cargado por
Moises PratoDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe Determinacion de Antiacidos Comerciales
Cargado por
Moises PratoCopyright:
Formatos disponibles
DETERMINACION DE ANTIACIDOS COMERCIALES.
AUTORES: PRATO MENDEZ, Moisés Adrián; TRIANA, Jorge Andrés Camilo.
RESUMEN
El día 6 de noviembre de 2020 se realizamos la práctica de laboratorio de
determinación de antiácidos comerciales, en esta práctica de laboratorio
aprendimos a verificar la eficiencia o eficacia de un antiácido comercial utilizando
para este procedimiento el HCl.
ABSTRARCT
On November 6, 2020 we carried out the laboratory practice for determining
commercial antacids, in this laboratory we learned to verify the efficiency or
effectiveness of a commercial antacid using HCl for this procedure.
PALABRAS CLAVE
1. Determinación.
2. Antiácidos.
3. Comerciales.
4. Titulaciones.
5. HCl.
KEYWORDS
1. Determination.
2. Antacids.
3. Commercial.
4. Qualifications.
5. HCl.
INTRODUCCION
Las Técnicas de titulación, presentan muchas aplicaciones, pero son
especialmente útiles en el análisis de sustancias ácidas y básicas. La titulación
implica la medición exacta del volumen de una solución de concentración conocida
que se requiere para reaccionar con un volumen medido de una solución de
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 1
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
concentración desconocida, o con una muestra pesada de un sólido desconocido.
La solución de concentración exactamente conocida se denomina solución patrón
o estándar. Normalmente para ser considerada como solución patrón, la
concentración del soluto en la solución debe conocerse con cuatro cifras
significativas. En muchos casos (especialmente solutos sólidos), es posible
preparar una solución estándar, pesando exactamente el soluto, seguido de una
dilución a un volumen exactamente conocido en un balón volumétrico
En los análisis por valoración debe existir algún medio que permita conocer
cuándo se ha añadido suficiente valorante para reaccionar exacta y totalmente con
la muestra que se está valorando. En una valoración acido-base, debe producirse
un cambio de pH, cuando la reacción es completa. Por ejemplo, si la muestra
valorada es un ácido, entonces el patrón valorante debe ser básico. Cuando se
añade una gota en exceso de solución valorante se hace básica repentinamente.
Existen varios colorantes naturales y sintéticos, denominados indicadores, que
presentan diversa formas coloreadas a diferentes valores de pH. Pude
seleccionarse un indicador adecuado que cambie de color a un valor de pH
consistente con el punto en que la reacción de valoración es completa. En esta
experiencia se utilizarán dos indicadores: la Fenoftaleína, y el azul de Bromofenol.
Las tabletas antiácidas están compuestas por sustancias débilmente básicas que
reaccionan con el ácido Clorhídrico presente en el estómago, neutralizándolo. Es
posible determinar la cantidad de ácido que puede neutralizar un medicamento
antiácido. El antiácido se disuelve en un exceso de HCl de concentración
conocida, y el exceso se valora con solución patrón de NaOH. No es posible
valorar directamente la tableta de antiácido porque contiene aglomerantes,
sustancias de relleno, sabores y colorantes que interfieren con la valoración, y
porque generalmente están constituidos por bases débiles, formando soluciones
amortiguadoras, lo que hace que no sea nítido el cambio del color en el punto final
En medicina, un antiácido es una sustancia, generalmente una base (medio
alcalino), que actúa en contra de la acidez estomacal (ácidos generados por
las glándulas parietales). En otras palabras, el antiácido alcaliniza
el estómago aumentando el pH. Los antiácidos más antiguos y conocidos son
el bicarbonato sódico (NaHCO3), el carbonato cálcico (CaCO3) y el hidróxido de
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 2
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
magnesio (Mg(OH)2) o de aluminio. Otros tipos de antiácidos son: las
sustancias cito protectoras, y los inhibidores de la bomba de protones.
Los antiácidos se han venido usando por siglos para el tratamiento de pacientes
con dispepsia y trastornos de acidez estomacal. Antes de la aparición de los
antagonistas de los receptores H2, eran el tratamiento de elección para estas
enfermedades.
Los antiácidos son bases débiles, por lo que desarrollan básicamente un
mecanismo de reacciones de neutralización al reaccionar con el ácido estomacal y
formar agua y una sal. Es decir, ellos hacen de tampón químico de los ácidos
gástricos que aumentan el valor del pH en el estómago (los jugos
gástricos poseen un valor de pH cercano a 0.8 que con la digestión de los
alimentos puede subir a cerca de 2), o lo que es lo mismo reducen la acidez en el
estómago. Cuando el ácido clorhídrico alcanza a los nervios de
la mucosa gastrointestinal, llega al sistema nervioso central un signo de dolor.
Esta sensación desagradable de dolor ocurre cuando los nervios están expuestos
a la agresión de los ácidos gástricos, llegando incluso a poder generar úlceras
pépticas. El ácido gástrico puede llegar a alcanzar igualmente el esófago (en cuyo
caso se presenta la pirosis o mal llamada acidez gástrica) o el
mismo duodeno (donde se producen también úlceras pépticas siendo más
frecuentes incluso que en el mismo estómago).
PARTE EXPERIMENTAL
MATERIALES, EQUIPOS E INSUMOS
Soporte para bureta
Pinza para bureta.
Bureta de 25 mL.
Erlenmeyer.
Vasos precipitado 100 mL y 250 mL.
Probeta de 100 mL.
Balanza analítica.
Embudo Vidrio.
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 3
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
Espátula.
.
REACTIVOS
HCl 0.1M.
NaOH 0.1M.
Tableta Antiácida.
Agua Destilada.
Azul de Bromofenol.
Fenoftaleína.
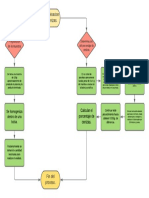
PROCEDIMIENTO
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 4
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
RESULTADOS Y ANALISIS DE DATOS
.
Se midió 1 gramo de antiácido.
Se diluyo el gramo de antiácido en 5mL de HCl.
Se añadió a la mezcla unas gotas de indicador y mezclarlo. En este caso el
indicador fue naranja de metilo.
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 5
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
Se procedió a agregar y mezclar la mezcla con HCl hasta que la mezcla se
Torne de un color amarillo.
CALCULOS
DATOS:
MHCl: 0.50M.
VHCl: 50ml: 0,050L.
MNaOH: 0.50M.
VNaOH: 22mL: 0,022L.
Masa de antiácido utilizada: 1 gramo.
Hallar la masa del HCl que neutralizo el antiácido.
Calcular el número de moles de HCl
( )( )
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 6
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
Calcular el número de moles de NaOH
( )( )
Numero de moles neutralizado por el antiácido
( )( )
PREGUNTAS
1. Escriba la fórmula molecular del Ftalato acido de potasio, utilizado para la
estandarización del NaOH. Calcule la masa molar.
Respuesta:
El Hidrogenoftalato de potasio o ftalato ácido de potasio (KHP), es una sal
con un hidrógeno ligeramente ácido, y se utiliza a menudo como patrón
primario en valoración ácido-base porque es sólido y estable al aire.
Formula: C8H5O4K KHP
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 7
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
Masa molar: 204.226 molar 68 gramos
2. Calcule la molaridad de una solución de NaOH, si se gastaron 34,65 mL de
la misma para estandarizarla, con 0,253 gramos de Ftalato ácido de
potasio, patrón primario, con Fenolftaleína como indicador.
Respuesta:
3. ¿Qué es una solución patrón acida o básica?
Respuesta:
Es una sustancia utilizada en química como referencia al momento de hacer una
valoración o estandarización, suelen ser solidos con las siguientes características:
Patrón primario
Un patrón primario también llamado estándar primario es una sustancia utilizada
en química como referencia al momento de hacer una valoración o
estandarización.
Usualmente son sólidos que cumplen con las siguientes características:
1. Tienen composición conocida. Es decir, se ha de conocer la estructura y
elementos que lo componen, lo cual servirá para hacer los cálculos
estequiométricos respectivos.
2. Deben tener elevada pureza. Para una correcta estandarización se debe utilizar
un patrón que tenga la mínima cantidad de impurezas que puedan interferir con la
titulación.
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 8
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
3. Debe ser estable a temperatura ambiente. No se pueden utilizar sustancias que
cambien su composición o estructura por efectos de temperaturas que difieran
ligeramente con la temperatura ambiente ya que ese hecho aumentaría el error en
las mediciones.
4. Debe ser posible su secado en estufa. Además de los cambios a temperatura
ambiente, también debe soportar temperaturas mayores para que sea posible su
secado. Normalmente debe ser estable a temperaturas mayores que la del punto
de ebullición del agua.
5. No debe absorber gases. Ya que este hecho generaría posibles errores por
interferentes así como también degeneración del patrón.
6. Debe reaccionar rápida y estequiométricamente con el titulante. De esta manera
se puede visualizar con mayor exactitud el punto final de las titulaciones por
volumetría y entonces se puede realizar los cálculos respectivos también de
manera más exacta y con menor incertidumbre.
7. Debe tener un peso equivalente grande. Ya que este hecho reduce
considerablemente el error de la pesada del patrón.
4. Los ingredientes más comunes de las tabletas antiácidas son CaCO3,
NaHCO3, Mg(OH)2, Al(OH)3. Calcule el volumen en mililitros requeridos de
solución 0,100M de solución de HCl, que neutralizan 1,00 gramos de cada
una de estas sustancias.
Respuesta:
CaCO3
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 9
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
NaHCO3
Mg(OH)2
Al(OH)3
CONCLUSIONES
Para la realización de esta práctica de laboratorio se tomó como guía
el video presentado por el docente durante la clase en línea.
La cantidad de HCl que se necesitó para que la muestra se tornara
de un color amarillo fue de 22mL.
La masa de HCl que se necesitó para neutralizar el antiácido fue de
.
REFERENCIAS BIBLIOGRAFICAS
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 10
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
https://www.youtube.com/watch?v=IghTQyqQ9cs&ab_channel=Mu%C3%B
1ozTutoriales.
https://es.wikipedia.org/wiki/Anti%C3%A1cido
Guía practica 5 Determinación de Antiácidos Comerciales (Suministrada por
el docente).
“Formando líderes para la construcción de un nuevo país en paz”
Universidad de Pamplona
Pamplona - Norte de Santander - Colombia 11
Tels: (7) 5685303 - 5685304 - 5685305 - Fax: 5682750
SC-CER96940 www.unipamplona.edu.co
También podría gustarte
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Evaluación de Antiácidos ComercialesDocumento3 páginasEvaluación de Antiácidos ComercialesKaterin Díaz OrtizAún no hay calificaciones
- Informe AntiacidoDocumento6 páginasInforme Antiacidojesid povedaAún no hay calificaciones
- Curvas de Titulación y Fases de Una CurvaDocumento8 páginasCurvas de Titulación y Fases de Una CurvaGeorge Robles MoralesAún no hay calificaciones
- EvaluacionDocumento3 páginasEvaluacionAdrian David Bermudez EstupiñanAún no hay calificaciones
- Síntesis de FenolftaleínaDocumento6 páginasSíntesis de FenolftaleínaESMERALDA PALACIO HERNANDEZAún no hay calificaciones
- Fundamentos Basicos de ArgentometriaDocumento3 páginasFundamentos Basicos de ArgentometriaLeslie WayneAún no hay calificaciones
- Informe #6. Titulacion - PotenciometriaDocumento10 páginasInforme #6. Titulacion - PotenciometriaIcarusAún no hay calificaciones
- Volumetria Redox - InformeDocumento7 páginasVolumetria Redox - InformeMilagros Trujillo Mucha50% (2)
- UreaDocumento2 páginasUreaMedalyt Huashuayo CusiAún no hay calificaciones
- Valoracion de Sulfato Ferroso. Quimica NaliticaDocumento17 páginasValoracion de Sulfato Ferroso. Quimica NaliticaAntony Vega Salazar100% (8)
- Determinación de Cloruro - Vol. PrecipitaciónDocumento10 páginasDeterminación de Cloruro - Vol. PrecipitaciónAngie CampoverdeAún no hay calificaciones
- Valoracion de AspirinaDocumento6 páginasValoracion de AspirinaJosé MariaAún no hay calificaciones
- Redox Volumetria InformeDocumento12 páginasRedox Volumetria InformeAndrea HernandezAún no hay calificaciones
- Informe No 7 - Identificacion de Los LipidosDocumento9 páginasInforme No 7 - Identificacion de Los LipidosJose Daniel LopezAún no hay calificaciones
- Informe SOLUCIONES REGULADORASDocumento9 páginasInforme SOLUCIONES REGULADORASRoberto Andres Delgado MillanAún no hay calificaciones
- Volhard OriginalDocumento5 páginasVolhard OriginalAlejandra CorsiAún no hay calificaciones
- Practica #7 PH Soluciones Amortiguadoras Análisis FarmacéuticoDocumento3 páginasPractica #7 PH Soluciones Amortiguadoras Análisis Farmacéuticojuan layque layasaAún no hay calificaciones
- Anhidrovolumetría Trabajo 2Documento13 páginasAnhidrovolumetría Trabajo 2Jeff C Poessy67% (3)
- Informe de AntiacidosDocumento4 páginasInforme de AntiacidosYofre Gil0% (2)
- ComplexometriaDocumento6 páginasComplexometriaDavid Herrera100% (1)
- Curvas de Titulacion PrecipitacionDocumento20 páginasCurvas de Titulacion PrecipitacionKarlos RamirezAún no hay calificaciones
- INFORME 3 Ibuprofeno-1Documento19 páginasINFORME 3 Ibuprofeno-1KEYLA VANESSA MORALES RODRIGUEZ ESTUDIANTEAún no hay calificaciones
- Informe de Albumina de HuevoDocumento4 páginasInforme de Albumina de HuevoGerman Andres CorralAún no hay calificaciones
- Informe 9 PiruvatoDocumento4 páginasInforme 9 PiruvatoalexanderAún no hay calificaciones
- Informe Estandarizacion de SolucionesDocumento7 páginasInforme Estandarizacion de Solucionesluis jose rodriguez cantilloAún no hay calificaciones
- Punto de EquilibrioDocumento3 páginasPunto de EquilibrioCabarcas StèfannyAún no hay calificaciones
- ACIDIMETRIADocumento6 páginasACIDIMETRIAJefry Jose González LopezAún no hay calificaciones
- Evaluacion de Antiacidos Comerciales InformeDocumento5 páginasEvaluacion de Antiacidos Comerciales InformeAlberth MuñozAún no hay calificaciones
- Valoración de Agua OxigenadaDocumento2 páginasValoración de Agua OxigenadaJesús Oyarce100% (1)
- Informe 5 Argentometría Parte IDocumento9 páginasInforme 5 Argentometría Parte IJesxy PxrdoAún no hay calificaciones
- Laboratorio Titulacion Acido Base (1) InformeDocumento15 páginasLaboratorio Titulacion Acido Base (1) InformeMelySaGalindresGarcia0% (1)
- DiscusiónDocumento2 páginasDiscusiónerickAún no hay calificaciones
- Valoracion Poteniometrica Con Acido FosforicoDocumento18 páginasValoracion Poteniometrica Con Acido FosforicoCinthya Knowles Gonzalez Rios100% (1)
- Práctica 5. Preparación de La Sal de MohrDocumento3 páginasPráctica 5. Preparación de La Sal de MohrDaniel Santos GarciaAún no hay calificaciones
- Evaluación Del Porcentaje de Ácidez de Vinagre ComercialDocumento2 páginasEvaluación Del Porcentaje de Ácidez de Vinagre ComercialYeferson Orlando Vera MantillaAún no hay calificaciones
- Informe Porcentaje de Acidez de Vinagre ComercialDocumento4 páginasInforme Porcentaje de Acidez de Vinagre ComercialDayana Botello60% (5)
- Permanganometria - Determinación de HierroDocumento3 páginasPermanganometria - Determinación de HierroFrancisco Vidal VivancoAún no hay calificaciones
- Informe 3 ANALITICADocumento10 páginasInforme 3 ANALITICAWalter Salazar SandiAún no hay calificaciones
- Práctica Preparación de Solución y Titulación Ácido-BaseDocumento5 páginasPráctica Preparación de Solución y Titulación Ácido-BaseAnaiisa Vizcarra50% (2)
- Informe Titulacion (TITULACION-ÁCIDO-BASE, MEDIDA DE PH)Documento6 páginasInforme Titulacion (TITULACION-ÁCIDO-BASE, MEDIDA DE PH)Juan Pablo Arias40% (5)
- Informe Metodo DumasDocumento8 páginasInforme Metodo Dumasestefania_ramos_4100% (2)
- Informe #9 Determinación Permanganimetrica.Documento5 páginasInforme #9 Determinación Permanganimetrica.richard dominguezAún no hay calificaciones
- Informe 5 Soluciones AmortiguadorasDocumento9 páginasInforme 5 Soluciones AmortiguadorasDeicy OrdoñezAún no hay calificaciones
- Calibración Quimica Analitica InstrumentalDocumento15 páginasCalibración Quimica Analitica Instrumentalangus a.Aún no hay calificaciones
- Cuadro Sinóptico de La Química AnalíticaDocumento1 páginaCuadro Sinóptico de La Química AnalíticaLarissaOliveraAún no hay calificaciones
- Práctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote TDocumento5 páginasPráctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote Ttania pinargoteAún no hay calificaciones
- ACIDIMETRÍADocumento4 páginasACIDIMETRÍAkarol321100% (1)
- Informe 5 Determinación de UREADocumento4 páginasInforme 5 Determinación de UREAAndres Padilla100% (1)
- Volumetría Con Formación de ComplejosDocumento5 páginasVolumetría Con Formación de ComplejosAndresFelipeChinguadObandoAún no hay calificaciones
- Determinacion de Acido Lactico en La CervezaDocumento4 páginasDeterminacion de Acido Lactico en La CervezaOscar Cardona PantojaAún no hay calificaciones
- Determinacion de Alcoholes y FenolesDocumento5 páginasDeterminacion de Alcoholes y Fenolessara peresAún no hay calificaciones
- Informe Suero FisiológicoDocumento7 páginasInforme Suero FisiológicojuanAún no hay calificaciones
- Acidimetria y Alcalimetria FinDocumento10 páginasAcidimetria y Alcalimetria FinVane Vanesita100% (2)
- Evaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDocumento3 páginasEvaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDayana BotelloAún no hay calificaciones
- Informe Preparacoin y Estandarizacion de SolucionesDocumento6 páginasInforme Preparacoin y Estandarizacion de SolucionesMoises PratoAún no hay calificaciones
- Pre Informe de Soluciones y Titulacion PDFDocumento15 páginasPre Informe de Soluciones y Titulacion PDFsantiagoAún no hay calificaciones
- Acido BaseDocumento5 páginasAcido BaseOmar Alfonso GaravitoAún no hay calificaciones
- Práctica 6b EMFDocumento8 páginasPráctica 6b EMFNain RodriguezAún no hay calificaciones
- Informe 4 - Curva de Neutralización o Curva de Titulación Acido-Base PDFDocumento8 páginasInforme 4 - Curva de Neutralización o Curva de Titulación Acido-Base PDFRenzo TrujilloAún no hay calificaciones
- Video Problemas Socio-Ambientales Que Causan Mayor Sensibilidad en El Siglo XxiDocumento3 páginasVideo Problemas Socio-Ambientales Que Causan Mayor Sensibilidad en El Siglo XxiMoises PratoAún no hay calificaciones
- Informe Volumetria de Precipitacion PDFDocumento7 páginasInforme Volumetria de Precipitacion PDFMoises PratoAún no hay calificaciones
- Informe Curva de Valoracion Acido Debil-Base Fuerte PDFDocumento18 páginasInforme Curva de Valoracion Acido Debil-Base Fuerte PDFMoises Prato0% (1)
- Informe Curva de Valoracion Acido Debil-Base Fuerte PDFDocumento18 páginasInforme Curva de Valoracion Acido Debil-Base Fuerte PDFMoises PratoAún no hay calificaciones
- Exposicion Elementos NativosDocumento24 páginasExposicion Elementos NativosMoises PratoAún no hay calificaciones
- Primera Proclamación Ecológica Del Mundo.Documento2 páginasPrimera Proclamación Ecológica Del Mundo.Moises PratoAún no hay calificaciones
- Resumen de LaboratoriosDocumento14 páginasResumen de LaboratoriosMoises PratoAún no hay calificaciones
- Taller Curvas de Valoración Acido-BaseDocumento43 páginasTaller Curvas de Valoración Acido-BaseMoises PratoAún no hay calificaciones
- Preinforme Cenizas.Documento1 páginaPreinforme Cenizas.Moises PratoAún no hay calificaciones
- Preinforme GavinometriaDocumento1 páginaPreinforme GavinometriaMoises PratoAún no hay calificaciones
- Preinforme Equilibrio QuimicoDocumento1 páginaPreinforme Equilibrio QuimicoMoises PratoAún no hay calificaciones
- Preinforme Equilibrio QuimicoDocumento1 páginaPreinforme Equilibrio QuimicoMoises PratoAún no hay calificaciones
- PRÁCTICA Determinación de AcidezDocumento3 páginasPRÁCTICA Determinación de AcidezMoises PratoAún no hay calificaciones
- PRÁCTICA Determinación de AcidezDocumento3 páginasPRÁCTICA Determinación de AcidezMoises PratoAún no hay calificaciones
- Preinforme Cenizas.Documento1 páginaPreinforme Cenizas.Moises PratoAún no hay calificaciones
- Preinforme GavinometriaDocumento1 páginaPreinforme GavinometriaMoises PratoAún no hay calificaciones
- Informe Calibracion de Material VolumetricoDocumento4 páginasInforme Calibracion de Material VolumetricoMoises PratoAún no hay calificaciones
- Informe 2 - CALIBRACIÓN DE LA BALANZA ANALÍTICADocumento5 páginasInforme 2 - CALIBRACIÓN DE LA BALANZA ANALÍTICAMoises PratoAún no hay calificaciones
- Informe de Normas de SeguridadDocumento5 páginasInforme de Normas de SeguridadMoises PratoAún no hay calificaciones
- Informe Preparacoin y Estandarizacion de SolucionesDocumento6 páginasInforme Preparacoin y Estandarizacion de SolucionesMoises PratoAún no hay calificaciones
- Informe Aldehidos y CetonasDocumento6 páginasInforme Aldehidos y CetonasMoises PratoAún no hay calificaciones
- Examen Final ADocumento2 páginasExamen Final ARICHARD MARTIN PEREYRA SIFUENTESAún no hay calificaciones
- Silabo - Dibujo en Ingenieria - 2020 BDocumento5 páginasSilabo - Dibujo en Ingenieria - 2020 BDiego Gutierrez RamosAún no hay calificaciones
- ANALISIS DE TERRENO - Pub 3Documento56 páginasANALISIS DE TERRENO - Pub 3Sara MarinAún no hay calificaciones
- Unsch: Capitulo 5 Mínimos Cuadrados RestringidosDocumento8 páginasUnsch: Capitulo 5 Mínimos Cuadrados RestringidosJUAN ALBERTO HUARIPUMA VARGASAún no hay calificaciones
- Generaciones de Las ComputadorasDocumento6 páginasGeneraciones de Las ComputadorasRicardo LlanoAún no hay calificaciones
- Trabajo 1 de Antenas FinalizadoDocumento22 páginasTrabajo 1 de Antenas FinalizadoBrayan TGAún no hay calificaciones
- Manual de Laboratorio CCNA2Documento297 páginasManual de Laboratorio CCNA2Junior Sumosa100% (14)
- TA5 - Expresiones Algebraicas FCMFAUTO5Documento10 páginasTA5 - Expresiones Algebraicas FCMFAUTO5MarianaAún no hay calificaciones
- Cap III Metodo de Rigidez en ArmadurasDocumento16 páginasCap III Metodo de Rigidez en ArmadurasKarol Sotomayor Gonzales100% (1)
- Operaciones Agroindustriales IIDocumento9 páginasOperaciones Agroindustriales IIKarlos Alayo BardalesAún no hay calificaciones
- Melucci La Acción Colectiva Como Construcción SocialDocumento8 páginasMelucci La Acción Colectiva Como Construcción SocialNahuelAún no hay calificaciones
- Sistema Codificacion AutomatizadaDocumento29 páginasSistema Codificacion AutomatizadaMelany Conocuica VeraAún no hay calificaciones
- Manual Laboratorio de Química InorgánicaDocumento51 páginasManual Laboratorio de Química InorgánicaDiana Carolina Uribe100% (2)
- Muro de Contencion C°a°Documento18 páginasMuro de Contencion C°a°David Ricardo Vega RojasAún no hay calificaciones
- Clasificación de Los CompresoresDocumento10 páginasClasificación de Los CompresoresWiñay RecordsAún no hay calificaciones
- S06 S1-EjerciciosDocumento6 páginasS06 S1-EjerciciosYadhira AparicioAún no hay calificaciones
- Cereal Es 2016Documento96 páginasCereal Es 2016maferAún no hay calificaciones
- Capa Límite, Viento, AOA, Ángulo de Incidencia, PerfilDocumento99 páginasCapa Límite, Viento, AOA, Ángulo de Incidencia, PerfilJose TejedaAún no hay calificaciones
- Conferencia 7Documento21 páginasConferencia 7Victor PopsiAún no hay calificaciones
- Capilaridad de Los SuelosDocumento18 páginasCapilaridad de Los SuelosDimas Edyn Gamboa HuaroccAún no hay calificaciones
- Blanco-Peck, Richard - Los Enfoques Metodológicos y La Administración Pública ModernaDocumento10 páginasBlanco-Peck, Richard - Los Enfoques Metodológicos y La Administración Pública ModernaL Felipe AlarcónAún no hay calificaciones
- Energia Potencial y CineticaDocumento4 páginasEnergia Potencial y CineticaMarcela Aguirre Vargas100% (1)
- Características Fotografía EstenopeicaDocumento5 páginasCaracterísticas Fotografía EstenopeicaDouglas Segovia P.Aún no hay calificaciones
- 7ma Semana - Clasificación PDFDocumento22 páginas7ma Semana - Clasificación PDFAriel GonzálezAún no hay calificaciones
- Cartel de Alcance y Secuencias PrimariaDocumento2 páginasCartel de Alcance y Secuencias PrimariaCepaluc CepalucAún no hay calificaciones
- Regresion Lineal MartinezDocumento6 páginasRegresion Lineal MartinezEdgar Fernando Martinez SanchezAún no hay calificaciones
- Reporte Modular 5Documento42 páginasReporte Modular 5Josue LariosAún no hay calificaciones
- Trigonometría - Sem 9Documento3 páginasTrigonometría - Sem 9DGRock91Aún no hay calificaciones
- 6ADocumento4 páginas6ARubius MacrausAún no hay calificaciones
- MatematicasDocumento14 páginasMatematicasLiliana Lagos100% (1)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Resetea tu mente. Descubre de lo que eres capazDe EverandResetea tu mente. Descubre de lo que eres capazCalificación: 5 de 5 estrellas5/5 (196)
- ¿Por qué mis padres no me aman?: Empezando a sanarDe Everand¿Por qué mis padres no me aman?: Empezando a sanarCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Tus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadDe EverandTus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadCalificación: 4.5 de 5 estrellas4.5/5 (1830)
- Psicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaDe EverandPsicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaCalificación: 4.5 de 5 estrellas4.5/5 (766)
- Recupera tu mente, reconquista tu vidaDe EverandRecupera tu mente, reconquista tu vidaCalificación: 5 de 5 estrellas5/5 (6)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaDe EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaCalificación: 5 de 5 estrellas5/5 (1870)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Yo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)De EverandYo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)Calificación: 5 de 5 estrellas5/5 (7)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRADe EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRACalificación: 4 de 5 estrellas4/5 (26)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaDe EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaCalificación: 5 de 5 estrellas5/5 (2)
- Influencia. La psicología de la persuasiónDe EverandInfluencia. La psicología de la persuasiónCalificación: 4.5 de 5 estrellas4.5/5 (14)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Terapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSDe EverandTerapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSCalificación: 5 de 5 estrellas5/5 (1)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Teoría polivagal práctica y terapiaDe EverandTeoría polivagal práctica y terapiaCalificación: 5 de 5 estrellas5/5 (4)
- Una mente en calma: Técnicas para manejar los pensamientos intrusivosDe EverandUna mente en calma: Técnicas para manejar los pensamientos intrusivosCalificación: 4.5 de 5 estrellas4.5/5 (142)
- Técnicas de resolución de problemas: En la vida diaria y profesionalDe EverandTécnicas de resolución de problemas: En la vida diaria y profesionalCalificación: 5 de 5 estrellas5/5 (1)
- Cómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaDe EverandCómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaCalificación: 4.5 de 5 estrellas4.5/5 (6)
- El poder del optimismo: Herramientas para vivir de forma más positivaDe EverandEl poder del optimismo: Herramientas para vivir de forma más positivaCalificación: 5 de 5 estrellas5/5 (16)
- Lee a las personas como un libro: Cómo analizar, entender y predecir las emociones, los pensamientos, las intenciones y los comportamientos de las personasDe EverandLee a las personas como un libro: Cómo analizar, entender y predecir las emociones, los pensamientos, las intenciones y los comportamientos de las personasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Suicidología: Prevención, tratamiento psicológico e investigación de procesos suicidasDe EverandSuicidología: Prevención, tratamiento psicológico e investigación de procesos suicidasCalificación: 5 de 5 estrellas5/5 (7)