0% encontró este documento útil (1 voto)
854 vistas3 páginasAnálisis de Concentraciones Químicas
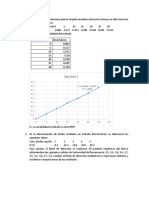
1. Se utilizó el método de adición patrón para determinar la concentración de Ca2+ en una solución problema. La concentración medida fue de 10.4167 mg/L.
2. Se utilizó el método de adición patrón para determinar la concentración de Litio en una muestra, obteniendo una concentración de 1.82 μg/mL después de aplicar un factor de dilución.
3. Se realizó una volumetría complexométrica de Pd(II) con un agente quelante. La concentración molar de
Cargado por
Andrea del AguilaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (1 voto)
854 vistas3 páginasAnálisis de Concentraciones Químicas
1. Se utilizó el método de adición patrón para determinar la concentración de Ca2+ en una solución problema. La concentración medida fue de 10.4167 mg/L.
2. Se utilizó el método de adición patrón para determinar la concentración de Litio en una muestra, obteniendo una concentración de 1.82 μg/mL después de aplicar un factor de dilución.
3. Se realizó una volumetría complexométrica de Pd(II) con un agente quelante. La concentración molar de
Cargado por
Andrea del AguilaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd