0% encontró este documento útil (0 votos)
306 vistas28 páginasDiagramas de Fases y Aleaciones
1. El documento presenta información sobre diagramas de fases y aleaciones. Define aleación como una mezcla de dos o más elementos metálicos y menciona algunas aleaciones comunes como el acero, bronce y latón.
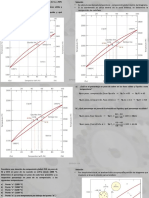
2. Explica conceptos clave como fases, regla de fases de Gibbs, solución, solubilidad y métodos experimentales para construir diagramas de fases.
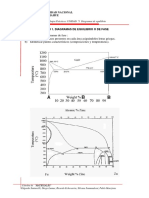
3. Señala que los diagramas de fases muestran las reacciones que ocurren cuando se mezclan elementos y cómo varían según la temperatura y composición
Cargado por
abrahamDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
306 vistas28 páginasDiagramas de Fases y Aleaciones
1. El documento presenta información sobre diagramas de fases y aleaciones. Define aleación como una mezcla de dos o más elementos metálicos y menciona algunas aleaciones comunes como el acero, bronce y latón.
2. Explica conceptos clave como fases, regla de fases de Gibbs, solución, solubilidad y métodos experimentales para construir diagramas de fases.
3. Señala que los diagramas de fases muestran las reacciones que ocurren cuando se mezclan elementos y cómo varían según la temperatura y composición
Cargado por
abrahamDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd