Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica Calificada
Practica Calificada
Cargado por
Jhonn Kenedy Vilcanqui Huarahuara0 calificaciones0% encontró este documento útil (0 votos)
13 vistas3 páginasEl documento presenta 4 preguntas de un examen escrito de análisis químico instrumental. La primera pregunta trata sobre una diapositiva. La segunda pregunta calcula la molaridad de una solución de ácido fosfórico. La tercera pregunta calcula la cantidad de agua evaporada y los porcentajes de soluto y solvente en una solución de sulfato de cobre. La cuarta pregunta determina la concentración de cobre en una muestra desconocida usando una curva de calibración de absorción atómica.
Descripción original:
Título original
practica calificada
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento presenta 4 preguntas de un examen escrito de análisis químico instrumental. La primera pregunta trata sobre una diapositiva. La segunda pregunta calcula la molaridad de una solución de ácido fosfórico. La tercera pregunta calcula la cantidad de agua evaporada y los porcentajes de soluto y solvente en una solución de sulfato de cobre. La cuarta pregunta determina la concentración de cobre en una muestra desconocida usando una curva de calibración de absorción atómica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
13 vistas3 páginasPractica Calificada
Practica Calificada
Cargado por
Jhonn Kenedy Vilcanqui HuarahuaraEl documento presenta 4 preguntas de un examen escrito de análisis químico instrumental. La primera pregunta trata sobre una diapositiva. La segunda pregunta calcula la molaridad de una solución de ácido fosfórico. La tercera pregunta calcula la cantidad de agua evaporada y los porcentajes de soluto y solvente en una solución de sulfato de cobre. La cuarta pregunta determina la concentración de cobre en una muestra desconocida usando una curva de calibración de absorción atómica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
EXAMEN ESCRITO CURSO ANÁLISIS QUÍMICO INSTRUMENTAL
1. Pregunta de las diapositivas de la Unidad I (oral)
2. Se tiene una solución de H3PO4 al 24.5% en masa, cuya densidad de solución es
1.2g/ml calcule la molaridad de solución.
MA (P)=31 MA (O)=16
3. Cuando se evapora 325g de una solución sulfato de cobre CuSO4, se obtiene un
residuo de 25g de sulfato.
a) Cuantos gramos de agua se evaporaron?
b) Cuál es el % de soluto por peso en la solución?
c) Cuál es el % de solvente?
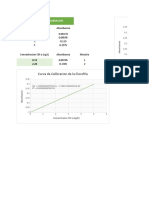
4. Para llevar acabo la determinación de cobre en agua por el método de absorción
atómica, se obtiene los patrones se dan a continuación.
MEDI mgCu ABSORBANC
DA /L IA
1 0 0
2 5 0.093
3 10 0.178
4 15 0.261
5 20 0.339
6 25 0.414
La muestra desconocida se trata en igualdad de condiciones que los patrones
(HNO3 0.5M) se aspira en la llama y se registra por triplicado la absorbancia,
realizando el proceso 5 veces.
N° DE ABSORBANC
MEDIDA IA
1 0.237
2 0.238
3 0.238
4 0.244
5 0.246
Calcular la concentración de la muestra del problema
Solución de la numero 04
También podría gustarte
- Reporte No 2. Biofarmacia. Determinacion de Log D de Una DrogaDocumento11 páginasReporte No 2. Biofarmacia. Determinacion de Log D de Una DrogaErik EstradaAún no hay calificaciones
- Ejercicios Resueltos Espectrofotometría 2017Documento5 páginasEjercicios Resueltos Espectrofotometría 2017Diana Dominguez AquinoAún no hay calificaciones
- Reduccion Del Ion PermanganatoDocumento7 páginasReduccion Del Ion PermanganatoMafe AlbarracinAún no hay calificaciones
- EJERCICIOS 7. ESPECTROFOTOMETRÍA UV-VIS-PARTE 2 Respuestas PDFDocumento3 páginasEJERCICIOS 7. ESPECTROFOTOMETRÍA UV-VIS-PARTE 2 Respuestas PDFEmanuel Pataquiva0% (1)
- Informe MezclaDocumento22 páginasInforme MezclaPaola DoğranmışAún no hay calificaciones
- RESULTADOS TalioDocumento3 páginasRESULTADOS TaliodeliaAún no hay calificaciones
- Informe ESPECTROFOTOMETRIADocumento6 páginasInforme ESPECTROFOTOMETRIAPaula Rincon TorresAún no hay calificaciones
- Examen Final Analitica Grupo IDocumento3 páginasExamen Final Analitica Grupo IGiselaAún no hay calificaciones
- PRÁCTICA 14 ColorimetríaDocumento6 páginasPRÁCTICA 14 ColorimetríaPablo SensoAún no hay calificaciones
- Colorimetria PDFDocumento5 páginasColorimetria PDFH. Ivan GarciaAún no hay calificaciones
- Resultados 1. Refractometria de Alcohol Con VarianzasDocumento5 páginasResultados 1. Refractometria de Alcohol Con VarianzasNatis PazAún no hay calificaciones
- Tarea 1.2Documento2 páginasTarea 1.2Lau AlvaAún no hay calificaciones
- Informe de HidroxiapatitaDocumento8 páginasInforme de HidroxiapatitaEsteban MalamboAún no hay calificaciones
- Valoracion Muestras VariasDocumento3 páginasValoracion Muestras VariasEsther RamosAún no hay calificaciones
- Absorcion Atomica. Hierro en Multivitaminico.Documento11 páginasAbsorcion Atomica. Hierro en Multivitaminico.Verónica MartínezAún no hay calificaciones
- AAS Ejercicios S1 2021Documento7 páginasAAS Ejercicios S1 2021Tatiana RodríguezAún no hay calificaciones
- Informe 5 BioquimicaDocumento9 páginasInforme 5 BioquimicaJorge100% (1)
- Guía Sulfatos Por Turbidimetría y EspectrofotometríaDocumento3 páginasGuía Sulfatos Por Turbidimetría y EspectrofotometríaJuan PerezAún no hay calificaciones
- Problemario de Flamometría y Absorción Atómica 2018 PDFDocumento2 páginasProblemario de Flamometría y Absorción Atómica 2018 PDFAngel BeltranAún no hay calificaciones
- Práctica N°02Documento5 páginasPráctica N°02Gacely RodriguezAún no hay calificaciones
- INFORME COLORANTES Semestre 2020Documento5 páginasINFORME COLORANTES Semestre 2020HERNANDO ESTEBAN ROLDÁN ESCUDEROAún no hay calificaciones
- 1014Documento3 páginas1014Jhoan RiveraAún no hay calificaciones
- Practica No. 8 Lab 2Documento14 páginasPractica No. 8 Lab 2Vidaña DuronAún no hay calificaciones
- P5 Cinetica Equipo 3Documento8 páginasP5 Cinetica Equipo 3Martínez Arias KarenAún no hay calificaciones
- Cinetica Enzimatica de La InvertasaDocumento8 páginasCinetica Enzimatica de La InvertasaKaláshnikov MalkavianAún no hay calificaciones
- Practica #4Documento6 páginasPractica #4JúpiterAún no hay calificaciones
- Ejercicio-Absorciòn AtomicaDocumento3 páginasEjercicio-Absorciòn AtomicaStefhanny Odar Nieto0% (1)
- Reporte MALowryDocumento15 páginasReporte MALowryValle Zamorano Elaine NicoleAún no hay calificaciones
- PRACTICA 4. DETERMINACION DE CR Con DifenilcarbazidaDocumento16 páginasPRACTICA 4. DETERMINACION DE CR Con DifenilcarbazidaLaura PerdomoAún no hay calificaciones
- Examen de InstrumentalDocumento3 páginasExamen de InstrumentalJhordan NietoAún no hay calificaciones
- Curvas de CalibracionDocumento15 páginasCurvas de CalibracionBrayan Armenta ValenzuelaAún no hay calificaciones
- Curva de CalibracionDocumento2 páginasCurva de CalibracionLinita UrbinaAún no hay calificaciones
- Informe de Laboratorio de Análisis Instrumental I Escuela de QuímicaDocumento8 páginasInforme de Laboratorio de Análisis Instrumental I Escuela de QuímicajuanAún no hay calificaciones
- Ejercicios Parte 2Documento7 páginasEjercicios Parte 2Horiana TrujilloAún no hay calificaciones
- Refracto Me TriaDocumento2 páginasRefracto Me TrialeidyAún no hay calificaciones
- Clase #4 - EespectrofotometriaDocumento38 páginasClase #4 - EespectrofotometriaG Muñoz XiangAún no hay calificaciones
- Problemas de Clase 5 y 6Documento7 páginasProblemas de Clase 5 y 6Eduardo MaldonadoAún no hay calificaciones
- Informe #6 BioquiDocumento9 páginasInforme #6 BioquiJulio Cesar SamaniegoAún no hay calificaciones
- Laboratorio N°07 Físicoquímica Tratamiento de DatosDocumento21 páginasLaboratorio N°07 Físicoquímica Tratamiento de DatosPatrick Quiroz MorenoAún no hay calificaciones
- Guia de Problemas de Introduccion Al Analisis de Datos de Velocidad-1Documento22 páginasGuia de Problemas de Introduccion Al Analisis de Datos de Velocidad-1rodry zuritaAún no hay calificaciones
- Ev02 - Aas Analisis InstrumentalDocumento4 páginasEv02 - Aas Analisis InstrumentalRubi RGAún no hay calificaciones
- UntitledDocumento5 páginasUntitledÄrlëy BäütïstäAún no hay calificaciones
- 10mo PRÁCTICA ANALISIS QUIMICODocumento6 páginas10mo PRÁCTICA ANALISIS QUIMICOCintbya Ccencho GaribayAún no hay calificaciones
- TP 2 AnalíticaDocumento5 páginasTP 2 AnalíticaFranz ZAún no hay calificaciones
- ESPECTRO DE ABSORCIÓN - DETERMINACIÓN DE λ ÓPTIMODocumento10 páginasESPECTRO DE ABSORCIÓN - DETERMINACIÓN DE λ ÓPTIMOSilvana Delgado VergarayAún no hay calificaciones
- Cálculos y Resultados ZINC Y COBREDocumento2 páginasCálculos y Resultados ZINC Y COBRESebastian ViverosAún no hay calificaciones
- Analisis Problemas EliseoDocumento12 páginasAnalisis Problemas EliseoLimon C. UrielAún no hay calificaciones
- Analítica Informe 1Documento4 páginasAnalítica Informe 1Camilo OrtizAún no hay calificaciones
- Pract 3 AaaDocumento8 páginasPract 3 AaaDavid GarciaAún no hay calificaciones
- Informe 1Documento12 páginasInforme 1ZENAIDA ALEXANDRA CCAMA CCAHUANAAún no hay calificaciones
- Practica 7 Conocimiento de Técnicas AnalíticasDocumento7 páginasPractica 7 Conocimiento de Técnicas AnalíticastotomaryAún no hay calificaciones
- Laboratorio Semana 1Documento12 páginasLaboratorio Semana 1nickii nickiiAún no hay calificaciones
- Fosforo en SueloDocumento43 páginasFosforo en Suelometales bureauAún no hay calificaciones
- Informes 2Documento7 páginasInformes 2Mariuxi Rocío Fajardo GuamanAún no hay calificaciones
- Hierro DiegoDocumento10 páginasHierro Diegoharold diazAún no hay calificaciones
- Reporte MetodosDocumento7 páginasReporte MetodosDarinka RomoAún no hay calificaciones
- Practica de Laboratorio Lambert BeerDocumento5 páginasPractica de Laboratorio Lambert Beerlaura QuinteroAún no hay calificaciones
- Practica 8 AdsorcionDocumento5 páginasPractica 8 AdsorcionJocee SqadeliiqAún no hay calificaciones
- Fundamentos de econometría intermedia: Teoría y aplicacionesDe EverandFundamentos de econometría intermedia: Teoría y aplicacionesAún no hay calificaciones