100% encontró este documento útil (2 votos)
346 vistas10 páginasDifusividad en Tubo de Stefan
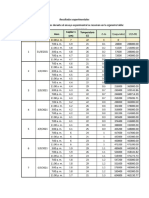
Este documento describe una práctica de laboratorio sobre la difusión de sustancias en el aire. Los objetivos son determinar el coeficiente de difusividad de una sustancia en el aire y compararlo con valores reportados. Se explican conceptos como la ley de Fick y el tubo de Stefan, que se usa para medir coeficientes de difusión. Los estudiantes realizan una simulación de la difusión de etanol en aire usando un tubo de Stefan de 15 cm a 25°C, midiendo el descenso del nivel del líquido en función
Cargado por
Angie Antonella Vidal HuamánDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (2 votos)
346 vistas10 páginasDifusividad en Tubo de Stefan
Este documento describe una práctica de laboratorio sobre la difusión de sustancias en el aire. Los objetivos son determinar el coeficiente de difusividad de una sustancia en el aire y compararlo con valores reportados. Se explican conceptos como la ley de Fick y el tubo de Stefan, que se usa para medir coeficientes de difusión. Los estudiantes realizan una simulación de la difusión de etanol en aire usando un tubo de Stefan de 15 cm a 25°C, midiendo el descenso del nivel del líquido en función
Cargado por
Angie Antonella Vidal HuamánDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd