Documentos de Académico
Documentos de Profesional
Documentos de Cultura
La Energía Interna
Cargado por
Juan MolinaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
La Energía Interna
Cargado por
Juan MolinaCopyright:
Formatos disponibles
La energía interna U del sistema depende únicamente del estado del sistema, en
un gas ideal depende solamente de su temperatura. Mientras que la transferencia
de calor o el trabajo mecánico dependen del tipo de transformación o camino
seguido para ir del estado inicial al final.
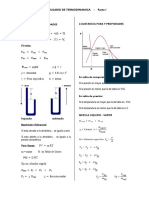
Isócora o a volumen constante
No hay variación de volumen del gas, luego
W=0
Q=ncV(TB-TA)
Donde cV es el calor específico a volumen constante
Isóbara o a presión constante
W=p(VB-VA)
Q=ncP(TB-TA)
Donde cP es el calor específico a presión constante
Calores específicos a presión constante cP y a volumen
constante cV
En una transformación a volumen constante, dU=dQ=ncVdT
En una transformación a presión constante, dU=ncPdT-pdV
Como la variación de energía interna dU no depende del tipo de transformación,
sino solamente del estado inicial y del estado final, la segunda ecuación se puede
escribir como ncVdT=ncPdT-pdV
Empleando la ecuación de estado de un gas ideal pV=nRT, obtenemos la relación
entre los calores específicos a presión constante y a volumen constante
cV=cP-R
Para un gas monoatómico U=32nRTcV=32RcP=52RU=32nRT cV=32R
cP=52R
Para un gas diatómico U=52nRTcV=52RcP=72RU=52nRT cV=52R
cP=72R
La variación de energía interna en un proceso AB es ΔU=ncV(TB-TA)
Se denomina índice adiabático de un gas ideal al cociente γ=cPcV
Isoterma o a temperatura constante
pV=nRT
La curva p=cte/V que representa la transformación en un diagrama p-V es una
hipérbola cuyas asíntotas son los ejes coordenados.
W=VB∫VApdV=VB∫VAnRTVdV=nRTlnVBVAW=∫VAVBpdV=∫VAVBnRTVd
V=nRTlnVBVA
ΔU=0
Q=W
Adiabática o aislada térmicamente, Q=0
Ecuación de la transformación adiabática
Del primer principio dU=-pdV
ncVdT=−nRTVdVdTT=−RcVdVVncVdT=−nRTVdV dTT=−RcVdVV
Integrando
lnT=RcVlnV+cteTVR/cV=ctePVR/cV+1=ctelnT=RcVlnV+cte
TVR/cV=cte PVR/cV+1=cte
Donde el exponente de V se denomina índice adiabático γ del gas ideal
γ=RcV+1=cP−cVcV+1=cPcVγ=RcV+1=cP−cVcV+1=cPcV
Si A y B son los estados inicial y final de una transformación adiabática se cumple
que
pAVγA=pBVγB,TAVγ−1A=TBVγ−1B
Cuadro-resumen de las transformaciones termodinámicas
Ecuación de estado de un gas ideal pV=nRT
Ecuación de una transformación adiabática pVγ=ctepVγ=cte
Relación entre los calores específicos cp-cV=R
Índice adiabático de un gas ideal γ=cpcVγ=cpcV
Primer Principio de la Termodinámica ΔU=Q-W
Var. Energía
Transformación Calor Trabajo
Interna
Q=ncV(TB-
Isócora (v=cte) 0 ΔU=ncV(TB-TA)
TA)
Q=ncp(TB-
Isóbara (p=cte) W=p(VB-VA) ΔU=ncV(TB-TA)
TA)
Isoterma
Q=W W=nRTlnVBVAW=nRTlnVBVA ΔU=0
(T=cte)
Adibática (Q=0) 0 W=-ΔU ΔU=ncV(TB-TA)
También podría gustarte
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- AF Primer Principio para Sistema Cerrados CompletoDocumento45 páginasAF Primer Principio para Sistema Cerrados Completoleandro lopezAún no hay calificaciones
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Trabajo en Sistemas TermodinámicosDocumento35 páginasTrabajo en Sistemas TermodinámicosJuan Isaias Jara LopezAún no hay calificaciones
- Demostración Matemática CP-CV RDocumento2 páginasDemostración Matemática CP-CV RRR EMAún no hay calificaciones
- Clase 5 - 1ER PRINC TERMO - ENERGIA INTERNADocumento36 páginasClase 5 - 1ER PRINC TERMO - ENERGIA INTERNABoris HergenretherAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- TAREA 2 TermodinamicaDocumento6 páginasTAREA 2 TermodinamicaJonni Antonio MorenoAún no hay calificaciones
- TermodinamicaDocumento16 páginasTermodinamicaEmmanuel AlvaradoAún no hay calificaciones
- Armónicas en Sistemas Eléctricos IndustrialesDe EverandArmónicas en Sistemas Eléctricos IndustrialesCalificación: 4.5 de 5 estrellas4.5/5 (12)
- Applied ChemistryDocumento7 páginasApplied Chemistrytamaramansurova50Aún no hay calificaciones
- Gases Ideales Primera LeyDocumento37 páginasGases Ideales Primera LeyJean Carlo GonzalesAún no hay calificaciones
- Primer TermodinamicaDocumento4 páginasPrimer Termodinamicamejora continuaAún no hay calificaciones
- 2da y 3ra LeyDocumento13 páginas2da y 3ra LeyAndy CamposAún no hay calificaciones
- Ciclo de CarnotDocumento4 páginasCiclo de CarnotDanitzaAún no hay calificaciones
- 20091IWQ111S1 Certamen II PDFDocumento7 páginas20091IWQ111S1 Certamen II PDFsteffan_schweikartAún no hay calificaciones
- Calor y TermodinámicaDocumento4 páginasCalor y TermodinámicaPaco BecaAún no hay calificaciones
- Clase N°8 1° LEY DE LA TERMODINAMICA (2° PARTE)Documento36 páginasClase N°8 1° LEY DE LA TERMODINAMICA (2° PARTE)EliúAngelRegaladoGuevaraAún no hay calificaciones
- Serie 1 - ResoluciónDocumento34 páginasSerie 1 - Resolucióneliana vegaAún no hay calificaciones
- Ecuciones TermodinámicaDocumento8 páginasEcuciones Termodinámicajose villamilAún no hay calificaciones
- 4 Balance de Energia para SCDocumento26 páginas4 Balance de Energia para SCJhonny Castro100% (1)
- Tarea3termo151 SolucionDocumento6 páginasTarea3termo151 SolucionsiriutAún no hay calificaciones
- Cálculos Del MotorDocumento106 páginasCálculos Del MotorLuis Patajalo73% (22)
- FORMULARIO Ciclos TermodinamicosDocumento2 páginasFORMULARIO Ciclos TermodinamicosAldo Calle100% (1)
- 1era Ley Termodinamica 2019Documento33 páginas1era Ley Termodinamica 2019Mildred Yoshiko Ricse VilaAún no hay calificaciones
- Formulario de Termodinamica 1Documento2 páginasFormulario de Termodinamica 1Jaime muñoz portugalAún no hay calificaciones
- Cap IIDocumento10 páginasCap IILuz AlvarezAún no hay calificaciones
- Motor de CarnotDocumento2 páginasMotor de CarnotSebastian Eduardo AndradeAún no hay calificaciones
- Trabajo de FronteraDocumento3 páginasTrabajo de FronteraFernando Sosa MedinaAún no hay calificaciones
- 1era Ley - Termodinamica - SEMANA13 - 14pptxDocumento79 páginas1era Ley - Termodinamica - SEMANA13 - 14pptxJIMMY GABRIELAún no hay calificaciones
- 09 Teoria Cinetica de Los GasesDocumento19 páginas09 Teoria Cinetica de Los GasesYamilmartinmamaniAún no hay calificaciones
- Formulario de TermodinamicaDocumento2 páginasFormulario de TermodinamicaDiego FrancoAún no hay calificaciones
- Ciclo OttoDocumento35 páginasCiclo OttoJonh LopezAún no hay calificaciones
- Portafolio 26 y 29Documento13 páginasPortafolio 26 y 29MoyCoral100% (3)
- Tarea 4 Jimena LopezDocumento7 páginasTarea 4 Jimena LopezPamela MuñozAún no hay calificaciones
- Formulario FisicoquimicaDocumento9 páginasFormulario FisicoquimicaMeli Arazelly CazerezAún no hay calificaciones
- 4 Balance de Energia para SCDocumento28 páginas4 Balance de Energia para SCEduardo Montenegro ValenciaAún no hay calificaciones
- 9.2. Procesos Termodinámicos Especiales - PgauDocumento3 páginas9.2. Procesos Termodinámicos Especiales - Pgauluisvilena919Aún no hay calificaciones
- Balance de Energia para SCDocumento27 páginasBalance de Energia para SCÂres ŁeöAún no hay calificaciones
- 2 Gas IdealDocumento12 páginas2 Gas IdealJose Alonzo VivancosAún no hay calificaciones
- Ciclo CarnotDocumento5 páginasCiclo CarnotJavier AnguianoAún no hay calificaciones
- pautaPEP1 Termodinamica 2 Sem 2021Documento3 páginaspautaPEP1 Termodinamica 2 Sem 2021Abelardo Zuniga VaqueroAún no hay calificaciones
- Clase N°8 1° LEY DE LA TERMODINAMICA (2° PARTE)Documento30 páginasClase N°8 1° LEY DE LA TERMODINAMICA (2° PARTE)Juan VasquezAún no hay calificaciones
- Ejercicios Resueltos de Ciclos Otto y BraytonDocumento8 páginasEjercicios Resueltos de Ciclos Otto y BraytonRicardo Arturo S LAún no hay calificaciones
- Formulario GlobalDocumento4 páginasFormulario GlobalCRISTIAN UBEDA SELUME100% (2)
- Módulo Vii - TermoquímicaDocumento43 páginasMódulo Vii - TermoquímicaIsaac MuñozAún no hay calificaciones
- Formulario TermodinamicaDocumento4 páginasFormulario TermodinamicaBentura VenturaAún no hay calificaciones
- Interrogaci On Nro. 1: NombreDocumento6 páginasInterrogaci On Nro. 1: NombreLuis RiveraAún no hay calificaciones
- Pauta Tarea 3Documento3 páginasPauta Tarea 3Caarlos Brevis AldanaAún no hay calificaciones
- Actividad 1 Segunda Unidad Gases IdealesDocumento11 páginasActividad 1 Segunda Unidad Gases IdealesDaniela LunaAún no hay calificaciones
- Gas Ideal F2Documento29 páginasGas Ideal F2AmIn20122Aún no hay calificaciones
- TermodinamicaDocumento36 páginasTermodinamicaBiblioteca Amauta SurAún no hay calificaciones
- Formulario FisicoquímicaDocumento6 páginasFormulario Fisicoquímicavaam0507Aún no hay calificaciones
- Apunte Transformaciones Con GasesDocumento12 páginasApunte Transformaciones Con GasesRocio FrescuraAún no hay calificaciones
- 05 Primera Ley Masa de ControlDocumento4 páginas05 Primera Ley Masa de ControlLAZYAún no hay calificaciones
- Echeverria, Plantas Termicas, Turbinas, ProcesosDocumento129 páginasEcheverria, Plantas Termicas, Turbinas, ProcesosFidel RomeroAún no hay calificaciones
- Clase 06 y 07 - Procesos TermodinámicosDocumento51 páginasClase 06 y 07 - Procesos TermodinámicosMARIA FERNANDA EGUILUZ ROBLESAún no hay calificaciones
- Manual de Partes Tnt600i ProvisionalDocumento92 páginasManual de Partes Tnt600i ProvisionalTapia Acuña BairoAún no hay calificaciones
- FTT U1 Ea CegoDocumento4 páginasFTT U1 Ea CegoBrenda Diaz SierraAún no hay calificaciones
- Fisica - 10Documento8 páginasFisica - 10Augusto Sánchez CardozoAún no hay calificaciones
- DABOTEWBPD2WDocumento14 páginasDABOTEWBPD2Wvideoric8867Aún no hay calificaciones
- 08 de Agosto Matem. PatronesDocumento13 páginas08 de Agosto Matem. PatronesAnyhi PiñanAún no hay calificaciones
- Avance Proyección SocialDocumento17 páginasAvance Proyección SocialLuz Sanchez FigueroaAún no hay calificaciones
- Ruta 02 Cast PDFDocumento32 páginasRuta 02 Cast PDFJaime FlorsAún no hay calificaciones
- Carta Del Personal Clave RESIDENTEDocumento1 páginaCarta Del Personal Clave RESIDENTEEdinson SánchezAún no hay calificaciones
- Experimentos y Experiencias SensorialesDocumento13 páginasExperimentos y Experiencias Sensorialesed_parvularia_08Aún no hay calificaciones
- Tarea 1 Fuentes de Voltaje y CorrienteDocumento6 páginasTarea 1 Fuentes de Voltaje y CorrienteJuan BahenaAún no hay calificaciones
- CerusitaDocumento28 páginasCerusitaCarlos LlonaAún no hay calificaciones
- Certificado de Deposito, Warran SBS.RDocumento26 páginasCertificado de Deposito, Warran SBS.ROsito FastAún no hay calificaciones
- Proyecto ProductivoDocumento60 páginasProyecto ProductivoZairha Daniela Peña BalantaAún no hay calificaciones
- Conociendo Mis Logros 2024-Reunión InformativaDocumento19 páginasConociendo Mis Logros 2024-Reunión Informativaerasmo64100% (2)
- El Intenso Amor en El Poema Las Calles Vacías Por David Auris VillegasDocumento4 páginasEl Intenso Amor en El Poema Las Calles Vacías Por David Auris VillegasJesusSiasAlvarezAún no hay calificaciones
- 22EM3853P12Documento2 páginas22EM3853P12Eduardo VillafuerteAún no hay calificaciones
- u3EJERCICIO PRACTICO 4Documento27 páginasu3EJERCICIO PRACTICO 4Vany LozanoAún no hay calificaciones
- Geoindicadores 2Documento4 páginasGeoindicadores 2dila gonzalezAún no hay calificaciones
- Ipeman - Curso RCM (2pag)Documento53 páginasIpeman - Curso RCM (2pag)polsiemprealdo100% (2)
- GST (Vo) 006Documento1 páginaGST (Vo) 006Leonel BerlinAún no hay calificaciones
- Estándares y Expectativas de Matemáticas 00 - IntroduccionDocumento67 páginasEstándares y Expectativas de Matemáticas 00 - IntroduccionTaller Sigma100% (2)
- Sistemas de Produccion e InventariosDocumento4 páginasSistemas de Produccion e InventariosJosé Antonio Rivero GómezAún no hay calificaciones
- Producto Acádemico 3Documento3 páginasProducto Acádemico 3GENRRY ALDAZABAL PORTILLAAún no hay calificaciones
- 6167-BT-02 Membrana Celular y Transporte 2020Documento16 páginas6167-BT-02 Membrana Celular y Transporte 2020franciscaAún no hay calificaciones
- FRUTASDocumento12 páginasFRUTASyonja_2191Aún no hay calificaciones
- Diptico Grupo 5Documento2 páginasDiptico Grupo 5cerobaAún no hay calificaciones
- Primer Curso Teorico Practico LibroDocumento15 páginasPrimer Curso Teorico Practico LibroAdolfo Rodríguez CantoAún no hay calificaciones
- Paper GuajiraDocumento6 páginasPaper GuajiraOttón MartínezAún no hay calificaciones
- Tercera Practica Califica Fisica Ii - Fb401w-Fiis-2021-IiDocumento2 páginasTercera Practica Califica Fisica Ii - Fb401w-Fiis-2021-IiJAMES ALBERTO TORRES LUCASAún no hay calificaciones
- Matos CmagDocumento106 páginasMatos CmagGeraldine Ola De Mar FlorSaAún no hay calificaciones