Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cloruro de Carbono (IV)
Cargado por
Jorge FyhyhDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cloruro de Carbono (IV)
Cargado por
Jorge FyhyhCopyright:
Formatos disponibles
Cloruro de carbono (IV)
El cloruro de carbono(IV) o tetracloruro de carbono, CCl4, es
un compuesto químico sintético, organoclorado, no inflamable,
Cloruro de carbono
antiguamente utilizado como extintor y en la producción de
refrigerantes, pero actualmente abandonado debido a su toxicidad.
Es un líquido incoloro de olor ligeramente dulce. Se obtiene
haciendo pasar dicloro (Cl2) por sulfuro de carbono (S2C), en
presencia de pentasulfuro de antimonio, y separando el tetracloruro
de carbono del monocloruro de azufre formado (p. eb. 135.6 °C)
por destilación fraccionada. Puede encontrarse en pequeñas
cantidades en el aire. El tetracloruro de carbono se usó en la
industria como un buen líquido refrigerante, un potente plaguicida
y fungicida, un potente producto desengrasante -elimina con suma
facilidad ceras, aceites y grasas, tanto las saponificables como las
que no lo son-, desinfectante genérico, como disolvente en pinturas
de aeromodelismo y de uso doméstico, y como agente extintor por
la liberación de fosgeno. Cuando se degrada, forma sustancias
químicas que pueden ser perjudiciales para lacapa de ozono.2 3
Nombre IUPAC
Tetracloruro de carbono(IV)
Índice Tetracloruro de carbono
Toxicocinética Tetraclorometano
Mecanismos de acción tóxicos General
Mecanismo hepatotóxico
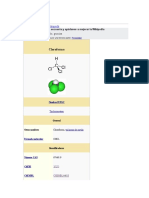
Fórmula CCl4
Otros mecanismos
semidesarrollada
Efectos de exposición
Fórmula
Efectos de la exposición en humanos
estructural
Interacciones
Límites de exposición
Determinaciones de laboratorio
Referencias Fórmula ?
molecular
Identificadores
Toxicocinética Número CAS 56-23-51
Podemos encontrar cantidades muy bajas de CCl4 en el aire, en el Número RTECS FG4900000
agua y en el suelo. La exposición a niveles más altos podría ocurrir ChEBI 27385
en industrias que no controlen bien las emisiones. El CCl4 se puede
ChEMBL CHEMBL44814
absorber por vía respiratoria, digestiva, ocular y por la piel
ChemSpider 5730
lesionada. La mayor parte del CCl4 es eliminada del cuerpo
inalterado, pero cierta cantidad puede transformarse a otras
PubChem 5943
sustancias, como cloroformo, hexacloroetano, anhídrido carbónico UNII CL2T97X0V0
o fosgeno.2 KEGG C07561
InChI
Mecanismos de acción tóxicos
InChI=1S/CCl4/c2-1(3,4)5
Key: VZGDMQKNWNREIO-UHFFF AOYSA-N
Mecanismo hepatotóxico
Propiedades físicas
Sus mecanismos principales de acción son el estrés oxidativo y la
Apariencia Líquido incoloro
alteración de la homeostasis de calcio. El CCl4 aumenta su
Densidad 1595 kg/m3; 1,595 g/cm3
toxicidad al ser metabolizado produciendo radicales libres .4 Sufre
oxidaciones multifuncionales a través del citocromo P-450 . A baja
Masa molar 153.8 g/mol
presión de oxígeno se forma el radical triclorometilo (Cl3C·) y a Punto de fusión 250 K (-23 °C)
alta presión de oxígeno se sigue oxidando y se forma el radical Punto de 350 K (77 °C)
triclorometilperoxilo (Cl3COO·) que es más tóxico aún. Ambos ebullición
radicales inician una reacción en cadena de lipoperoxidación, Temperatura 556 K (283 °C)
5
lesionando al hígado y a otros tejidos como el pulmón. crítica
Presión crítica 55 atm
Las reacciones hepatotóxicas por CCl4 tienen dos fases:
Índice de 1,4607
Durante la primera hora después de la exposición refracción (nD)
aparecen los metabolitos reactivos (Cl3COO· y Cl3C·), la
peroxidación de lípidos y las uniones covalentes a los
Propiedades químicas
receptores nucleófilos. Solubilidad en 0.08 g/100 g de agua
A las seis horas aparecen las consecuencias de la
agua
acumulación intracelular de calcio. Se produce la Momento dipolar 0 D
necrosis de células aisladas, que evoluciona hacia una
necrosis centrolobulillar extrema en las 24-48 horas Termoquímica
siguientes. La regeneración celular es máxima entre 36- ΔfH0gas -95.5 kJ/mol
48 horas después de la dosis.5
ΔfH0líquido -128 kJ/mol
Los radicales libres formados en la primera fase tienen como diana
ΔfH0sólido -130 kJ/mol
los fosfolípidos de membrana, produciendo roturas en ella. Esto
provoca que aumente la concentración de calcio en el citosol
S0gas, 1 bar 309.7 J·mol-1·K
debido también a la disminución del secuestro de calcio S0líquido, 1 bar 216 J·mol-1·K-1
intracelular. Peligrosidad
NFPA 704
En los hepatocitos, esta elevación del calcio intracelular activa la 0
fosfolipasa A2 y agrava la afectación de la membrana. Es posible 3 0
que este mecanismo también intervenga en la alteración de la
actividad de la calmodulina y la fosforilasa, así como de la proteína
cinasa del núcleo. El aumento del calcio estimula la liberación de Riesgos
citosinas y eicosanoides, provocando la infiltración por neutrófilos Ingestión Muy peligroso, a largo plazo
y la lesión hepatocelular. Debido al aumento del calcio intracelular, puede dañar el cerebro.
la mitocondria va a intentar captar calcio para reducir los niveles. Inhalación Muy peligroso, a largo plazo
Para ello va a utilizar ATP y por lo tanto no estará disponible para puede dañar el cerebro.
el resto de funciones de la célula, produciéndose un déficit Piel Puede causar irritación.
energético que agrava el proceso. También se produce una Ojos Puede causar irritación.
depleción de los niveles de glutatión, provocando inactivaciones
Más información Hazardous Chemical
enzimáticas. La consecuencia de todos estos procesos es la muerte Database (en inglés)
celular.6
Compuestos relacionados
Haluros CF4, CBr4, CI4
Otros mecanismos Cloruros SiCl4, GeCl4
A nivel renal la exposición al tetracloruro de carbono Valores en el SI y en condiciones estándar
puede disminuir la producción de orina, provocando (25 °C y 1 atm), salvo que se indique lo contrario.
acumulación de agua en el cuerpo, especialmente en los
pulmones, y productos de desecho en la sangre. El fallo [editar datos en Wikidata]
renal ha sido la mayor causa de muerte por exposición a este tóxico.
A nivel del sistema nervioso la exposición al CCl
4 afecta principalmente al cerebro. Los efectos inmediatos son dolor
de cabeza, mareo, somnolencia, náuseas y vómitos. En los casos más graves se puede producir coma, o daño
permanente de las células nerviosas.2
Efectos de exposición
El tetracloruro de carbono es un hepatotóxico clásico. En los humanos es más grave la lesión renal pero no está muy estudiada, no se
6
han encontrado modelos animales adecuados para su evaluación.
6
En ratas, la lesión hepatocelular se ha visto con los siguientes efectos:
Disociación de los polisomas y ribosomas del retículo endoplasmático rugoso.
Desorganización del retículo endoplasmático liso.
Inhibición de la síntesis de proteínas.
Acumulación de triglicéridos.
Se ha demostrado que el CCl4 es cancerígeno en animales de laboratorio, pero no hay pruebas suficientes sobre su efecto genotóxico
en humanos.2
Efectos de la exposición en humanos
Corta duración: irritación de los ojos, efectos en hígado, riñón y sistema nervioso central, pudiendo dar lugar a
pérdida de conocimiento.
Larga duración: dermatitis, posiblecarcinogenicidad.7
Interacciones
Muchos de los casos de intoxicación con CCl4 están asociados con consumo de alcohol ya que aumenta el riesgo de daño al hígado.
La toxicidad también se ve aumentada por losbarbitúricos.2
Límites de exposición
TVL-STEL 10 ppm
TVL-TWA 5 ppm
MAK 0.5 ppm
A2 (piel)
H. Cancerígeno clase 4
Categoría de limitación de pico II(2)
Riesgo para el embarazo, grupo C
Tabla 1: Límites de exposición.7
Determinaciones de laboratorio
IBE 1 mg/l
Niveles de CCl4 en sangre Hasta 0.1 mg/l
Niveles de CCl4 en aire exhalado 3 ppm
Triclorocompuestos totales en orina 300 mg/g de creatinina
Tabla 2: Determinaciones de laboratorio.3
Referencias
1. Número CAS (http://webbook.nist.gov/cgi/cbook.cgi?ID=56-23-5)
2. «Agencia para Sustancias Tóxicas y el Registro de Enfermedades»
(http://www.atsdr.cdc.gov/es/phs/es_phs30.html). Consultado el 2 de noviembre de 2015.
3. «El ergonomista, Seguridad y Salud laboral.T etracloruro de carbono»(https://web.archive.org/web/20150810015837/
http://www.elergonomista.com/tetracloruro.htm). Archivado desde el original (http://www.elergonomista.com/tetraclor
uro.htm) el 10 de agosto de 2015. Consultado el 2 de noviembre de 2015.
4. Martínez-Cayuela (1998).M.Toxicidad de xenobióticos mediada por radicales libres de oxígeno. Ars Pharmaceutica.
pp. 39:1; 5-18.
5. Repetto Jiménez, Manuel; Repetto Kuhn, Guillermo (2009).Toxicología fundamental(4ª edición). Díaz de Santos.
6. Klaaseen, Curtis D.; Watkins III, John B. (2005). Casarett y Doull. Fundamentos de Toxicología. Mc Graw Hill.
7. «Ficha internacional de seguridad química del cloruro de carbono»(http://www.insht.es/InshtWeb/Contenidos/Docum
entacion/FichasTecnicas/FISQ/Ficheros/0a100/nspn0024.pdf).
Obtenido de «https://es.wikipedia.org/w/index.php?title=Cloruro_de_carbono_(IV)&oldid=112705230
»
Esta página se editó por última vez el 16 dic 2018 a las 13:21.
El texto está disponible bajo laLicencia Creative Commons Atribución Compartir Igual 3.0 ; pueden aplicarse cláusulas
adicionales. Al usar este sitio, usted acepta nuestrostérminos de uso y nuestra política de privacidad.
Wikipedia® es una marca registrada de laFundación Wikimedia, Inc., una organización sin ánimo de lucro.
También podría gustarte
- CloroformoDocumento7 páginasCloroformoRuth Vargas PimentelAún no hay calificaciones
- REACTIVOSDocumento18 páginasREACTIVOSKarla Massiel MartinezAún no hay calificaciones
- Efecto Hepatotoxico Del Tetracloruro de Carbono PDFDocumento16 páginasEfecto Hepatotoxico Del Tetracloruro de Carbono PDFHupal Rafael100% (1)
- Lab Quimica Organica II Informe 6 SintesDocumento5 páginasLab Quimica Organica II Informe 6 SintesDANIELA FRANCISCA IBÁÑEZAún no hay calificaciones
- Ayuda de MamiDocumento70 páginasAyuda de MamiCarol YundaAún no hay calificaciones
- Alcanos Química OrgánicaDocumento12 páginasAlcanos Química OrgánicaNatxo OlalAún no hay calificaciones
- Intoxicacion Por PlaguicidasDocumento22 páginasIntoxicacion Por PlaguicidasCarol Arratia ContrerasAún no hay calificaciones
- Informe #1 MetanolDocumento6 páginasInforme #1 MetanolDeinir SolanoAún no hay calificaciones
- Informe Metenamina - Brayan Alexander Ceron - MiercolesDocumento5 páginasInforme Metenamina - Brayan Alexander Ceron - MiercolesBRAYAN ALEXÁNDER CERON CRUZAún no hay calificaciones
- Delfina Mezzano MIMetanolDocumento12 páginasDelfina Mezzano MIMetanoljorge bergamoAún no hay calificaciones
- Que Es PCBDocumento9 páginasQue Es PCBJuan PabloAún no hay calificaciones
- Informe de Práctica N 9 Química OrgánicaDocumento11 páginasInforme de Práctica N 9 Química OrgánicaPercy Paucar100% (1)
- REV-Informe Lab 5 EliminaciónDocumento8 páginasREV-Informe Lab 5 EliminaciónRodrigo MolinaAún no hay calificaciones
- Informe Ciclo de Krebs Bioquimica MonoDocumento3 páginasInforme Ciclo de Krebs Bioquimica MonosebastianAún no hay calificaciones
- Práctica #VIII y IX Reacciones de Sustitución y Eliminación en Haluros de Alquilo y Síntesis de MentonaDocumento13 páginasPráctica #VIII y IX Reacciones de Sustitución y Eliminación en Haluros de Alquilo y Síntesis de MentonaIrving JiménezAún no hay calificaciones
- Caso Clínico 3Documento12 páginasCaso Clínico 3andresAún no hay calificaciones
- HalogenacionDocumento10 páginasHalogenacionRafael A. Feria QuintanaAún no hay calificaciones
- Halogenuros de AlquiloDocumento65 páginasHalogenuros de AlquiloemanuelAún no hay calificaciones
- Bioquímica - Sem-04 - Sesión-13 - 202-0 Modifg1Documento73 páginasBioquímica - Sem-04 - Sesión-13 - 202-0 Modifg1herly funegraAún no hay calificaciones
- ToluenoDocumento6 páginasToluenoAlvarexqui GuterzonAún no hay calificaciones
- Halogenacion de AlquenosDocumento5 páginasHalogenacion de AlquenosLópez DiegoAún no hay calificaciones
- S8Documento16 páginasS8Paoli RuizAún no hay calificaciones
- Portada - Proyecto VCMDocumento7 páginasPortada - Proyecto VCMPablo Lopez PiñeiroAún no hay calificaciones
- Chalconas 2Documento9 páginasChalconas 2Tomás Flavio Delgado CastroAún no hay calificaciones
- CCI4 DiplomadoDocumento17 páginasCCI4 DiplomadoJose Emmanuel GaonaAún no hay calificaciones
- CocainaDocumento14 páginasCocainaQF Carlos AbarcaAún no hay calificaciones
- Tetrafluoroborato - de - 1 Butil 3 MetilimidazolioDocumento3 páginasTetrafluoroborato - de - 1 Butil 3 MetilimidazolioJhanierEulerGetialDiazAún no hay calificaciones
- Sintesis de Ciclohexano Practica 8Documento7 páginasSintesis de Ciclohexano Practica 8adrian_a20100802350% (6)
- Dióxido de Cloro - Wikipedia, La Enciclopedia LibreDocumento6 páginasDióxido de Cloro - Wikipedia, La Enciclopedia LibrejumanachiAún no hay calificaciones
- Práctica N°5 Halogenación de ParafinasDocumento14 páginasPráctica N°5 Halogenación de ParafinasDilan LeónAún no hay calificaciones
- Obtension de Alquenos - PRACTICA 6Documento7 páginasObtension de Alquenos - PRACTICA 6Rosaura Duno100% (2)
- Actividad AlquenosDocumento5 páginasActividad AlquenosKmilo MurielAún no hay calificaciones
- Reactivos Utilizados en El Laboratorio de QuimicaDocumento23 páginasReactivos Utilizados en El Laboratorio de QuimicaGenaroMallqui80% (5)
- Laboratorio 8 OrganicaDocumento13 páginasLaboratorio 8 Organicacesarinarraga100% (2)
- Clase y Hoja de Trabajo Biologia 4º Año II LapsoDocumento6 páginasClase y Hoja de Trabajo Biologia 4º Año II LapsoindianaAún no hay calificaciones
- Quimica OrganicaDocumento26 páginasQuimica OrganicaDiana RubiAún no hay calificaciones
- Hidrocarburos Ernesto Duran NDocumento3 páginasHidrocarburos Ernesto Duran NErnesto DuranAún no hay calificaciones
- Trabajo Práctico N°1 Química Orgánica Ii: Ingenierías Química Profesorado en QuímicaDocumento8 páginasTrabajo Práctico N°1 Química Orgánica Ii: Ingenierías Química Profesorado en QuímicaAldo MeriñoAún no hay calificaciones
- PLAGUICIDASDocumento9 páginasPLAGUICIDASEnriqueNoaAún no hay calificaciones
- PCR TecnicasDocumento32 páginasPCR TecnicasAurora OsegueraAún no hay calificaciones
- Comparaciones de Procesos de RefinaciónDocumento53 páginasComparaciones de Procesos de RefinaciónRichard RodríguezAún no hay calificaciones
- Practica PRÁCTICA 5 HALOGENACIÓN DE PARAFINASDocumento14 páginasPractica PRÁCTICA 5 HALOGENACIÓN DE PARAFINASTalin DavidAún no hay calificaciones
- Sintesis de Cloruro de Ter ButiloDocumento7 páginasSintesis de Cloruro de Ter ButiloValentinaToroAún no hay calificaciones
- Síntesis de Ciclohexeno InformeDocumento3 páginasSíntesis de Ciclohexeno InformemaraAún no hay calificaciones
- Clase 8 Halogenuros de Alquilo PDFDocumento6 páginasClase 8 Halogenuros de Alquilo PDFRoberto FiorilloAún no hay calificaciones
- Qué Es La Actividad CatalíticaDocumento5 páginasQué Es La Actividad CatalíticaLeonel Santos NavaAún no hay calificaciones
- Etileno - Wikipedia, La Enciclopedia LibreDocumento7 páginasEtileno - Wikipedia, La Enciclopedia LibreLorenzo JimenezAún no hay calificaciones
- Ácido Malónico y MalonatosDocumento7 páginasÁcido Malónico y MalonatosNoheli PatiñoAún no hay calificaciones
- ToluenoDocumento4 páginasToluenoMarco HipolitoAún no hay calificaciones
- Informe EstirenoDocumento19 páginasInforme EstirenodavismoodyAún no hay calificaciones
- Exposiciones QODocumento8 páginasExposiciones QOlopezmanzanocarmen1Aún no hay calificaciones
- Hidrocarburos CicloalquenosDocumento3 páginasHidrocarburos CicloalquenosHenry Soto0% (1)
- Biodegradación Anaeróbica de Hidrocarburos Saturados y AromáticosDocumento20 páginasBiodegradación Anaeróbica de Hidrocarburos Saturados y AromáticosAndrés Vélez HenaoAún no hay calificaciones
- Noval Gomez Lucia TFMDocumento52 páginasNoval Gomez Lucia TFMCarlos Eduardo Dioses SaldarriagaAún no hay calificaciones
- Informe 4 Ciclohexilbutan 2 OlDocumento8 páginasInforme 4 Ciclohexilbutan 2 OlAngela aponteAún no hay calificaciones
- Balance de Energía SimplificadoDocumento3 páginasBalance de Energía SimplificadoOkay?Aún no hay calificaciones
- Practica No 5 Sintesis de Cloruro de TerbutiloDocumento7 páginasPractica No 5 Sintesis de Cloruro de TerbutiloanonymuusAún no hay calificaciones
- 05 Glucólisis Fermentación y Respiración CelularDocumento23 páginas05 Glucólisis Fermentación y Respiración CelularricardochavezrAún no hay calificaciones
- Síntesis de productos químicos derivados de la biomasa empleando catálisis heterogénea: heterociclos de la biomasaDe EverandSíntesis de productos químicos derivados de la biomasa empleando catálisis heterogénea: heterociclos de la biomasaAún no hay calificaciones
- ElectronegatividadDocumento3 páginasElectronegatividadJorge FyhyhAún no hay calificaciones
- Capa FreáticaDocumento6 páginasCapa FreáticaJorge FyhyhAún no hay calificaciones
- Perfil de Proyecto de Investigación Posgrado PDFDocumento1 páginaPerfil de Proyecto de Investigación Posgrado PDFJorge FyhyhAún no hay calificaciones
- Cloruro de CincDocumento5 páginasCloruro de CincJorge FyhyhAún no hay calificaciones
- Ácido SilícicoDocumento2 páginasÁcido SilícicoJorge FyhyhAún no hay calificaciones
- Estandar de Estacion de Barretillas en MinaDocumento1 páginaEstandar de Estacion de Barretillas en MinaJorge FyhyhAún no hay calificaciones
- PatologíaDocumento5 páginasPatologíaJorge FyhyhAún no hay calificaciones
- Nitrato de AmonioDocumento9 páginasNitrato de AmonioJorge FyhyhAún no hay calificaciones
- BismutoDocumento6 páginasBismutoJorge FyhyhAún no hay calificaciones
- SátiroDocumento4 páginasSátiroJorge FyhyhAún no hay calificaciones
- ÁstatoDocumento2 páginasÁstatoJorge FyhyhAún no hay calificaciones
- UranioDocumento7 páginasUranioJorge FyhyhAún no hay calificaciones
- Dinamita Famesa PulverulentaDocumento2 páginasDinamita Famesa Pulverulentaanon_626714735Aún no hay calificaciones
- Rub IdioDocumento4 páginasRub IdioJorge FyhyhAún no hay calificaciones
- ItrioDocumento4 páginasItrioJorge FyhyhAún no hay calificaciones
- WolframioDocumento9 páginasWolframioJorge FyhyhAún no hay calificaciones
- OsmioDocumento11 páginasOsmioJorge FyhyhAún no hay calificaciones
- Osmio PDFDocumento3 páginasOsmio PDFJorge Fyhyh0% (1)
- Los - Mamiferos - I Origenes PDFDocumento7 páginasLos - Mamiferos - I Origenes PDFbrancobraeAún no hay calificaciones
- Inseminacion en Bovinos 2. Unidad 1Documento36 páginasInseminacion en Bovinos 2. Unidad 1Jordano MoisesAún no hay calificaciones
- Tesis Definitiva G - 01 14-02-2015 .Documento73 páginasTesis Definitiva G - 01 14-02-2015 .Ali TeránAún no hay calificaciones
- Ficha RespiratorioDocumento2 páginasFicha RespiratorioJose Luis Medina LlicanAún no hay calificaciones
- Aparato DigestivoDocumento34 páginasAparato DigestivomiriamAún no hay calificaciones
- Avenida 2 Abril Junio 2015 PDFDocumento52 páginasAvenida 2 Abril Junio 2015 PDFAgus TolabaAún no hay calificaciones
- Familias Del Orden LepidopteraDocumento8 páginasFamilias Del Orden LepidopteraDaniela VergaraAún no hay calificaciones
- No Puedo Amarte - Mery EirabellaDocumento391 páginasNo Puedo Amarte - Mery EirabellaManuel100% (1)
- Congreso Internacional de Medicina y Cirugía Equina 2010Documento355 páginasCongreso Internacional de Medicina y Cirugía Equina 2010Enciaflor100% (2)
- Planeacion NssaDocumento11 páginasPlaneacion NssaLory Miranda100% (1)
- StreptophytasDocumento7 páginasStreptophytasJuliánAún no hay calificaciones
- Caballos Mustang ACTIVIDAD COMPLETA Y HECHADocumento3 páginasCaballos Mustang ACTIVIDAD COMPLETA Y HECHAAstrid AteneaAún no hay calificaciones
- Taller de ColagenoDocumento27 páginasTaller de ColagenoDaniel Otaku Gomez DominguezAún no hay calificaciones
- Imagenologia de ATMDocumento104 páginasImagenologia de ATMAlbeiro David Cordoba SolarteAún no hay calificaciones
- Planeaciones Semana 2 y 3 de AbrilDocumento32 páginasPlaneaciones Semana 2 y 3 de AbrilAriadna Caro TorresAún no hay calificaciones
- Inmunofluorescencia 2Documento19 páginasInmunofluorescencia 2Rafael ZevallosAún no hay calificaciones
- Calor CT QuintoDocumento7 páginasCalor CT QuintoVICTORIAAún no hay calificaciones
- Indice de Resazurina PDFDocumento6 páginasIndice de Resazurina PDFSilvana MatheusAún no hay calificaciones
- Manejo de Conducta OdpDocumento25 páginasManejo de Conducta OdpJuDhy Vásquez ParedesAún no hay calificaciones
- Boletín N°3 - Ciencia y Tecnología 5Documento2 páginasBoletín N°3 - Ciencia y Tecnología 511-MH-HU-MELANIE MILAGROS CORDOVA RODRIGUEZAún no hay calificaciones
- Ciencias Relaciones InterespecíficasDocumento5 páginasCiencias Relaciones InterespecíficasMatias BPAún no hay calificaciones
- Chiri ChiriDocumento3 páginasChiri ChiriVikyMirandaAún no hay calificaciones
- Enfermedades Del Cristalino y GlaucomaDocumento55 páginasEnfermedades Del Cristalino y GlaucomaAnonymous VqqtuR100% (1)
- Guia Resumen Organismo Ambiente y Sus InteraccionesDocumento3 páginasGuia Resumen Organismo Ambiente y Sus InteraccionesClaudia FuentesAún no hay calificaciones
- Salud Familiar - Modelo de Salud Integral APS - 1999Documento182 páginasSalud Familiar - Modelo de Salud Integral APS - 1999rardilesi71% (7)
- Farmacología de La QuimioterapiaDocumento111 páginasFarmacología de La QuimioterapiaResidencia Pediatría HEGCAún no hay calificaciones
- Decreto 263 - 1986 Reglamento Sanidad Maritima, Aerea y de FronterasDocumento11 páginasDecreto 263 - 1986 Reglamento Sanidad Maritima, Aerea y de FronterasMauro LaraAún no hay calificaciones
- Test Nines CompletoDocumento30 páginasTest Nines CompletoJaime terrazas carrascoAún no hay calificaciones
- Dermatologia Correlacion Clinico PatologicaDocumento640 páginasDermatologia Correlacion Clinico PatologicaMaría RizoAún no hay calificaciones
- Rep T0 TP ZVJs S1 KW SXR3 UHd MNXFoa HD EQT09Documento1 páginaRep T0 TP ZVJs S1 KW SXR3 UHd MNXFoa HD EQT09Ale TaboraAún no hay calificaciones