0% encontró este documento útil (0 votos)
347 vistas25 páginasConductividad de Soluciones Electrolíticas
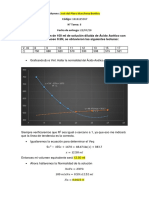
La práctica experimental midió la conductividad de soluciones de KCl, HCl y HAc a diferentes concentraciones bajo condiciones controladas. Se valoraron las soluciones para determinar sus concentraciones exactas y se midió la conductividad de cada una. Los datos se usaron para calcular la constante de ionización del ácido acético y la conductividad equivalente a dilución infinita para HCl, obteniendo porcentajes de error respecto a los valores teóricos.
Cargado por
Carla AndreaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
347 vistas25 páginasConductividad de Soluciones Electrolíticas
La práctica experimental midió la conductividad de soluciones de KCl, HCl y HAc a diferentes concentraciones bajo condiciones controladas. Se valoraron las soluciones para determinar sus concentraciones exactas y se midió la conductividad de cada una. Los datos se usaron para calcular la constante de ionización del ácido acético y la conductividad equivalente a dilución infinita para HCl, obteniendo porcentajes de error respecto a los valores teóricos.
Cargado por
Carla AndreaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd