100% encontró este documento útil (1 voto)
378 vistas9 páginasAminación Reductora y Formación de Iminas
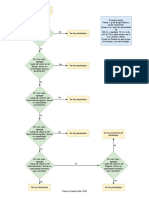
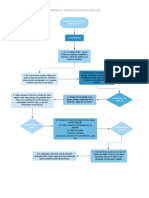
La aminación reductora consiste en la formación de una imina a partir de una aldehído o cetona y una amina, que luego se reduce a una amina. Este proceso puede llevarse a cabo reduciendo la imina con H2 utilizando Ni como catalizador, o con NaBH3CN. El documento describe varias reacciones orgánicas clave como la condensación aldólica, la reacción de Wolff-Kishner, la reacción de Mannich y la reacción de Cannizzaro.
Cargado por
Anonymous bN3j9r8vbBDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (1 voto)
378 vistas9 páginasAminación Reductora y Formación de Iminas
La aminación reductora consiste en la formación de una imina a partir de una aldehído o cetona y una amina, que luego se reduce a una amina. Este proceso puede llevarse a cabo reduciendo la imina con H2 utilizando Ni como catalizador, o con NaBH3CN. El documento describe varias reacciones orgánicas clave como la condensación aldólica, la reacción de Wolff-Kishner, la reacción de Mannich y la reacción de Cannizzaro.
Cargado por
Anonymous bN3j9r8vbBDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd