Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Oclusión
Cargado por
Estrella MedinaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Oclusión
Cargado por
Estrella MedinaCopyright:
Formatos disponibles
Oclusin Fenmeno por el que un gas o un slido quedan retenidos en la estructura cristalina de un metal. A veces se forman compuestos intersticiales.
La oclusin aumenta con la temperatura y presin del gas. El trmino tambin hace referencia a la absorcin de iones de un electrlito por un precipitado. Oclusin. Consiste en el arrastre de impurezas en el interior de un cristal durante su crecimiento. Existen dos mecanismos posibles, los que pueden ocurrir separada o simultneamente: Oclusin de iones extraos en el retculo del precipitado. Se trata de iones capaces de sustituir a los cationes o aniones del retculo cristalino. Generalmente los iones del cristal se sustituyen durante el crecimiento con iones de igual carga y tamao presentes en la solucin. Los cristales que se forman a partir de estas sustituciones constituyen soluciones slidas y se producen en rangos de concentracin especficos. Existen numerosos ejemplos de soluciones slidas, como las formadas por BaSO4 con BaCrO4. As, cuando se mezcla una solucin de Ba+2 en medio clorhdrico con solucin de CrO4 = no ocurre precipitacin debido a que la concentracin de CrO4 = en medio cido no es suficiente para superar el Kps(BaCrO4). Sin embargo si previamente se adiciona K2SO4 a la solucin precipitar BaSO4 y el cristal formado contendr aproximadamente un 5% de anin CrO4 = . En este ejemplo ambas sales son isomorfas, y pueden formar soluciones slidas dentro de un rango limitado de composicin; afortunadamente este tipo de oclusin no es frecuente dado que los iones sustituyentes deben ser similares en tamao y carga con los iones del retculo. Otro ejemplo de soluciones slidas de PbSO4 con BaSO4 y AgBr con AgI. Cuando ocurre este tipo de contaminacin no es posible purificar al precipitado; los procesos de digestin no mejoran la situacin ya que los iones contaminantes que pasan a la solucin durante la redisolucin, volvern a ocluirse en la reprecipitacin. La nica posibilidad de llevar a cabo una precipitacin con fines analticos es eliminando la sustancia contaminante del medio antes de efectuar la precipitacin; en el ejemplo anterior, el CrO4= , contaminante del SO4 =, deber ser reducido a Cr(III) antes de agregar la solucin de BaCl2. Oclusin de iones que se adsorbieron durante el crecimiento. Se trata de iones que no encajan en el retculo, es decir, no son capaces de sustituir a los iones normales del cristal; en consecuencia la oclusin de los mismos causa imperfecciones en el cristal formado. Como ya se describi, estas oclusiones ocurren generalmente con precipitados de naturaleza cristalina, donde el crecimiento lleva a la formacin de cristales relativamente grandes. Los iones extraos ocluidos pueden ser eliminados en gran medida durante la maduracin: en la redisolucin y reprecipitacin que ocurre durante la digestin de cristales imperfectos se forman cristales con menor superficie expuesta. Las impurezas inicialmente ocluidas retornan a la solucin y no vuelven a adsorberse pues la velocidad de crecimiento cristalino durante la digestin del precipitado es mucho ms lenta que en la formacin inicial del slido.
Las molculas polares y no polares son tipos de uniones covalentes en las que dos o ms tomos comparten electrones hasta tener ambos ocho en su ltimo orbital. Las polares se dan entre elementos con distinta electronegatividad o capacidad de atraer electrones, como ocurre por
ejemplo en el caso del H2O (agua). Las no polares se dan entre tomos del mismo elemento, ya que tienen igual electronegatividad. Un ejemplo de ellas es el O2 (oxgeno). H2O: la molcula del agua. Molcula polar es aquella que posee un extremo cargado positivamente y otro de manera negativa. Apolar, en cambio, es todo aquello que no posee polos. Molculas polares y no polares Decimos que una molcula es polar cuando uno de los extremos de los que est compuesta se encuentra cargado positivamente, y el otro cargado de forma negativa. El agua es un disolvente polar ya que solamente puede recibir molculaspolares. Entonces, para disolverse en agua el componente de la sustancia debe ser polar para poder realizarse el enlace. En cambio, apolar es todo aquello que no posee polos. En la fsica y la qumica se aplica a cierto tipo de molculas que no tienen cargas positivas ni negativas. Entonces, las molculas apolares se encuentran compuestas por tomos unidos por enlaces de tipo covalentes, es decir, enlaces donde la carga elctrica no es la suficiente como para realizar una transferencia de electrones. Decir que algo es apolar significa que carece de polos. En qumica, los trminos polar/apolar se aplican a las molculas, dependiendo del tipo de enlace que sus tomos presenten. Una molcula es polar siempre que uno de sus extremos est cargado positivamente y, el otro, posea carga negativa. Una molcula es apolar cuando las cargas positivas/negativas no existen. Molculas Polares: Agua H2O, Amonaco NH3, Fluoruro de Hidrgeno HF, Fosfina PH3, Cloformo CHCl3, Molculas No Polares Tetracloruro de Carbono CCl4, Dixido de Carbono CO2, Cloro Cl2, Trixido de Azufre SO3, Hidrgeno H2. Estimados Alumnos: Se enva la clase 12, all se adjunta los requisitos del Informe de Nivelacin Compuesta en el Extremo, para el da Lunes 02 de diciembre Examen de Conocimientos, Estudiar lo hecho en Clase Coordenadas, y Nivelacin. No se saldr a campo. SOLUCIONES GASEOSAS: POR SU CONCENTRACIN: SOLUCION SOBRE SATURADA: representan un tipo de disolucin inestable, ya que presenta disuelto ms soluto que el permitido para la temperatura dada. Para preparar este tipo de disoluciones se agrega soluto en exceso, a elevada temperatura y luego se enfra el sistema lentamente. Estas soluciones son inestables, ya que al aadir un cristal muy pequeo del soluto, el exceso existente precipita; de igual manera sucede con un cambio brusco de temperatura.
Soluciones gaseosas: Se producen cuando el soluto, gas, se disuelve en un solvente que puede ser gas, lquido o slido. Ejemplos: Gas en gas: aire, gas de alumbrado o gas industrial. Gas en lquido: bebidas gaseosas, amonaco en agua. Gas en slido: Oclusin del hidrgeno por metales. SOLUCIONES 1. SOLUCIN o Disoluciones.- Son mezclas homogneas que presentan una fase, formada por dos o ms sustancias que se ha logrado dispersar a escala de molculas o de iones. A una disolucin tambin se le llama dispersin, pero muy distintas a las suspensiones y los coloides que vendran hacer mezclas heterogneas. Suspensin: Partculas dispersas relativamente grandes su dimetro es mayor a 0,1 micra Ej. Cocoa en agua Coloides: Con partculas relativamente pequeas, su dimetro es mayor que 0,001micra y menor que 0,1 micra. Ej. Mayonesa, niebla Soluciones: Con partculas muy pequeas, su dimetro es menor a ,001 micra. Ej. Agua y sal. 2. PARTES DE UNA SOLUCION a) Soluto.- (Fase dispersa) Es la sustancia que se disuelve y se encuentra en menor proporcin. b) Solvente o disolvente.- (Fase dispersante) Es la sustancia que disuelve y se encuentra en mayor proporcin. 3. TIPOS DE SOLUCIONES Soluciones slidas: cuando el disolvente es un slido y pueden ser: Soluto solvente Slido en Slido ALEACIONES : F + C Lquido en Slido AMALGAMAS Gas en Slido OCLUSIN DEL H Es la propiedad que presenta el gas de poder distribuirse a travs de los poros de ciertos metales como el platino o el paladio es decir el slido absorbe el gas. Soluciones lquidas: donde el solvente es un lquido y pueden ser: Soluto solvente Slido en Lquido Agua dulce Lquido en Lquido Agua y alcohol Gas en Lquido Agua gaseosa Soluciones gaseosas: cuando el solvente es un gas y pueden ser: Soluto solvente Gas en Gas Aire *Liquido en Gas Neblina *Slido en Gas Humo, aerosoles Nota: Cuando en la solucin existe un solo solvente y un solo soluto entonces se denomina DISOLUCIN y el solvente es denominado DISOLVENTE .Las soluciones acuosas son aquellas donde el solvente es el agua. Publicado por Rella Vargas Snchez en 18:58 No hay comentarios: domingo, 14 de octubre de 2007 REACCIONES QUIMICAS
REACCIONES QUIMICAS Es un proceso en el cual unas sustancias, llamadas reactivos, se transforman en otras llamadas productos. Se representa mediante una ecuacin qumica. Hierro + Oxgeno ---- Oxido Ferroso o Oxido de Hierro ( II) REACTANTES PRODUCTO Un ejemplo de reaccin qumica es la formacin de xido de hierro producida al reaccionar el oxgeno del aire con el hierro. Evidencias de las reacciones qumicas. La evidencia de tales transformaciones es detectable, mediante la simple observacin de factores tales como: - Formacin de un gas, el cual se manifiesta por efervescencia o por su olor caracterstico. - Formacin de un slido insoluble o precipitado. - Generacin apreciable de energa en forma de luz y/o calor. - El cambio qumico puede ser exotrmico si hay desprendimiento de energa, o endotrmico si requiere de energa para llevarse a cabo.Cambios de color en el sistema CLASES DE REACCIONES QUMICAS Segn el tipo de transformacin que tenga lugar, se consideran los siguientes tipos de reaccin: 1. REACCION DE ADICION, COMBINACION O SNTESIS : Dos o ms sustancias generan una nueva sustancia,: A + B ------------- A B Ejemplo: La combinacin de hidrgeno con oxgeno para producir agua: 2H2 + O2 --------------- 2H2O 2. REACCION DE DESCOMPOSICION, DISOCIACION O ANALISIS : Un compuesto produce dos o mas sustancias. AB ---------------A + B Ejemplo: El carbonato de calcio se descompone por medio de calentamiento para producir oxido de calcio y dixido de carbono. CaCO3 ------------------CaO + CO2 3. REACCION DE DESPLAZAMIENTO SIMPLE O SUSTITUCIN : En estas reacciones, un elemento sustituye y libera a otro elemento presente en el compuesto. A + BC------------------AC + B Ejemplo: El bromo lquido, que desplaza al yodo en el yoduro de sodio para producir bromuro de sodio dejando al yodo libre. 2NaI + Br2-------------------2NaBr + I2 4. REACCION DE INTERCAMBIO O DOBLE DESPLAZAMIENTO, DOBLE SUSTITUCIN: Al reaccionar dos compuestos intercambian elementos y se producen dos nuevos compuestos. AB + CD----------------- AC + BD Ejemplo: La combinacin del cido clorhdrico con el hidrxido de sodio y el agua.(neutralizacin)
HCl + NaOH--------------NaCl + H2O 5. REACCIN DE OXIDACIN-REDUCCIN: Una reaccin de oxidacin-reduccin es una reaccin en la que hay transferencia de electrones desde la sustancia que se oxida a la que se reduce. Oxidacin es un proceso de prdida de electrones Reduccin es el proceso inverso de ganancia de electrones. De forma que: Cu + 2AgCl > CuCl2 + 2Ag Cu - 2 e > Cu2+ es una oxidacin Ag1+ + 2 e > Ag es una reduccin 6. REACCION COMPLETA O IRREVERSIBLE: Tiene un solo sentido y solo origina productos HCl + NaOH NaCl + H2O 7. REACCION INCOMPLETA O RREVERSIBLE: Tiene un solo sentido y solo origina productos. CH3COOH + CH3OH CH3COOCH3 + H2O 8. REACCION DE COMBUSTION COMPLETA: El combustible se combina con el comburentes generando dixido de carbono y agua. C3H8 + O2 CO2 + H2O 9. REACCION DE COMBUSTION INCOMPLETA Ten esta combustin se genera monxido de carbono y agua u holln y agua. CH4 + O2 CO + H2O C5H12 + O2 C + H2O 10.REACCION EXOTERMICA : En estas reacciones se libera calor. C3H8 + O2 CO2 + H2O + calor N2 + 3H2 NH3 + calor 11. REACCION ENDOTERMICA: En estas reacciones se absorbe calor(Q). CaCO3 + calor CaO + CO2 12 REACCIN DE NEUTRALIZACIN La reaccin de un cido con una base se denomina reaccin de neutralizacin, se origina unas sal y agua. Por ejemplo: 2HCl + Ca(OH)2 ----- CaCl2 + 2H2O 13. REACION FOTOQUIMICA El factor energtico es la luz, que da la energa necesaria para que la reaccin se lleve a cabo. CO2 + H2O luz -- - C12H22O11 Nota: CATALIZADOR: Es una sustancia que vara la velocidad de reaccin. Algunas reacciones necesitan de catalizadores para incrementar su velocidad de reaccin, o de los inhibidores qumicos para lograr lo contrario. (Estos no se consumen en la reaccin).
También podría gustarte
- Sustitución Nucleofílica AromáticaDocumento5 páginasSustitución Nucleofílica AromáticaSaulPizarrosoAlvarezAún no hay calificaciones
- Hiperconjugacion DefinicionDocumento2 páginasHiperconjugacion DefinicionDiego Guayacan100% (1)
- Actividades: Destilación Por Arrastre de Vapor de Agua. Separación Del Aceite Esencial de Canela e Identificación Del CinamaldehidoDocumento12 páginasActividades: Destilación Por Arrastre de Vapor de Agua. Separación Del Aceite Esencial de Canela e Identificación Del CinamaldehidoAlan YañezAún no hay calificaciones
- Practica 2. Obtencion de Bromuro de N-ButiloDocumento4 páginasPractica 2. Obtencion de Bromuro de N-ButiloKai100% (1)
- Eaboracion de Fluidos de CorteDocumento78 páginasEaboracion de Fluidos de CorteIngDiaz730% (1)
- Paneles Sip TesisDocumento107 páginasPaneles Sip Tesisana cifuentes100% (3)
- Tema 7 Contaminación de Precipitados (A-2018) PDFDocumento19 páginasTema 7 Contaminación de Precipitados (A-2018) PDFcesar de arco navaAún no hay calificaciones
- Coprecipitación Inclusión OclusiónDocumento2 páginasCoprecipitación Inclusión OclusiónEric FernandezAún no hay calificaciones
- Formacion y Propiedades de PrecipitadosDocumento11 páginasFormacion y Propiedades de PrecipitadosSilvy CastilloAún no hay calificaciones
- Informe 3 REACCIÓN DE HALUROS DE ALQUILODocumento7 páginasInforme 3 REACCIÓN DE HALUROS DE ALQUILOLinda Lucia Insignares OteroAún no hay calificaciones
- Aplicacion Titulaciones Redox PDFDocumento15 páginasAplicacion Titulaciones Redox PDFEsteban MalamboAún no hay calificaciones
- Destilacion CinamaldehídoDocumento16 páginasDestilacion CinamaldehídoFrancisco Perea RsdzAún no hay calificaciones
- Informe 1 Nerolina FinalDocumento11 páginasInforme 1 Nerolina FinalMishell Benavides100% (2)
- Titulación de Ácido MuriáticoDocumento14 páginasTitulación de Ácido MuriáticoHarrietAún no hay calificaciones
- Ley Periódica (Informe)Documento10 páginasLey Periódica (Informe)Hiroaki DarkAún no hay calificaciones
- INFORME-8 InorganicaDocumento8 páginasINFORME-8 InorganicaJhonatan MoreanoAún no hay calificaciones
- Práctica 1. Isomería Cis - TransDocumento8 páginasPráctica 1. Isomería Cis - TransAndres Ordoñez100% (2)
- Influencia de Un Soluto en El Punto de CongelaciónDocumento2 páginasInfluencia de Un Soluto en El Punto de CongelaciónEnriqueMuñiz100% (1)
- DERIVADOS HALOGENADOS (Obtencion de Cloruro de CiclohexiloDocumento12 páginasDERIVADOS HALOGENADOS (Obtencion de Cloruro de Ciclohexilo.:("*"BLacK BuLLeT"*"):.100% (3)
- Metodo de Rast 2Documento6 páginasMetodo de Rast 2Mendoza EiraAún no hay calificaciones
- Estudio Cualitativo Del Comportamiento Químico de Algunas Sustancias en Disolución Acuosa. Facultad de Estudios Superiores CuautilánDocumento15 páginasEstudio Cualitativo Del Comportamiento Químico de Algunas Sustancias en Disolución Acuosa. Facultad de Estudios Superiores CuautilánBrenda Karen0% (2)
- Práctica 3. OBTENCIÓN DEL BROMURO DE n-BUTILODocumento6 páginasPráctica 3. OBTENCIÓN DEL BROMURO DE n-BUTILOLeidy Laura HRAún no hay calificaciones
- Laboratorio de Química Inorgánica II. Síntesis de Compuestos de Coordinación.Documento21 páginasLaboratorio de Química Inorgánica II. Síntesis de Compuestos de Coordinación.Ana CarolinaAún no hay calificaciones
- Conceptos de GravimetriaDocumento11 páginasConceptos de GravimetriatimmywhiteAún no hay calificaciones
- Aplicaciones de Los Compuestos de CoordinaciónDocumento23 páginasAplicaciones de Los Compuestos de CoordinaciónRoss Casas100% (3)
- DEBER 4 Analitica Jaime PérezDocumento4 páginasDEBER 4 Analitica Jaime Pérezjaime perezAún no hay calificaciones
- Obtención y Cristalización de AcetanilidaDocumento5 páginasObtención y Cristalización de AcetanilidaESMERALDA PALACIO HERNANDEZAún no hay calificaciones
- PRÁCTICA 9 Isomería I.Q. Fes CuautitlanDocumento5 páginasPRÁCTICA 9 Isomería I.Q. Fes CuautitlanJose Emmanuel ChemaAún no hay calificaciones
- Cuestionario Experiencia 3Documento3 páginasCuestionario Experiencia 3Yo No MasAún no hay calificaciones
- Informe 6 Isomeros IonicoDocumento8 páginasInforme 6 Isomeros Ionicosamir velezAún no hay calificaciones
- Cloruro de TerbutiloDocumento6 páginasCloruro de Terbutiloyocepunkrocker100% (1)
- Cetenas de Quimicca OrganicaDocumento6 páginasCetenas de Quimicca OrganicaWilber Lopez AvilaAún no hay calificaciones
- Práctica # 5 Síntesis de Ácido SulfanílicoDocumento5 páginasPráctica # 5 Síntesis de Ácido SulfanílicoLaura RamirezAún no hay calificaciones
- Informe 5, Propiedades de Los Aldehidos y CetonasDocumento8 páginasInforme 5, Propiedades de Los Aldehidos y CetonasDani SantoyoAún no hay calificaciones
- CARBANIONESDocumento48 páginasCARBANIONESValeria Dorador100% (1)
- Introduccion Al Trabajo de Laboratorio RivasDocumento79 páginasIntroduccion Al Trabajo de Laboratorio RivasLili CastroAún no hay calificaciones
- Tarea 1 - Analisis Quimico, Paula Meneses DDocumento3 páginasTarea 1 - Analisis Quimico, Paula Meneses DPaula Meneses0% (1)
- Práctica 8 Acoplamiento de Sales de DiazonioDocumento8 páginasPráctica 8 Acoplamiento de Sales de DiazonioErnesto ZavalaAún no hay calificaciones
- Practica 4 CristalizacionDocumento12 páginasPractica 4 CristalizacionAlejandro Martínez100% (1)
- Calibración de Un Calorímetro Por El Método de Dilución de H2SO4Documento14 páginasCalibración de Un Calorímetro Por El Método de Dilución de H2SO4Andrea MelendezAún no hay calificaciones
- HidroxiquinolinaDocumento2 páginasHidroxiquinolinaenac07Aún no hay calificaciones
- Síntesis de WilliamsonDocumento2 páginasSíntesis de WilliamsonJosé Encarnación Espinosa100% (1)
- HinsbergDocumento1 páginaHinsbergPRISCILA YAMILET JIMENEZ MANZOAún no hay calificaciones
- Palmer Capitulo VDocumento10 páginasPalmer Capitulo VCesar Fernando Sarrin CepedaAún no hay calificaciones
- Práctica L-Reacciones de AdiciónDocumento14 páginasPráctica L-Reacciones de AdiciónAndy AldamaAún no hay calificaciones
- Practica 6 Peso Molecular Por Metodo de RastDocumento6 páginasPractica 6 Peso Molecular Por Metodo de RastJavier RG100% (2)
- Práctica 2 Sintesis de DibenzalacetonaDocumento3 páginasPráctica 2 Sintesis de DibenzalacetonaSaul RuizAún no hay calificaciones
- Marco Teórico Ii Peso MolecularDocumento4 páginasMarco Teórico Ii Peso MolecularPalma AlexisAún no hay calificaciones
- Analisis Cualitativo Marcha de CationesDocumento10 páginasAnalisis Cualitativo Marcha de CationesAna C. Ramirez0% (1)
- Sintesis de WilliamsonDocumento2 páginasSintesis de WilliamsonNatalia MerchanAún no hay calificaciones
- Criterios de EspontaneidadDocumento3 páginasCriterios de EspontaneidadjosuediazAún no hay calificaciones
- VoltamperometríaDocumento9 páginasVoltamperometríaLuis RieraAún no hay calificaciones
- Sintesis 1-Clorobutano Reaccion - SN2Documento8 páginasSintesis 1-Clorobutano Reaccion - SN2Oscar G. Marambio100% (1)
- Cuestionario 1 FQIIDocumento4 páginasCuestionario 1 FQIIBryan BautistaAún no hay calificaciones
- Reporte Cis-TransDocumento8 páginasReporte Cis-TransJose Emmanuel ChemaAún no hay calificaciones
- Practica 10 - Yodimetria Indirecta (Analitica II)Documento7 páginasPractica 10 - Yodimetria Indirecta (Analitica II)SEBASTIAN OSPINA PELAEZAún no hay calificaciones
- Síntesis de Ácido AdípicoDocumento3 páginasSíntesis de Ácido AdípicoGänon Abraham0% (1)
- Guia 06 Estequiometria en Solucion QUI080Documento4 páginasGuia 06 Estequiometria en Solucion QUI080Alan John AndradesAún no hay calificaciones
- Marcha AnalíticaDocumento6 páginasMarcha AnalíticaRodrigo Cori Córdova100% (1)
- Propiedasdes Coligativas, Coloides y EmulsionesDocumento5 páginasPropiedasdes Coligativas, Coloides y EmulsionesPedro SilverioAún no hay calificaciones
- Preguntas de InformeDocumento4 páginasPreguntas de InformeCharlie Santos Cabarcas75% (4)
- DisolucionesDocumento16 páginasDisolucionesdaniel ayalaAún no hay calificaciones
- Actividades Complementarias de MatematicasDocumento2 páginasActividades Complementarias de MatematicasEstrella MedinaAún no hay calificaciones
- La Libertad Octubre 2015Documento23 páginasLa Libertad Octubre 2015Estrella MedinaAún no hay calificaciones
- La Libertad Octubre 2015Documento23 páginasLa Libertad Octubre 2015Estrella MedinaAún no hay calificaciones
- 1ver DIA Tibillo - CompressedDocumento408 páginas1ver DIA Tibillo - CompressedEstrella MedinaAún no hay calificaciones
- Seción Hoy Martes 06 de Abril de MatematicaDocumento3 páginasSeción Hoy Martes 06 de Abril de MatematicaEstrella MedinaAún no hay calificaciones
- Sesión 1 S1Documento3 páginasSesión 1 S1Estrella MedinaAún no hay calificaciones
- ACTIVIDAD 4lo Que Soy Capaz de HacerDocumento3 páginasACTIVIDAD 4lo Que Soy Capaz de HacerEstrella MedinaAún no hay calificaciones
- Planeamiento EstratégicoDocumento36 páginasPlaneamiento EstratégicoEstrella MedinaAún no hay calificaciones
- Ficha de Actividades Matemática Miércoles 05 de Abril...Documento4 páginasFicha de Actividades Matemática Miércoles 05 de Abril...Estrella MedinaAún no hay calificaciones
- Ley 27446 Sneia SeiaDocumento64 páginasLey 27446 Sneia SeiaJesus CoralAún no hay calificaciones
- El Ave Mas Grande Del MundoDocumento13 páginasEl Ave Mas Grande Del MundoEstrella MedinaAún no hay calificaciones
- El VIRUS CON CORONADocumento5 páginasEl VIRUS CON CORONAEstrella MedinaAún no hay calificaciones
- Manual de Procesos en Fotografías Aéreas EnviDocumento14 páginasManual de Procesos en Fotografías Aéreas EnviWaldo PintoAún no hay calificaciones
- Turismo Como Estrategia de Conservación - SERNANPDocumento35 páginasTurismo Como Estrategia de Conservación - SERNANPEstrella MedinaAún no hay calificaciones
- Diapositivas de InvestigaciónDocumento9 páginasDiapositivas de InvestigaciónEstrella MedinaAún no hay calificaciones
- Zoológico de HuancayoDocumento14 páginasZoológico de HuancayoEstrella MedinaAún no hay calificaciones
- MuseoDocumento7 páginasMuseoEstrella MedinaAún no hay calificaciones
- Determinacion de La Humedad Del SueloDocumento21 páginasDeterminacion de La Humedad Del SueloEstrella MedinaAún no hay calificaciones
- Terminos AmbientalesDocumento49 páginasTerminos AmbientalespexunitedAún no hay calificaciones
- Diapositivas de InvestigaciónDocumento9 páginasDiapositivas de InvestigaciónEstrella MedinaAún no hay calificaciones
- Alzheimer - Historias ClinicasDocumento6 páginasAlzheimer - Historias ClinicasEstrella MedinaAún no hay calificaciones
- Alzheimer PDFDocumento10 páginasAlzheimer PDFlithium2203Aún no hay calificaciones
- Clima Nuestras Manos RESUMENDocumento14 páginasClima Nuestras Manos RESUMENJuVe UbAún no hay calificaciones
- Sabana de PalmerasDocumento9 páginasSabana de PalmerasEstrella Medina0% (1)
- Oxidacion - SueloDocumento5 páginasOxidacion - SueloEstrella Medina100% (1)
- Porosidad Total Del Suelo y Espacio AéreoDocumento25 páginasPorosidad Total Del Suelo y Espacio AéreoEstrella Medina50% (2)
- Cultivo HidroponicoDocumento95 páginasCultivo HidroponicoEstrella MedinaAún no hay calificaciones
- Combinaciones BandasDocumento5 páginasCombinaciones BandasJhon Javier67% (3)
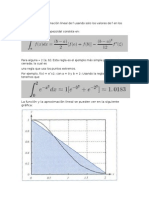
- Regla TrapezoidalDocumento3 páginasRegla TrapezoidalEstrella MedinaAún no hay calificaciones
- Canal, Vertedero, TunelDocumento50 páginasCanal, Vertedero, TunelJhon Anderzo Diaz Garcia100% (1)
- ContratoDocumento2 páginasContratojcmt2kAún no hay calificaciones
- 02-Tratamiento Termico Patentado Camesa PDFDocumento18 páginas02-Tratamiento Termico Patentado Camesa PDFJuan CastroAún no hay calificaciones
- Informe de Practica de Campo Emapa San Martin y Fuente Rio ShilcayoDocumento7 páginasInforme de Practica de Campo Emapa San Martin y Fuente Rio ShilcayoAnonymous SHZtFTzOAún no hay calificaciones
- Arquitectura Bioclimatica AmericaDocumento28 páginasArquitectura Bioclimatica AmericaJunior BarrenoAún no hay calificaciones
- Examen FluidosDocumento21 páginasExamen FluidosKristhiam Alendez QuispitupaAún no hay calificaciones
- Convertidores CC-CCDocumento4 páginasConvertidores CC-CCAlexit EmoxaAún no hay calificaciones
- Proyecto Fundamentos de Diseño DigitalDocumento4 páginasProyecto Fundamentos de Diseño DigitalLenaAún no hay calificaciones
- Repertorio Certificados Profesionalidad-310-319Documento10 páginasRepertorio Certificados Profesionalidad-310-319Jose Alberto Blanco FernandezAún no hay calificaciones
- Propiedades de Los CódigosDocumento15 páginasPropiedades de Los CódigosJuan FernandoAún no hay calificaciones
- Direcciones y Ang. Horiz.Documento10 páginasDirecciones y Ang. Horiz.LUIS CARLOS BURBANO CASTILLOAún no hay calificaciones
- Sistema de Referenciacion de Documentos en Las AAPP-V8Documento17 páginasSistema de Referenciacion de Documentos en Las AAPP-V8juancampo2000Aún no hay calificaciones
- PR-HSE-PRO.07.09 Inspeccion de ArnesDocumento3 páginasPR-HSE-PRO.07.09 Inspeccion de Arnesnelida ramos floresAún no hay calificaciones
- Materiales y Herramientas Utilizados en ConstruccionDocumento5 páginasMateriales y Herramientas Utilizados en ConstruccionWilliams Anderson CG100% (1)
- Detección de Prácticas No EcoeficientesDocumento3 páginasDetección de Prácticas No EcoeficientesDelia HernandezAún no hay calificaciones
- Compactacion de Suelos .... - 1Documento17 páginasCompactacion de Suelos .... - 1Dulce maria feria navarroAún no hay calificaciones
- Material de Apoyo SSODocumento7 páginasMaterial de Apoyo SSOEdder PereiraAún no hay calificaciones
- Sonelco Sonorizacion Ambiental Al Megafonia Equipos ProfesionalesDocumento51 páginasSonelco Sonorizacion Ambiental Al Megafonia Equipos ProfesionalesEnrique Iriarte MarquesAún no hay calificaciones
- Guia Ent ForzadaDocumento49 páginasGuia Ent Forzadasergio villarroelAún no hay calificaciones
- Parámetros Cromatográficos ExpoDocumento30 páginasParámetros Cromatográficos ExpoericcckkAún no hay calificaciones
- GranulometriaDocumento4 páginasGranulometriaWilliam Quispe QuispeAún no hay calificaciones
- MEMORIA DE I.E Victor Raul Haya de La TorreDocumento32 páginasMEMORIA DE I.E Victor Raul Haya de La TorrejuliorihuelaAún no hay calificaciones
- Estudio Impacto Ambiental Enmallado Estadio HUANCAYREDocumento24 páginasEstudio Impacto Ambiental Enmallado Estadio HUANCAYREDionicio de la CruzAún no hay calificaciones
- Conducción de Calor Radial A Través de Un Cilindro HuecoDocumento7 páginasConducción de Calor Radial A Través de Un Cilindro HuecoJhonny QuintanaAún no hay calificaciones
- Yacimientos CordilleranosDocumento16 páginasYacimientos CordilleranosD'Marlon MnAún no hay calificaciones
- Instalación y Configuración IISDocumento8 páginasInstalación y Configuración IISSofia Kari Vargas KamiyaAún no hay calificaciones
- Indicador de Presion Diferencial Es BOLLFILTERDocumento2 páginasIndicador de Presion Diferencial Es BOLLFILTERantonio sanchezAún no hay calificaciones
- CapEDtulo11 Tensor de CadenaDocumento4 páginasCapEDtulo11 Tensor de CadenaAndrés Amorós SánchezAún no hay calificaciones