Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practicas Electroquimica y Corrosion
Practicas Electroquimica y Corrosion
Cargado por
Letizia Velazquez AvelarDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practicas Electroquimica y Corrosion
Practicas Electroquimica y Corrosion
Cargado por
Letizia Velazquez AvelarCopyright:
Formatos disponibles
PRCTICAS DE LABORATORIO
DE ELECTROQUMICA Y CORROSIN
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #1 Manejo del potenciostato
Objetivo
Conocer los fundamentos del manejo del potenciostato y emplearlo para realizar
una reaccin electroqumica de xido-reduccin del in bromuro.
Teora
En el estudio de las reacciones electroqumicas es preciso disponer de un control
total sobre las dos principales variables que afectan los fenmenos electroqumicos: el
potencial y la corriente. El potenciostato es el aparato que nos permitir manipular ambas
variables, por lo que es un equipo bsico e insustituible en un laboratorio de
electroqumica.
Una celda de tres electrodos permite tener control sobre la corriente que circula a
travs del electrodo de trabajo y tambin sobre el potencial que ste adquiere comparado
con una referencia. Dicha referencia es, precisamente, uno de los tres electrodos, que se
elige de acuerdo a ciertas caractersticas que se discuten con ms detalle en la siguiente
prctica. Cuando circula una corriente por un electrodo, el potencial del mismo no se
mantiene constante, sino que se modifica debido a las reacciones qumicas que ocurren en
l (sobrepotencial de activacin) y a los cambios de concentracin que ocurren en su
entorno inmediato (sobrepotencial por concentracin). Decimos entonces que el electrodo
se polariza.
Es evidente que el uso de un electrodo como referencia est limitado por el
fenmeno de polarizacin. La referencia ideal sera un electrodo no polarizable, cuyo
potencial permaneciera constante para cualquier valor de la corriente. Sin embargo, esto
difcilmente puede conseguirse en la realidad. La solucin se obtiene utilizando
electrodos muy poco polarizables, tales como los de calomel, plata/cloruro de plata,
platino, etc., y acoplndolos a los circuitos elctricos del potenciostato. Gracias a la
construccin de este aparato es posible hacer circular corrientes muy pequeas por el
electrodo de referencia, de modo que no ocurre polarizacin apreciable. Dependiendo del
modelo de potenciostato que se est utilizando es posible operar simultneamente con dos
electrodos de trabajo, aplicar un voltaje o una corriente fijas al electrodo, aplicar voltajes
variables en distintas secuencias y muchas otras posibilidades que dependen de las
prestaciones del equipo.
El procedimiento de la prctica se basa en los controles del bipotenciostato modelo
AFCBP1 de Pine Instrument Company, pero puede extrapolarse sin dificultad a otras
marcas y modelos de potenciostatos.
Prcticas de laboratorio de Electroqumica y Corrosin
Reactivos
Solucin de KBr 0.1 M
Dos electrodos de platino
Un electrodo de referencia de calomel (SCE)
Un vaso de precipitados
Caimanes y cables varios de conexin
Procedimiento
En un vaso de precipitados coloque aproximadamente 40 ml de solucin de
bromuro de potasio 0.1 M, y monte una celda de tres electrodos empleando como
referencia al electrodo de calomel, y como electrodos de trabajo y auxiliar a los dos
electrodos de platino. Verifique las conexiones cuidadosamente y asegrese que los
electrodos no se tocan entre s.
Conecte el electrodo de trabajo a la terminal marcada como K1 en el potenciostato.
En la terminal marcada CE (counter) conecte el electrodo auxiliar, y en la terminal REF
conecte el electrodo de referencia de calomel. Encienda el aparato y asegrese que se
encuentra en el modo DUMMY.
Los controles del potenciostato deben ajustarse como sigue:
1) Apague el generador de barrido, colocando el botn marcado con SWEEP VOLTAGE
en la posicin "off" dentro de la seccin del panel de control marcada con K1
ELECTRODE.
2) Justo arriba del control SWEEP VOLTAGE se encuentra el botn de eleccin del
modo de trabajo (potenciosttico o galvanosttico). Elija el modo potencistatico.
3) Coloque el convertidor de corriente del electrodo K1 en la posicin de 1 mA / V o en
10 mA / V para evitar sobrecargar el aparato.
El potenciostato se encuentra listo para aplicar un voltaje al electrodo de trabajo. En
una tabla de potenciales de electrodo, obtenga el valor del potencial reversible para el par
bromo-bromuro contra calomel, y entonces aplique al electrodo de trabajo un potencial
que sea ms positivo que este valor. Se ha encontrado que se obtienen buenos resultados
aplicando un potencial de +2 V al electrodo. Seleccione dicho potencial en el control
OFFSET VOLTAGE y oprima el botn que indica potencial positivo.
Para iniciar el experimento, desactive el modo DUMMY colocando al potenciostato
en NORMAL. Observe cuidadosamente lo que ocurre en los electrodos auxiliar y de
trabajo. Monitoree la corriente y el potencial del electrodo colocando la perilla del
display del aparato en las posiciones E1 e I1 respectivamente. Use un voltmetro para
medir el potencial entre el electrodo de trabajo y el auxiliar. Coloque el aparato en modo
DUMMY, invierta el signo del potencial y observe lo que sucede. Registre sus
observaciones por escrito.
Prcticas de laboratorio de Electroqumica y Corrosin
CE
REF
SCE
K1
Pt
Potenciostato
Pt
Solucin de
Celda de tres
KBr
electrodos
Clculos y reporte
Investigue el potencial estndar reversible para la reacin involucrada. Qu se
observa en el electrodo de trabajo ? Y en el electrodo auxiliar ? Justifique sus
afirmaciones con las reacciones involucradas en cada electrodo.
Reporte el potencial que existe entre los dos electrodos de platino (auxiliar y de
trabajo). Por qu es distinto este valor al potencial que se fij en el aparato ?
Comente la razn por la cual se eligieron electrodos de platino en esta prctica.
Qu sucedera si se hubiera empleado un electrodo de otro material, por ejemplo hierro o
cobre ?
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #2 Electrodos de referencia
Objetivo
Fabricar un electrodo de referencia de plata/cloruro de plata.
Teora
Un electrodo de referencia es una media celda electroltica que se emplea como
estndar para la medicin y comparacin del potencial de otras medias celdas. Para
satisfacer este uso, los electrodos de referencia deben cumplir con ciertos requisitos:
1)
Ser reproducibles sin que su preparacin o ensamblaje sean complicados
E
2)
Tener un coeficiente de temperatura pequeo
T
3)
Ser reversibles an a corrientes relativamente grandes
4)
Consistencia con el paso del tiempo (envejecimiento)
5)
De preferencia, poder emplearse con puentes salinos de KCl
Los electrodos que mejor satisfacen estos requisitos son los que estn formados por
un metal y una sal insoluble del mismo. En la prctica, los electrodos de referencia que se
usan con ms frecuencia son el de calomel y el de plata-cloruro de plata, en el que un
alambre de plata se recubre con el cloruro del mismo metal, y se sumerge en una solucin
de cloruro de potasio de concentracin conocida. El potencial del electrodo depende de la
concentracin de iones cloruro, como puede comprobarse con la ecuacin de Nernst para
la media celda correspondiente. Algunas de sus caractersticas son:1
Potencial reversible estndar:
0.2222 V vs. NHE
Potencial en solucin de KCl saturado a 25C:
0.1989 V vs. NHE
Coeficiente de temperatura:
en solucin 4 M de KCl: +0.09 mV/K
en solucin 0.001 M de KCl: +0.75 mV/K
No es sensible a la iluminacin
Se ha podido emplear hasta 125C
La solucin de la unin lquida debe estar saturada con AgCl, para reducir la
formacin de iones complejos solubles tales como el tricloroargntico [AgCl3] -2.
Aparatos necesarios
Potenciostato
Un calibrador o pie de rey (vernier)
Cables varios de conexin y caimanes
Vasos de precipitados
Prcticas de laboratorio de Electroqumica y Corrosin
Un tubo de unin lquida, preparado como se indica ms adelante y que servir como
soporte final del electrodo.
Reactivos
Solucin de amonaco concentrado
Solucin de cido actico 50 % volumen
Solucin de HCl 0.1 M
Solucin saturada de KCl
Alambre de plata
Procedimiento2
Prepare un tubo de unin lquida, que constituir el cuerpo del electrodo. El tubo
puede ser de plstico o vidrio, y el material que constituir la unin lquida debe ser
permeable a los iones, sin permitir que la solucin del electrodo entre en contacto con el
exterior. En el laboratorio hemos usado con xito materiales como piedra pmez, barro o
celofn, sellando el tubo con resina epxica.
Limpie cuidadosamente un trozo de alambre de plata con la solucin de hidrxido
de amonio concentrado, enjuague y sumrjalo en cido actico al 50 % hasta que la plata
tenga un color casi blanco (usualmente cerca de un minuto). Enjuague con agua destilada
pero no seque.
Mida el dimetro del alambre con el calibrador, calcule el rea superficial que
estar sumergida en la solucin de electrlisis y catodcelo contra un nodo de plata a una
densidad de corriente constante de 0.5 a 10 mA / cm2 (lo mejor es cerca de 5 mA / cm2 )
en HCl 0.1 M durante 30 segundos. Aleje las burbujas del alambre.
Anodice el alambre por 10-15 minutos con la misma densidad de corriente, en la
misma solucin. Enjuagar.
El electrodo se prepara introduciendo el alambre en el tubo de unin lquida lleno
con solucin de KCl concentrada y saturada con AgCl (basta con aadir un cristalito de
nitrato de plata). El electrodo puede tardar varios minutos, a veces horas, en obtener un
potencial estable. El envejecimiento se puede acelerar introduciendo los electrodos en un
bao Mara a 60 C durante una hora.
Reporte
Investigue el potencial estndar del electrodo de plata/cloruro de plata, y comprelo
con el que obtiene experimentalmente con su electrodo. Reporte las reacciones que
ocurren en el electrodo de trabajo y en el auxiliar, y calcule el espesor estimado del
depsito de cloruro de plata obtenido. Notifique tambin el tipo de unin lquida que
utiliz, el material de la membrana permeable y cualquier otra observacin que considere
pertinente. No tire sus electrodos, pues los necesitar en la siguiente prctica.
2 Parte del procedimiento de esta prctica se basa en el trabajo de Schulz.
Prcticas de laboratorio de Electroqumica y Corrosin
cable de conexin
tapn de
hule
tubo de
vidrio
alambre de
plata en
solucin de
plastilina
KCl
epxica
membrana
permeable
Tubo de unin lquida
Electrodo terminado
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #3 Puentes salinos
Objetivo
Construccin de puentes salinos y evaluacin experimental de sus potenciales de
unin lquida, cuando se utilizan como conectores inicos entre dos compartimientos de
una celda electroqumica.
Teora
El contacto entre dos soluciones de concentraciones diferentes, de iones diferentes,
o de ambos tipos, conduce a un potencial de unin provocado por la transferencia de
iones con distinta carga a uno y otro lado de la frontera interfacial. Las uniones lquidas
fueron clasificadas por Lingane en tres diferentes tipos:
1)
Dos soluciones del mismo electrolito, a diferente concentracin.
2)
Dos soluciones de la misma concentracin con diferente electrolito teniendo un in
comn.
3)
Dos soluciones que no satisfacen alguno de los criterios anteriores.
Para reducir la aparicin de los potenciales de unin lquida se acostumbra
comunicar la solucin andica y catdica por medio de un puente salino, que es un
sistema formado por una solucin de iones que tienen aproximadamente la misma
movilidad, por lo que reciben el nombre de soluciones equitransferentes. Algunos
ejemplos de soluciones equitransferentes son:3
KCl 1.8 M + KNO3 1.8 M
KCl 3 M + KNO3 1 M
RbCl 2 M
KNO3 1.7 M + KCl 0.64 M + NaCl 0.06 M + 1ml/lt de formaldehdo
Se puede usar tambin KCl saturado (4.16 M a 25C), 3.8 M o 3.5 M. La solucin
saturada tiene el inconveniente de la formacin de cristales de KCl y su acumulacin
alrededor de la unin lquida, lo que la hace poco reproducible. Los coloides y
suspensiones afectan el potencial de unin lquida cuando se realizan mediciones de pH y
en electrodos selectivos de iones, por lo que deben tomarse precauciones especiales
cuando estn presentes.4
3 Citadas por Schulz, pg. 10.
4 Ibdem.
Prcticas de laboratorio de Electroqumica y Corrosin
Reactivos y aparatos necesarios
Solucin saturada de KCl
Solucin de ZnSO4 0.1 M en H2SO4 0.5 M
Solucin de CuSO4 0.1 M en H2SO 4 0.5 M
Solucin de KCl 0.1 M
Solucin de HCl 0.1 M
Solucin de NaCl 0.1 M
Agar en polvo
Lmina de cobre
Lmina de zinc
Un recipiente para unin lquida, construido como se indica ms adelante
Medidor de pH o voltmetro de alta impedancia, plato caliente con agitacin, mechero
Bunsen, termmetro, tubo de vidrio de 5 mm de dimetro (o mayor) y lima para cortarlo,
dos electrodos de referencia de Ag/AgCl preparados en la prctica anterior, vasos de
precipitado, caimanes y cables varios de conexin, un trozo de papel filtro.
Procedimiento
Prepare un puente salino de KCl aadiendo 1.0 g de agar a 50 ml de solucin
saturada de KCl preparada con anticipacin. Agite continuamente mientras calienta la
solucin hasta que alcance una temperatura de por lo menos 85 C y se torne clara. La
solucin se vaca en un tubo de vidrio en forma de "U" y se deja solidificar formando un
gel. Para evitar la formacin de burbujas, esta operacin se aconseja realizarla calentando
el tubo en bao Mara y sacudindolo ligeramente. El puente salino se almacena en
solucin saturada de KCl o en refrigeracin para evitar su contaminacin por
microorganismos.
Una vez preparado el puente salino, monte dos compartimientos de una celda
electroqumica, colocando en uno de ellos una laminilla de zinc inmersa en la solucin de
cloruro de zinc y en el otro una laminilla de cobre en solucin de sulfato de cobre.
Conecte la laminilla de zinc a la terminal negativa de un voltmetro o al electrodo de
referencia del medidor de pH, y la laminilla de cobre a la terminal positiva del voltmetro
o a la terminal del electrodo de vidrio del medidor de pH.
Mida el potencial de la celda utilizando el medidor de pH o el voltmetro y el
puente salino de agar. Reemplace el puente salino de agar con otro hecho de papel filtro
humedecido en solucin de NaCl y mida el voltaje nuevamente. Finalmente, reemplace el
papel filtro con dos dedos de la misma mano y mida el potencial otra vez.
Construya un recipiente de unin lquida, comunicando entre s dos recipientes
pequeos con una membrana permeable al paso de los iones (cermica, vidrio
sinterizado, celofn, etc.). Coloque en un lado de la unin lquida a la solucin de HCl 0.1
M y del otro lado a la solucin de KCl 0.1 M. Introduzca un electrodo de referencia en
cada lado de la unin lquida y mida el potencial de unin con el voltmetro.
Prcticas de laboratorio de Electroqumica y Corrosin
Lmina de
Cu
Lmina de
Puente salino
Zn
Membrana porosa
Recipiente de unin lquida
Clculos y reporte
Investigue las medias reacciones de la celda electroqumica y evale el potencial
terico con la ecuacin de Nernst.
Haga un dibujo completo de la celda sealando el movimiento de los iones en las
soluciones y en el puente salino de agar.
Evale el potencial de la unin lquida tericamente utilizando la ecuacin de
Lewis-Sargent y comprelo con el obtenido experimentalmente.
Tabule todos los potenciales medidos experimentalmente y los calculados
tericamente.
Justifique las diferencias en los potenciales observados cuando son reemplazados
los diferentes puentes salinos.
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #4 Potenciales de electrodo
Objetivo
Construir un electrodo normal de hidrgeno y utilizarlo como referencia para
establecer una escala de potenciales de media celda.
Teora
La reaccin qumica global que tiene lugar en una celda electroqumica puede
considerarse como la suma algebraica de dos medias reacciones, una de oxidacin y otra
de reduccin. Cada media reaccin corresponde a la diferencia de potencial interfacial en
el electrodo correspondiente.
Dado que no es posible determinar el potencial absoluto de un solo electrodo, pero
s es posible determinar la diferencia de potencial entre dos de ellos, una forma
conveniente de solucionar este conflicto es seleccionar un electrodo que funcione como
referencia arbitraria para establecer una escala de potenciales de electrodo. Por acuerdo
internacional, el electrodo estndar de hidrgeno (NHE, Normal Hydrogen Electrode) se
usa mundialmente como electrodo primario de referencia.
El electrodo de hidrgeno comn est constituido de un trozo de hoja o alambre de
Pt que tenga una superficie grande (generalmente se obtiene depositando
electrolticamente en la superficie una capa delgada de platino finamente dividido, es
decir, negro de platino) que se sumerge en una solucin acuosa con actividad unitaria de
iones de H+ y saturada con hidrgeno a una presin parcial de 1 atm. 5 A este electrodo
se le asigna un potencial de 0.000 V a cualquier temperatura. A fin de ser consistentes
con respecto al signo de la diferencia de potencial, el electrodo de hidrgeno se toma
como nodo, que es el signo que tendra si la reaccin que se registra en el otro electrodo
fuera una reduccin.
Aparatos necesarios
Electrodos de platino (si se va a platinar, ver ms adelante)
Laminillas o trozos de hierro, cobre y cobalto
Un electrodo de calomel saturado (SCE)
Tubo de vidrio de 3-5 mm o manguera de plstico
Un tubo de vidrio con tapn de goma, que pueda contener al electrodo de platino (ver
ms adelante los detalles de construccin)
Un voltmetro
Vasos de precipitados
5 Strobel, pg. 330.
10
Prcticas de laboratorio de Electroqumica y Corrosin
Reactivos
Hidrgeno gaseoso proveniente de un tanque u obtenido por electrlisis
Soluciones amortiguadoras de pH 4, 7 y 10
Solucin de HCl 1 M6
Soluciones de los siguientes pares inicos:
0.1 M en Fe+3 y 0.1 M en Fe+2
0.1 M en Fe+2
0.1 M en Fe+3
0.1 M en Cu+2
0.1 M en Co+2
0.1 M en [Fe(CN)6]-4 y 0.1 M en [Fe(CN)6] -3
0.1 M en I- que contenga I2 disuelto en proporcin 0.01 M
Procedimiento
Si se va a usar platino platinado en el electrodo de hidrgeno, los electrodos de
platino se mantienen por 10-12 horas en mezcla crmica (dicromato de potasio disuelto
en cido sulfrico concentrado), despus de lo cual se dejan en agua por 24 horas para
eliminar los cromatos adsorbidos. Se platina aplicando una tensin de 4 V por 10-15 min
en una solucin que contiene 3 g de cido cloroplatnico y 0.02 g de acetato de plomo por
100 ml de agua. El sentido de la corriente debe variarse cada 30 s. Los electrodos
cubiertos de un sedimento aterciopelado de negro de platino se lavan en agua, para
despus catodizarlos en una solucin de cido sulfrico al 10 % contra un nodo de
platino, quedando as listos para usarse.7
Perfore el tapn del tubo de vidrio con dos orificios, uno lo suficientemente grande
para permitir el paso ajustado del electrodo de platino y el otro para la manguera que
conducir el gas hidrgeno. Guese por el siguiente esquema:
6 Se supondr aqu que la actividad del ion hidronio en la solucin 1 M de HCl es muy cercana a la unidad.
Para una discusin ms amplia, vase Walton, pg. 222.
7 Este procedimiento se basa en el libro de Mschenko, pg. 436.
11
Prcticas de laboratorio de Electroqumica y Corrosin
conexin
elctrica
flujo de hidrgeno
tapn de goma
Electrodo de hidrgeno
platino
platinado
nivel de la solucin
El electrodo debe estar sumergido en la solucin de HCl 1 M. Mida entonces el
potencial del NHE contra el electrodo de calomel. No olvide que el electrodo puede
tardar varios minutos en alcanzar el equilibrio, pues debe desalojarse el aire en el sistema
y saturarse la solucin con hidrgeno antes de realizar la medicin.
Coloque el electrodo de hidrgeno en soluciones amortiguadoras de distinto pH y
mida el potencial contra SCE.
Mida el potencial de los siguientes electrodos vs. SCE:
a) Pt / Fe+3, Fe +2
b) Fe / Fe+2
c) Cu / Cu+2
d) Cu / Fe+3
e) Co / Co+2 o bien Pt / Co / Co+2 (electrodo de Pt recubierto de Co)
f) Pt / [Fe(CN)6]-4 , [Fe(CN)6] -3
g) Pt / I-, I2
Clculos y reporte
Grafique los resultados experimentales como ENHE vs. pH e incluya la lnea
terica. Discuta las causas de posibles desviaciones.
Describa la operacin del SCE incluyendo la semirreaccin correspondiente. Por
qu se emplea como electrodo de referencia?
El producto de solubilidad del cloruro mercuroso es 1.3E-18. Calcule y grafique el
potencial del SCE como una funcin de la concentracin de iones cloruro desde un rango
de 1E-10 M hasta saturacin. Por qu se emplean soluciones saturadas en la
construccin de este electrodo?
Tabule los potenciales medidos para los pares inicos del experimento. Establezca
una escala de potenciales de electrodo tomando como base al NHE.
Calcule G para la reaccin de la celda cuando cada uno de estos electrodos se
acopla al electrodo de calomel saturado y se le permite descargarse espontneamente.
12
Prcticas de laboratorio de Electroqumica y Corrosin
Escriba la reaccin de la celda en cada caso. Comente sobre la reversibilidad de cada una
de las reacciones. Hay alguna evidencia que indique que estas reacciones no son
reversibles?
13
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #5 Curvas de polarizacin y cintica de electrodos
Objetivos
Obtener las curvas de polarizacin (curvas de corriente vs. potencial) para un par
inico.
Obtener las grficas de Tafel de dicho sistema y emplearlas para calcular la
constante de velocidad heterognea para cada reaccin.
Reactivos y aparatos necesarios
Solucin de FeCl3 0.05 M en HCl 1 M
Solucin de FeCl2 0.05 M en HCl 1 M
Solucin 0.05 M en Fe+3 y 0.05 M en Fe+2 en HCl 1 M
Dos electrodos de platino
Un electrodo de referencia de calomel (SCE)
Un vaso de precipitados
Caimanes y cables varios de conexin
Potenciostato
Calibrador o pie de rey (vernier)
Procedimiento
Seleccione uno de los electrodos de platino para utilizarlo como electrodo de
trabajo, y estime su rea (puede medir el dimetro con el calibrador). No es necesario
estimar el rea del electrodo auxiliar, tambin de platino.
Monte una celda de tres electrodos empleando como electrodo de trabajo y como
electrodo auxiliar al platino; la referencia ser el electrodo de calomel. Para cada
solucin, mida el potencial de circuito abierto Eoc contra calomel. Entonces, aplique al
electrodo de trabajo un rango de voltajes de 500 mV alrededor del valor de Eoc y mida
la corriente (entre los electrodos auxiliar y de trabajo) en estado estacionario para varios
valores del potencial aplicado. Cuando se trabaja con un multmetro digital puede
observarse que un mismo valor de la corriente vara permanentemente.8 Lo mejor es
registrar varios valores, uno cada 15-20 segundos, y despus realizar la elaboracin
estadstica de los mismos. Asegrese de tomar suficientes datos cerca de Eoc para poder
construr las grficas de Tafel.
8 K. P. Mschenko et. al., pg. 342.
14
Prcticas de laboratorio de Electroqumica y Corrosin
Clculos y reporte
Grafique las curvas de corriente- voltaje en estado estacionario para cada sistema.
Elabore las grficas de Tafel para cada sistema.
Calcule la constante de velocidad de reaccin heterognea para cada reaccin.
Discuta las limitaciones de estas mediciones (influencia del transporte de masa).
Calcule el coeficiente de transferencia de masa para las soluciones de in frrico y
ferroso, y dibuje la curva corriente- voltaje que se esperara de una solucin en la que
estuvieran presentes los dos iones. Compare esta curva con la experimental obtenida para
la solucin que corresponde a stas caractersticas
15
Prcticas de laboratorio de Electroqumica y Corrosin
Grfica i-E
Solucin mezclada Fe II-Fe III
0 .2 0
0 .1 0
0 .0 0
i, mA
- 0 .1 0
- 0 .2 0
- 0 .3 0
- 0 .4 0
- 0 .5 0
- 0 .6 0
0
0 .2
0 .4
0 .6
0 .8
E, V vs SCE
16
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #6 Distribucin de corriente y potencial
Objetivos
Observar el efecto que tiene la distribucin de corriente y potencial en un depsito
metlico obtenido a distintas densidades de corriente en una celda de Hull.
Evaluacin de la potencia del depsito (throwing power) para una solucin de
cobrizado en una celda de Haring- Blum.
Teora
La distribucin de corriente y potencial en un sistema es un aspecto muy importante
que debe considerarse especialmente en las aplicaciones tcnicas de la electroqumica.
Por ejemplo, en el electronivelado o acabado de superficies, la distribucin de corriente
determina la variacin del espesor del recubrimiento, lo cual se pretende usualmente
minimizar con el fin de obtener una superficie lo ms lisa posible. Lo mismo puede
decirse del electroformado, electopulido y electromaquinado.
En el refinado electroltico de metales la distribucin de corriente y potencial
determinar, entre otros factores, la uniformidad de las capas de metal depositadas en el
ctodo. Si la distancia entre los electrodos es pequea (lo cual es deseable para evitar
grandes prdidas de potencia debidas a la resistencia de la solucin), entonces una
adecuada distribucin de corriente es fundamental para evitar que se formen
protuberancias en el metal depositado capaces de causar un posible cortocircuito. El
desempeo de ciertas bateras y reactores electroqumicos tambin se ve afectado por la
distribucin de corriente y potencial, pues una variacin local en el potencial puede
conducir a cambios de composicin de los productos de reaccin.
Los factores principales capaces de afectar la distribucin de corriente y potencial
de un sistema son:
a)
La geometra del sistema.
b)
La conductividad de la solucin y de los electrodos.
c)
El sobrepotencial de activacin (que depende de factores cinticos).
d)
El sobrepotencial por concentracin (que depende de fenmenos de
transporte).
Dependiendo del sistema que se analice, la influencia de uno o ms de estos factores
puede despreciarse, con el fin de introducir simplificaciones. Es costumbre distinguir
cuatro casos fundamentales:
Distribucin primaria de corriente, donde se ignoran los efectos cinticos y las
limitaciones por difusin; es decir, la influencia de los sobrepotenciales es despreciable y
solo se involucran efectos elctricos.
17
Prcticas de laboratorio de Electroqumica y Corrosin
Distribucin secundaria de corriente, que toma en cuenta al sobrepotencial de
activacin y los efectos elctricos pero desprecia la influencia de los fenmenos de
transporte de masa (sobrepotencial por concentracin).
Distribucin terciaria de corriente, que considera los gradientes de concentracin,
los efectos cinticos y el campo elctrico.
Distribucin controlada por transporte de masa, en la cual se considera que
solamente los gradientes de concentracin gobiernan la distribucin de corriente.
Aparatos necesarios
Una fuente de poder (rectificador) de corriente continua, caimanes, un multmetro,
una celda Hull y una celda tipo Haring- Blum construidas como se indica mas adelante.
Reactivos
Lmina de latn y de cobre
Fenol, dextrosa, sacarosa o melaza
Solucin para cobrizar en medio cido:
CuSO4 - 5 H2O
250 g / L
H2SO4 concentrado
75 g / L
Procedimiento
PREPARACION DE LAS PLACAS DE METAL
Corte las lminas de metal con unas tijeras de hojalatero, lime los bordes de modo
que no queden salientes cortantes. Pula las placas usando pulimento comercial para
metales y estopa, tratando de lograr un acabado tan liso como sea posible. No pula sobre
las mesas del laboratorio ! Utilice una hoja de papel peridico.
Una vez pulidas las placas, colquelas durante 5 minutos en un bao caliente y
concentrado de detergente, agitando ocasionalmente9 . Saque las placas del bao con
pinzas (no las toque con los dedos), enjuguelas con agua corriente y despus con un
bao de cido ntrico diludo por 30 segundos10 . Colquelas de inmediato en la solucin
de cobrizado o de lo contrario sufrirn oxidacin por el aire y ser necesario repetir el
procedimiento. Lo mismo ocurrir si las toca con los dedos.
CELDA DE HULL
Construya una celda de Hull de dimensiones pequeas tal como la que se muestra.
Llnela con la solucin de cobrizado, colocando como ctodo una placa de latn y como
nodo una de cobre. Mantenga la temperatura entre 20-50 C y ajuste la corriente de
modo que obtenga una densidad de corriente de 0.5-2.5 amperes por decmetro
cuadrado11 .Deposite el metal durante aproximadamente 3 minutos y observe lo que
ocurre en los electrodos.
9 A sugerencia del maestro, puede usarse otra solucin desengrasante, tal como hidrxido de sodio,
compuestos de amonio, etc.
10 No enjuague con cido si necesita saber el peso de la placa (experimento de la celda Haring-Blum).
11 A valores cercanos al lmite inferior se obtienen mejores resultados cuando la celda es pequea.
18
Prcticas de laboratorio de Electroqumica y Corrosin
CELDA HARING-BLUM
Construya la celda Haring- Blum como se muestra y llnela con la solucin de
cobrizado. Los dos ctodos de latn debern estar previamente pulidos, pesados y
desengrasados (en ese orden), pero no deben sumergirse en el bao de cido ntrico, pues
perderan peso. Deposite el metal con las mismas condiciones del apartado anterior, por
un periodo mximo de 3 minutos o el tiempo necesario para obtener un depsito
uniforme, no demasiado grueso ni arborescente. Repita el experimento agregando a la
solucin algn aditivo: fenol, melaza, dextrosa, sacarosa, etc. a aproximadamente 0.9 g /
L.
Clculos y reporte
CELDA DE HULL
Se sugiere emplear una hoja electrnica de clculo o algn programa
computacional para obtener la distribucin de potencial del sistema. Consulte el captulo
Current distribution de N. Ibl en las pginas 251- 254, donde se incluye una forma
discretizada de la ecuacin de Laplace y las condiciones frontera a utilizar.
CELDA HARING-BLUM
Calcule la potencia del depsito utilizando la definicin de la British Standards
Institution:
TP
A
A
M N
+ MN
/ MF
/ MF
100
[%]
A = b / a Razn de distancias entre los ctodos. Usualmente A 5
MN, MF Pesos del metal depositado en el ctodo ms cercano y en el ms lejano
respectivamente.
Recuerde que, de acuerdo a la misma, la potencia del depsito se hace 100%
cuando los pesos de metal depositados en ambos ctodos son iguales. Tuvo algn efecto
la adicin del aditivo en el valor de TP? Y en la apariencia del depsito?
19
Prcticas de laboratorio de Electroqumica y Corrosin
Figuras
12 cm
Vista superior
5
cm
7
cm
Altura sugerida:
7 cm
4
cm
Celda de Hull
Celda Haring-Blum
20
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #7 Cronoamperometra y Cronocoulombimetra
Objetivo
Evaluacin de los coeficientes de difusin del ion bromuro en soluciones
acuosas de glicerina a diferente concentracin.
Teora
La Cronoamperometra es una tcnica electroanaltica basada en la medicin de
la corriente debida a difusin en funcin del tiempo, despus de aplicarse un escaln
de potencial. Una aplicacin importante de la Cronoamperometra es la evaluacin
de los coeficientes de difusin de especies electroactivas en solucin. Los
coeficientes de difusin son fundamentales en el establecimiento de los procesos de
transporte de masa en diferentes procesos, por ejemplo, la difusin de iones en
electrodos de bateras recargables, reactores electroqumicos y procesos de
galvanoplastia.
Sistema de estudio
El sistema de estudio consiste en soluciones de bromuro de potasio en medio cido
con diferente concentracin de glicerina, a fin de modificar la viscosidad del medio. Las
soluciones sugeridas son: 10 mM KBr, 0.1 M H2SO4, 0%glicerina, 20% glicerina, 40%
glicerina, 60% glicerina en volumen.
Reportar
Las curvas de corriente vs. tiempo para todas las soluciones y obtener las grficas
de Cottrell. Evaluar los coeficientes de difusin del ion bromuro en cada una de las
soluciones. Graficar los coeficientes de difusin del ion bromuro obtenidos en funcin de
la concentracin de glicerina. Llevar a cabo un escaln de potencial doble para una de las
soluciones y obtener la curva de corriente vs. tiempo correspondiente. Integrar una de las
curvas de corriente vs tiempo para un escaln sencillo de potencial y graficar la respuesta
de carga vs tiempo. Evaluar la viscosidad del medio utilizando reometra o un
viscosmetro de Oswalt.
21
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #8 Voltamperometra cclica
Objetivos
Obtener un voltamperograma cclico para el par inico ferrocianuro- ferricianuro e
investigar la reversibilidad del mismo sistema.
Emplear el programa computacional LabView o Virtual Bench como sistema de
adquisicin de datos.
Teora
Potencial
Dentro de las tcnicas electroanalticas reversibles ocupa un lugar importante la
voltamperometra cclica. Se emplea principalmente para caracterizar las propiedades
redox de compuestos qumicos y para el estudio de mecanismos de reaccin.
La tcnica que empleamos en esta prctica recibe el nombre tcnico de
cronoamperometra de barrido lineal del potencial, pero se acostumbra referirse a ella
como voltamperometra de barrido lineal o LSV por sus iniciales en ingls. Al
electrodo de trabajo se le aplica un potencial que vara linealmente con respecto al
tiempo, y se registra entonces la respuesta i vs. E del sistema bajo estudio.
Ei
tiempo
Rampa de potencial comenzando en Ei
22
Corriente
Prcticas de laboratorio de Electroqumica y Corrosin
Ei
Eo'
Potencial
Un voltamperograma tpico
Es posible aplicar una rampa lineal del potencial cuya pendiente cambie de signo al
llegar a un cierto valor E . En este caso, que corresponde a la voltamperometra cclica,
el voltamperograma puede presentar dos picos, uno correspondiente a la reaccin de
oxidacin y otro a la reaccin de reduccin, en caso de que el sistema sea reversible.
Normalmente, los parmetros de inters que se miden en un voltamperograma son:
- La relacin entre las corrientes de pico, ipa / ipc
- La separacin entre los potenciales de pico, | Epa - Epc |
- Los potenciales a la mitad del pico, Ep/2
Aparatos necesarios:
Potenciostato
Computadora equipada con el software LabView, el programa Virtual Bench o algn otro
similar que permita adquisicin de datos por medio de una tarjeta A/D y caja de
conexiones. LabView y Virtual Bench son marcas registradas de National Instruments.
Celda electroqumica
Electrodos de platino para usar como electrodos auxiliar y de trabajo
Electrodo de referencia (SCE, NHE o algn otro)
Tanque de nitrgeno purificado para dearear la solucin
Cables varios de conexin BNC, banana y caimn
Reactivos:
Solucin de ferricianuro de potasio 5 mM en nitrato de potasio 1 M
Procedimiento:
1) Ensamble la celda electroqumica y llnela con la solucin de ferricianuro de potasio.
Conecte el electrodo de trabajo de platino a la entrada K1, el electrodo auxiliar de platino
a la entrada CE y el electrodo de referencia a la entrada REF. Burbujee nitrgeno durante
10 minutos en la solucin para desplazar el oxgeno disuelto. Puede continuar con los
pasos 2 a 6 durante el burbujeo.
23
Prcticas de laboratorio de Electroqumica y Corrosin
2) Conecte la salida marcada E1 a la terminal de entrada del eje X en el graficador o al
canal elegido para tal fin en la computadora. Conecte la salida marcada I1 a la entrada del
eje Y del graficador o computadora.
3) Ajuste los controles del electrodo K1 como sigue: desactive el control "offset
voltage". Active el control de "sweep voltage". Coloque el convertidor de corriente
"current converter" en 1mA/V o en una sensibilidad menor, por ejemplo 10mA/V para
evitar sobrecargar el sistema.
4) Asegrese que el electrodo K1 se encuentra en modo potenciosttico y gire la perilla
del aparato de modo que monitoree el potencial E1.
5) Ajuste el generador de funciones como sigue: lmite superior +0500 mV, lmite
inferior -0500 mV; El ajuste de la velocidad de barrido se deja para ms tarde. Oprima el
botn ZERO y coloque el control SWEEP en el modo HOLD.
6) Seleccione la direccin en que iniciar el barrido del potencial (hacia arriba o hacia
abajo).
7) Coloque el potenciostato en modo NORMAL.
8) Para iniciar el experimento, desactive el botn ZERO y ponga el control SWEEP en
modo RUN.
9) En la pantalla del graficador debe trazarse un voltamperograma. Experimente con
diferentes valores de la velocidad de barrido (por ejemplo, a 10, 15 y 25 mV / s ) y
observe el efecto sobre las grficas. Siga las instrucciones del maestro o el asistente para
almacenar los datos en un archivo de la computadora. Normalmente basta con adquirir
los datos a razn de un dato por segundo o un dato cada dos segundos, en un ciclo
completo del potencial.
Reporte
Utilizando una hoja electrnica de clculo o algn programa similar, grafique el
voltamperograma para diferentes velocidades de barrido. Reporte para cada onda:
El potencial de pico.
El potencial a la mitad del pico.
El potencial formal del sistema.
La corriente de pico.
La corriente limitante (si se observa).
Compruebe los criterios de reversibilidad de Nernst para el sistema, tales como la
relacin entre las corrientes de pico andica y catdica, y la diferencia entre los
potenciales de pico. Es reversible el sistema ?
24
Prcticas de laboratorio de Electroqumica y Corrosin
25
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #9 Polarografa
Objetivo
Construir y utilizar un polargrafo a partir de un capilar de termmetro y
cuantificar una especie electoactiva en solucin.
Teora
La polarografa es una tcnica electroanaltica desarrollada inicialmente por
Heyrovsky para la medicin de la tensin superficial. Actualmente se emplea como
tcnica electroanaltica para determinar concentraciones de hasta 1x10-9 M de especies
electroactivas en solucin. La tcnica involucra el uso de un electrodo de gota de
mercurio colgante, donde se llevan a cabo reacciones de oxidacin o reduccin de
especies electroactivas en solucin. El arreglo experimental bsico de un polargrafo,
consiste en un capilar de 10 a 20 cm de longitud y 5x10-3 cm de dimetro conectado a un
recipiente conteniendo Hg. El contacto entre el mercurio y el electrodo de trabajo se
logra por medio de un alambre de platino. El mercurio fluye a travs del capilar
formando pequeas gotas de aproximadamente 0.1 cm de dimetro. Las gotas adquieren
una forma casi esfrica y caen cuando su peso es mayor que la fuerza de tensin
superficial que las mantiene unidas a la columna de mercurio. El barrido del potencial
del electrodo de gota de mercurio se hace por medio de un potenciostato. La velocidad
de barrido se fija de tal forma que cada gota tiene un potencial diferente a su predecesora
y se comporte como un experimento independiente.
La gota madura con un dimetro de 0.1 cm, cae a una frecuencia de 2 a 6 gotas/s.
Al caer la gota, la solucin se agita, y reconstituye las condiciones iniciales del
experimento. Entonces, la gota naciente ofrece una superficie reactiva nueva a la
solucin. La corriente detectada en el electrodo de gota de mercurio es predicha por la
ecuacin de Ilkovic. Esta expresin relaciona las condiciones de crecimiento de la gota y
la ecuacin de Cottrell. La ecuacin de Ilkovic aparece en seguida.
i d = 798nDo1 / 2 Co* m 2 / 3 t 1 / 6
en donde i d est en amperios, Do en cm2 /s, m en mg/s, y t en segundos.
26
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
A partir de una seccin de capilar de vidrio de un termmetro de
aproximadamente 10 cm de longitud, se procede a estirar en la flama de un mechero uno
de sus extremos para formar un capilar de aproximadamente 5x10-3 cm. El capilar se
conecta a la salida de una pera de decantacin en donde se coloca el mercurio que ser
alimentado a la celda por medio de una manguera de hule flexible. El capilar se coloca
en una celda de tres electrodos, junto con el electrodo de referencia y el electrodo
auxiliar. El potencial de la gota de mercurio se controla por medio de un potenciostato,
asegurndose que la velocidad de barrido sea tal que cada gota tenga un potencial
diferente a su antecesora. El tiempo de vida de la gota es de 2 a 6 s. La solucin de
prueba es una solucin de 0.01 M de CdCl2 , utilizando una solucin 0.1 M de KCl como
electrolito de soporte. El potencial se barre desde el potencial de circuito abierto a
valores negativos necesarios para reducir el Cd2+ en solucin.
Reporte
Reportar el polarograma de la reduccin de Cd2+ en solucin, la corriente lmite y
el potencial medio del par inico Cd/Cd2+. A partir de los datos del polarograma deducir
los valores del potencial medio graficando los datos de manera apropiada. Calcular el
nmero de electrones intercambiados en la reaccin. Comparar el potencial medio
obtenido experimentalmente con el potencial predicho por la ecuacin de Nerst..
Bibliografa
Allen J. Bard, Larry R. Faulkner, Electrochemical Methods. Fundamentals and
Applications, John Wiley & Sons, (1980).
27
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #10 Disco rotatorio
Objetivo
Utilizar la tcnica de disco rotatorio para evaluar el coeficiente de difusin de una
especie electroactiva en solucin y comprobar la ecuacin de Levich.
Teora
La tcnica e disco rotatorio es una prueba hidrodinmica que permite controlar la
transferencia de masa en la superficie del electrodo, modificando el espesor de la capa de
difusin en funcin de la velocidad de giro del electrodo. Es una tcnica electroanaltica
de la cual se dispone de informacin sobre los patrones de flujo imperantes en el disco y
las ecuaciones que gobiernan la transferencia de masa. Las aplicaciones de la tcnica de
disco rotatorio incluyen: estudios cinticos, evaluacin de especies electroactivas en
solucin. Experimentalmente, la tcnica de disco rotatorio consiste en un disco de trabajo
montado en una flecha metlica recubierta de tefln acoplada a un motor. La velocidad
de giro del electrodo es controlado por medio de un controlador de velocidad
independiente conectado directamente al motor. El potencial del electrodo de trabajo se
controla por medio de un potenciostato y un generador de funciones en una celda de tres
electrodos.
Procedimiento
Preparar 100 ml de una solucin de ferricianuro de potasio K3 Fe(CN)6 en nitrato
de potasio KNO3 1 M como electrolito de soporte. La solucin se coloca en un vaso de
precipitado y se introduce el electrodo de disco, el electrodo auxiliar y el electrodo de
referencia. Se conectan los electrodos al potenciostato y se emplea el mismo programa
utilizado en la prctica de voltamperometra cclica. Es recomendable utilizar una
velocidad de barrido del potencial de 40 mV/s. Obtener un voltamperograma de la
solucin quieta, enseguida proceder a variar la velocidad de rotacin del disco en el rango
de 0 a 2500 RPM, se recomienda emplear raices cuadradas perfectas para la velocidad de
rotacin y facilitar la representacin de los datos en las grficas de Levich, por ejemplo 0,
16, 25, 36, 49, 64, etc.
Reportar
Reportar los voltamperogramas en solucin quieta y a las diferentes velocidades
de agitacin ensayadas. A partir de los datos de corriente lmite construir una grfica de
Levich y evaluar el coeficiente de difusin del ion ferricianuro y compararlo con el valor
reportado en la literatura. Explique por que razn en el voltamperograma en solucin
quieta se observan tanto los picos de oxidacin como de reduccin, pero no as cuando el
28
Prcticas de laboratorio de Electroqumica y Corrosin
electrodo est rotando, por que solo se observa el pico de reduccin?. Bosqueje el
voltamperograma que esperara a una velocidad de 1000 RPM si se hubiera utilizado una
solucin de la misma concentracin de tanto ferri y ferrocianuro de potasio. Reporte el
potencial medio para el sistema.
Bibliografa
1. Notas de clase
2. Electrochemical Methods. Fundamentals an applications Allen J. Bard, Larry
R. Faulkner, John Wiley and Sons (1980).
29
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #11 Electrlisis en masa
Objetivo
Llevar a cabo una electrlisis en masa (exhaustiva) en un sistema electroqumico
que permita evaluar el factor p=mo A/V, anlogo a la constante de velocidad de reaccin
de primer orden y la cantidad total de carga Q(t) (en coulombios) consumida durante la
electrlisis por unidad de tiempo.
Teora
Los procesos de electrlisis en masa o exhaustivos permiten eliminar,
electrosintetizar o cuantificar una especie electroactiva en solucin. Estos mtodos tienen
diferencias importantes en comparacin con las tcnicas electroanalticas tratadas, por
ejemplo, utilizan una relacin entre el rea de los electrodos y el volumen de la solucin
grande A/V, lo que provoca cambios apreciables de la concentracin en el seno de la
solucin desde el inicio de la electrlisis. En la deduccin de la expresin de la corriente
vs. tiempo para este tipo de electrlisis aparece la relacin p=mo A/V, anloga a la
constante de velocidad de reaccin de primer orden para una cintica convencional[1,2].
La separacin entre los electrodos es pequea y se precisa de buena agitacin para
aumentar la transferencia de masa durante la electrlisis.
La electrlisis en masa o (exhaustiva) se utiliza en electroseparaciones, remocin
de especies electroactivas en solucin de manera selectiva, electrlisis de pelcula
delgada en sistemas con relaciones A/V grandes y poca cantidad de electrolito atrapado
entre los electrodos de la celda, agotamiento de especies en solucin o stripping en
procesos de preconcentracin de materiales en volmenes pequeos o en la superficie de
electrodos, adems de, aplicaciones como tcnica electroanaltica, cuantificndose la
cantidad de peso de la especie electrodepositada en la superficie del electrodo, lo que se
conoce como electrogravimetra, o la cuantificacin de la carga consumida durante la
electrlisis relacionndolo con la masa de la especie electrolizada empleando la primera
ley de Faraday, lo que se conoce como coulombimetra. Cabe sealar que las tcnicas
anteriores requieren de una eficiencia de la corriente del 100%.
La tcnica de electrlisis en masa puede llevarse a cabo con un control del
potencial o de la corriente. El primer mtodo es ms conveniente para evitar reacciones
secundarias, sin embargo, demanda de una instrumentacin ms costosa como la
necesidad de utilizar un potenciostato. El mtodo de control de corriente requiere de
equipo menos sofisticado como es el caso de un rectificador de corriente.
30
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
Preparar 500 ml de una solucin de sulfato cprico industrial en medio cido 0.2 M
de CuSO4 y 0.2 M H2 SO4 . Tomar 100 ml de la solucin y diluirla al 50 % continuar el
proceso de dilucin hasta preparar una serie de soluciones con las siguientes
concentraciones (0.2, 0.1, 0.05, 0.025, 0.0125, 0.00625 M). Preparar una curva de
calibracin de concentracin de sulfato de cobre vs. transmitancia empleando el
espectrofotmetro Spectronic 20 a una longitud de onda de 630 nm. Construir un
arreglo de electrodos de cobre y acero inoxidable cmo se muestra en la figura anexa.
Intercalar una lmina de cobre y otra de carbn con un separador de acrlico entre ellas.
Perforar el arreglo de placas y atornillarlas en cada extremo. Enseguida, conectar los
bornes opuestos del arreglo al rectificador de corriente, las placas de cobre al ctodo y las
placas de carbn al nodo del rectificador de corriente. Conectar un multmetro en serie
en el nodo o en el ctodo para cuantificar la cantidad de corriente que circula en la celda
en funcin del tiempo. Conectar un multmetro en paralelo para medir el voltaje entre las
terminales y registrar los valores en funcin del tiempo. Enviar la seal de corriente y de
voltaje de los multmetros directamente a una PC con tarjeta GPIB y almacenar los datos
en funcin del tiempo. Colocar la celda en un vaso de precipitado con un agitador
magntico e introducir el arreglo de electrodos. Se vaca la solucin de sulfato de cobre
0.2 M en la celda y se fija una densidad de corriente de 2 A/dm2 . Se toman alcuotas de
10 ml de la celda cada 10 minutos y se llevan al espectrofotmetro Spectronic 20 para
obtener su transmitancia.
Reportar
La curva de calibracin para la solucin de cobre en trminos de absorbancia y
transmitancia. Las grficas de la concentracin de cobre y corriente vs. tiempo. A partir
de los datos experimentales obtenidos se evalua el coeficiente p=mo A/V y la curva de
carga vs tiempo Cmo se afectara este coeficiente si el experimento se realizara con
una agitacin ms vigorosa a la utilizada? Qu efectos esperara observar en el
coeficiente p si se incrementara la temperatura?
Bibliografa
3. Notas de clase
4. Electrochemical Methods. Fundamentals an applications Allen J. Bard, Larry
R. Faulkner, John wiley and Sons (1980).
5. J. Electrochem. Soc., 139, 2806 (1992).
31
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #12 Electrosntesis
Objetivo
Llevar a cabo la electrlisis de salmuera para producir cloro y sosa custica en una
celda electroltica a escala de laboratorio.
Teora
Una de las industrias electroqumicas ms importantes en el mundo es la industria
del cloro-lcali debido a la demanda de sus productos: cloro, sosa custica e hidrgeno en
diversos procesos. Esta industria produce el cloro para la produccin de PVC, en
sistemas de potabilizacin de agua en todas las ciudades alrededor del mundo y
compuestos clorados empleados como agentes desinfectantes como hipoclorito de sodio e
insecticidas. El hidrxido de sodio, por otra parte, se emplea en la manufactura de rayn,
la saponificacin grasas para la produccin de jabn y la limpieza de botellas en la
industria embotelladora. La produccin de cloro involucra la oxidacin del ion cloruro
en el nodo de la celda y la reduccin de agua en el ctodo generando hidrgeno. La
celda est constituida por un compartimiento andico donde se tiene el nodo de titanio
recubierto de xido de rutenio, se encuentra separado del compartimiento catdico por un
diafragma de asbesto montado sobre un ensamble de acero al carbn. Durante la
electrlisis de la salmuera el cloro es colectado en el nodo de la celda y el hidrgeno en
el ctodo. Durante la electrolisis aparecen en los compartimientos de la celda cambios
apreciables tanto de concentracin como de pH de las especies presentes.
Procedimiento
Se prepara una salmuera de 50 g/l en agua destilada para utilizarse en la
electrlisis. Se prepara un diafragma de asbesto siguiendo el procedimiento descrito en la
tesis de licenciatura del estudiante Oliverio Barbosa. Se procede a armar la celda de
electrlisis. Enseguida, se conecta el nodo de la celda y el ctodo a un rectificador de
corriente. La corriente que circula en la celda se cuantifica por medio de un electrodo en
serie. El cloro generado se lleva a un recipiente conteniendo los medidores de pH en
cada compartimiento de la celda Se utiliza un programa adquisicin de datos escrito en el
programa LabView para monitorear los cambios de pH que se presentan en ambos
compartimientos de la celda.
Reportar
Los volmenes de cloro e hidrgeno generados con el paso de una corriente y los
cambios de pH obtenidos en ambos compartimientos de la celda.
32
Prcticas de laboratorio de Electroqumica y Corrosin
Bibliografa
Notas de clase
Electrochemical Methods. Fundamentals an applications Allen J. Bard, Larry R.
Faulkner, John wiley and Sons (1980).
Oliverio Barbosa, Tesis de licenciatura desarrollada en el laboratorio de
Electroqumica y Corrosin (1998).
33
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #13 Electrorefinado de plata
Objetivo
Purificar plata hasta un 99.999 % de pureza a partir de dore por medio de
electrorefinado.
Teora
La materia prima donde se obtiene la plata es fundamentalmente, el producto
concentrado de los barros andicos procedentes de la refinacin del cobre, as como de
otros metales no ferrosos como el plomo, nquel y zinc. La plata bruta procedente de los
baos de cobre contiene 95 % de plata y 1 a 3 % de Au, siendo el 2 % restante de plomo,
bismuto y cobre, telurio, hierro, nquel, platino y algunas cantidades de otros metales.
La plata bruta procedente de la desplatacin del plomo contiene 98 % de Ag un
0.50% de Au y el uno y medio porciento de cobre, plomo y zinc. Estos metales se funden
como nodos y se refinan electrolticamente en un electrolito de Ag NO3-Cu (NO3 )2 en
medio cido.
Al llegar los barros a la refinera de plata se deja reposar en tanques
sedimentadores, para extraer el cobre se le tuesta ligeramente en un horno de combustible
lquido, esto provoca que todo el cobre se vuelva xido de cobre que es lixiviado con
cido sulfrico al 15 % en agitadores. Despus de la lixiviacin, el barro se lleva a un
nuevo filtrado donde se extrae todo el cobre, para despus llevarlo a los hornos dore,
durante el proceso de refinado en el horno se forma una escoria que se despuma y se
enva a la refinera de plomo. El antimonio es volatilizado y recuperado como polvo. El
selenio y el telurio se volatizan en parte, pero principalmente se eliminan aadiendo
flujos alcalinos, nitro y cenizas sdicas. Esto dura aproximadamente 40 hrs. De aqu se
obtiene el metal dore que contiene 98.5% de Ag, el 1% de Au y una pequea cantidad de
impurezas metlicas. La plata dore se funde formando nodos y es electrolizada para
separar el oro. Esto se hace en celdas Thum y Moebius.
En el sistema Thum, las pilas constan de tanques de porcelana vitrificada, o bien
de tanques de hormign revestidos interiormente de mstique o masilla cuyo fondo,
cubierto de bloques de grafito, forma el ctodo. Los nodos de plata dore se disponen
horizontalmente en unos bastidores de madera, encima del ctodo. Estos soportes se
cubren de lona, que acta de diafragma e impiden la mezcla del barro de oro con el
deposito catdico. La plata se deposita en cristales que son rescatados en un tiempo
determinado. El electrolito a utilizar es una solucin de nitrato de plata neutro y nitrato
de cobre, que contiene unos 60 g de Ag/l, y unos 40 g de Cu/l.
En el sistema Moebius se disponen el nodo y el ctodo verticalmente, encerrando
los nodos en una bolsa de lona para retener los lodos de oro. Los ctodos son lminas de
acero inoxidables, se emplean escarbadores de madera accionados mecnicamente, los
cuales separan los cristales del ctodo echndolos en cubetas. La densidad de corriente
34
Prcticas de laboratorio de Electroqumica y Corrosin
en la superficie del nodo es de 4 a 6 A/dm2, mientras que en el ctodo es del orden de
2.8 a 3.8 A/dm2. Los cristales obtenidos suelen tener una pureza del 99.999 %. Tras el
lavado se funde en grandes retortas y se les da la forma de barras.
Equipo
Rectificador de corriente
Multmetro digital
Cables y caimanes
Vaso de precipitado
Tijeras de hojaletero
Balanza analtica
Guantes
Lentes
Reactivos
Plata Dore
Lmina de acero inoxidable
Agua destilada
Procedimiento
Preparar una solucin 1 molar de AgNO3 . Cortar un pedazo de plata dore, medir
sus dimensiones, lavar con solucin de jabn para eliminar grasa, enjuagar con agua
destilada secar y pesar en la balanza analtica. Se recorta una lmina de acero de
dimensiones similares a las de la plata. Colocar el pedazo de plata en un vaso de
precipitado envuelto en una bolsa de lona. Introducir el ctodo de acero inoxidable en la
celda permitiendo una separacin de algunos cm entre ambos electrodos. Proceder a
calcular la corriente que circular en la celda para mantener una densidad de corriente de
4.8 A/dm2 en el nodo. Conectar el borne (+) del rectificador de corriente al electrodo de
plata (nodo), el borne (-) al electrodo de acero inoxidable (ctodo), ajustar la corriente
en el rectificador de corriente girando la perilla central. En caso de que sea difcil leer los
valores de corriente en el ampermetro del rectificador, conecte en serie un multmetro
digital. Una vez ajustada la densidad de corriente necesaria proceda a tomar tiempo del
experimento. En un lapso de 30 min. puede observarse la formacin de cristales de Ag
formarse en el ctodo de la celda. Detenga el experimento y pese el ctodo para conocer
el peso de Ag depositada.
35
Prcticas de laboratorio de Electroqumica y Corrosin
Reporte
1.- Que reacciones estn ocurriendo en el ctodo y el nodo de la celda?
2.- Cual es el objetivo de utilizar la bolsa de lona para cubrir el nodo de la celda?
3.- Calcular el nmero de colulombios circulados en la celda y evalu el peso de la Ag
depositado tericamente, compare con los valores obtenidos experimentalmente.
4.- Que efectos podran generarse si la densidad de corriente se elevara arbitrariamente?
5.- Que otro tipo de metales podran refinarse por este procedimiento?
6.- Cual es la limitacin ms importante de este proceso?
7.-Podra este proceso funcionar para purificar otros metales? En caso afirmativo
Cules?
36
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #14 Titulacin potenciomtrica de Fe2+ con Ce4+
Objetivo
Obtener las curvas de titulacin potenciomtrica de Fe2+ con una solucin valorada
de Ce4+ empleando como mtodos de deteccin la tcnicas: de un electrodo indicador y
dos electrodos indicadores.
Teora
Una de las titulaciones clsicas de oxidacinreduccin es la determinacin de Fe2+
por medio de una titulacin con una solucin estndarizada de Ce4+. La reaccin global
aparece a continuacin
Fe2+ + Ce4+ = Fe3+
+ Ce3+
Normalmente, este tipo de titulaciones se lleva a acabo en un medio cido a
concentraciones de 0.5 M o mayores. La presencia de cantidades elevadas de cido es
necesaria para reprimir la reaccin del Ce4+, promover la reaccin rpida entre Fe2+ y
Ce4+ y adems favorecer la solubilidad del Fe2+.
En las titulaciones potenciomtricas se mide la diferencia de potencial entre un
electrodo indicador y un electrodo de referencia y se grfica en funcin del volumen de
titulante aadido. El electrodo indicador es de platino y el electrodo de referencia
comnmente es un electrodo de calomel saturado (SCE). El potencial del electrodo de
platino depende de la relacin de agente oxidante y reductor presente en la solucin. Por
otra parte, el electrodo de calomel tiene un potencial constante a lo largo de la titulacin.
Para evitar contaminaciones del electrodo de calomel es conveniente mantenerlo aislado
de la solucin titulada. El contacto se establece a travs de un puente salino. El potencial
medido se obtiene directamente por medio de un multmetro digital, para un sistema de
un solo electrodo indicador la medicin corresponde a la diferencia entre el electrodo
indicador y el electrodo de referencia:
Emedido = Eind Rref
Las curvas de titulacin potenciomtrica pueden calcularse a partir de la ecuacin
de Nernst y una tabla de potenciales estndar. En cualquier punto durante la titulacin el
Ce4+ reacciona con Fe2+ de acuerdo a la reaccin de arriba sealada de manera completa y
se alcanza un equilibrio.
37
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
Preparar 100 ml de una solucin 0.01M de Fe2+ en 0.5 M H2 SO4 y 100 ml de una
solucin 0.020 M de Ce4+. Colocar la solucin valorada de Ce4+ en una bureta y la
solucin de Fe2+ en un vaso de precipitado con agitacin. Adaptar los mtodos de
deteccin del punto de equivalencia potenciomtrico de un electrodo indicador y de dos
electrodos indicadores.
Efectuar la titulacin aadiendo volmenes pequeos de solucin de Ce4+ de
aproximadamente 0.5 ml a la solucin de Fe2+ agitada por medio de una barra magntica.
Medir la diferencia de potencial entre el electrodo indicador y el electrodo de referencia
por medio de un multmetro digital. Repetir la misma titulacin empleando el sistema de
deteccin de dos electrodos indicadores. Tabular los datos de potencial vs. el volumen de
titulante aadido.
Reportar
Medir los potenciales de equilibrio utilizando un electrodo de referencia acoplado a
un electrodo indicador de platino de las soluciones de Fe2+ y Ce4+. Reportar las curvas de
titulacin del sistema empleando los dos mtodos potenciomtricos de deteccin del
punto de equivalencia (uno y dos electrodos indicadores). Evaluar la constante de
velocidad de reaccin entre Fe2+ y Ce4+. Calcular el potencial terico en el punto de
equivalencia para la titulacin de Fe2+ y Ce4+ empleando las ecuaciones de Nerst de
ambas especies y resolviendo simultneamente.
38
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #15 Titulacin de una mezcla de haluros
Objetivo
Obtener las curvas de titulacin potenciomtrica de una mezcla de haluros
empleando una solucin valorada de nitrato de plata
Teora
En las titulaciones potencimetricas se mide la diferencia de potencial entre un
electrodo indicador y un electrodo de referencia y se grfica el potencial en funcin del
volumen de titulante aadido. El objetivo del procedimiento es detectar el punto de
equivalencia, aunque tambin puede emplearse en la determinacin de constantes de
disociacin de cidos dbiles, informacin termodinmica y constantes de
acomplejamiento. La tcnica tiene la ventaja sobre las titulaciones convencionales de que
pueden titularse sustancias coloreadas al no requerirse de indicador.
El electrodo indicador normalmente es de platino, aunque tambin puede ser de
otro tipo de metal, por ejemplo, plata para las titulaciones de halgenos. El electrodo de
referencia comnmente empleado es el de calomel saturado (SCE). El potencial del
electrodo indicador depende de la relacin de agente oxidante y reductor presente en la
solucin. Por otra parte, el electrodo de calomel mantiene un potencial constante a lo
largo de la titulacin. Esto permite observar las variaciones del potencial conforme se
agrega el titulante. Para evitar la contaminacin del electrodo de calomel se mantiene
ste en un recipiente aislado de la solucin titulada. El contacto se establece a travs de
un puente salino. El potencial se mide por medio de potencimetro en la escala de mV o
un multmetro digital.
Procedimiento
Determinacin de cloruros
Colocar 25 ml de una solucin 0.02 M de cloruro de potasio en un vaso de
precipitado de 250 ml conteniendo un agitador magntico. Adicionar aproximadamente
75 ml de una solucin amortiguadora de 0.6 M cido actico y 0.6 M acetato. Colocar un
electrodo de plata sumergido previamente en una solucin de cido ntrico concentrado y
enjuagado con agua destilada completamente. Utilizar un electrodo de calomel saturado
como electrodo de referencia. Colocar el electrodo de referencia en un recipiente
independiente y conectarlo a la celda por medio de un puente salino de agar. Medir la
diferencia de potencial entre el electrodo indicador y de referencia empleando un
potencimetro con la escala de mV o un multmetro digital.
Titular la muestra con una solucin estndar de nitrato de plata, registrando el
potencial del electrodo indicador despus de cada adicin del titulante. Adicionar
39
Prcticas de laboratorio de Electroqumica y Corrosin
volmenes de titulante relativamente grande (1 a 3 ml) al principio de la titulacin,
esperar hasta que el potencial no vari ms de 1 a 2 mV por minuto antes de adicionar la
nueva porcin de titulante. Cerca del punto de equivalencia de a titulacin, adicionar
volmenes de 0.1 ml. Continuar la titulacin al menos 1 ml ms haya del punto de
equivalencia. Determinar el punto de equivalencia por medio de un procedimiento
grfico o analtico.
Determinacin de bromuro
Repetir el procedimiento descrito anteriormente usando 25 ml de una solucin de
bromuro de potasio 0.02 M en lugar del cloruro de potasio
Determinacin de una mezcla de cloruros y bromuros
Repetir el procedimiento usando una mezcla de 10 ml de cloruro de potasio 0.02 M
y 10 ml de una solucin 0.02 M de bromuro de potasio.
Reportar
Las curvas de titulacin para el cloruro, bromuro y la mezcla de halgenos.
Tabular los datos de las titulaciones. Para cada titulacin, comparar el nmero de
milimoles de haluro encontrado con el nmero de milimoles tomados para el anlisis. En
el caso de la mezcla de haluros, calcular los milimoles de bromuro del volumen de nitrato
de plata necesario para la primer deflexin en la curva de titulacin, calcular los
milimoles de cloruro de la diferencia en volumen entre la primera y segunda deflexin en
la curva, y calcular la suma de las cantidades de bromuro y cloruro del volumen total de
titulante para alcanzar la segunda inflexin. Calcular los errores de la titulacin. Obtener
la expresin que rige el potencial de la celda, expresarla en funcin de la concentracin
de in plata.
40
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #16 Potenciometra de un electrodo
Objetivo
Utilizar la tcnica de potenciometra ordinaria de un electrodo para determinar el
peso equivalente y la constante de disociacin de un cido dbil desconocido.
Teora
Existen varios mtodos electromtricos que permiten detectar el punto de
equivalencia en las titulaciones convencionales. Estos mtodos pueden clasificarse en a)
mtodos potenciomtricos, en los que se mide el potencial del electrodo indicador, y b)
mtodos amperomtricos, en los que se monitorea la corriente en el circuito del electrodo
indicador.
Dentro de los mtodos potenciomtricos podemos distinguir:
- Potenciometra de un electrodo: Involucra la medicin del potencial de un electrodo
indicador polarizable con respecto a un electrodo de referencia no polarizable, tanto en
circuito abierto como aplicando una corriente andica o catdica pequea en el electrodo
indicador.
- Potenciometra de dos electrodos: Involucra la medicin de las diferencias de potencial
entre dos electrodos polarizables cuando se aplica entre ellos una corriente constante
pequea. Generalmente se emplean dos electrodos idnticos, del mismo material y del
mismo tamao.
En esta prctica se pretende seguir potenciomtricamente el curso de una titulacin
con hidrxido de sodio de un cido dbil desconocido, graficar los datos y reportar el
peso equivalente y la constante de ionizacin del cido dbil. Se usar la tcnica de
potenciometra con un electrodo, en la que el electrodo indicador corresponde a un
electrodo de vidrio sensible a los cambios de concentracin del ion hidronio.
Aparatos necesarios
Un potencimetro o medidor de pH con sus electrodos, balanza analtica, soporte
universal, bureta, vasos de precipitados, agitador magntico y pinzas para bureta.
Reactivos
Soluciones amortiguadoras de pH 4, 7 y 10 para calibrar el medidor de pH.
Hidrxido de sodio o potasio aproximadamente 0.1 N, previamente estandarizado. La
solucin puede estandarizarse rpidamente contra ftalato cido de potasio (KHP)
previamente desecado a 110C por dos horas o que haya permanecido en un desecador
qumico por lo menos 24 horas.
Alguno de los siguientes cidos dbiles solubles en agua, que se utilizarn como
41
Prcticas de laboratorio de Electroqumica y Corrosin
problema: cido oxlico, fosfrico, ctrico, ascrbico (vitamina C), tartrico, etc.
Procedimiento12
Obtenga una muestra del problema de cido dbil y si es necesario squela.
Suponga que el peso equivalente del cido es aproximadamente 100, a menos que se le
indique otra cosa, y calcule el peso de la muestra que se neutralizar con menos de 40 ml
de hidrxido de sodio valorado.
Pese entonces la muestra (o en su caso tome una alcuota) y disulvala en
aproximadamente 50 ml de agua destilada, en un vaso de precipitados.
Calibre el medidor de pH utilizando las soluciones amortiguadoras y siguiendo las
instrucciones que se le proporcionen. Mientras no utilice el electodo indicador, colquelo
en solucin saturada de KCl.
Enjuague los electrodos con agua destilada y sumrjalos en el vaso de precipitados
que contiene la solucin del cido dbil. Mida el pH y antelo donde diga 0 ml de
titulante en su libreta.
Titule potenciomtricamente con la solucin valorada de NaOH 0.1 N. Agregue
incrementos grandes de base al principio. Conforme se acerque al punto final, aada
incrementos ms pequeos y por ltimo porciones de una o dos gotas, agregando por lo
menos 5 ml de titulante despus de haber alcanzado el punto final. Mantenga una
agitacin constante con ayuda del agitador magntico.
Clculos y reporte
Grafique la curva de titulacin del cido problema como pH vs. ml de NaOH
agregados.
Localice el punto de equivalencia usando el criterio de la primera y/o el de la
segunda derivada de la curva de titulacin, y grafquelas.
Calcule el peso equivalente del cido desconocido, y si conoce el nmero de
hidrgenos, determine su masa molecular.
Encuentre la(s) constante(s) de ionizacin del cido, tomando en cuenta que el pH
al 50 % de neutralizacin corresponde al pKa del cido (demustrelo).
12 El procedimiento de esta prctica se basa en el libro de Fritz y Schenk, pgs. 707-710.
42
Prcticas de laboratorio de Electroqumica y Corrosin
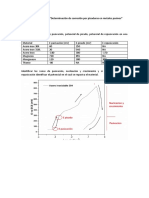
Titulacin de vitamina C
12
10
8
pH
10
20
30
ml NaOH
43
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #17 Medicin de pH en diferentes medios
Objetivo
Extraer un colorante natural a partir de col morada y utilizarlo como indicador de
pH de diferentes medios y comparar las mediciones empleando un electrodo de vidrio y
un medidor de pH.
Teora
Un indicador es una sustancia qumica que experimenta un cambio de color al
cambiar la acidez del medio en donde se encuentra. Esto permite determinar fcilmente
el pH sin necesidad de hacer una medicin formal. Existen muchos productos naturales
que pueden utilizarse como indicadores, ejemplos de tales sustancias son, los colorantes
de flores, frutas o algunas legumbres. En esta prctica se pretende extraer y utilizar un
colorante natural proveniente de la col morada y detectar los cambios de color que
experimenta en medios de diferente pH.
La medicin del pH se hace por medio de un electrodo de vidrio. El cual est
constituido por dos electrodos de referencia colocados en el cuerpo del electrodo
separados por una membrana de vidrio borosilicato con un contenido elevado de sodio.
Se mide la diferencia de potencial a travs de la membrana de vidrio por medio de los dos
electrodos de referencia. La diferencia de potencial resulta cuando la membrana de
vidrio de borosilicato intercambia tomos de sodio con iones hidrgeno en la solucin.
Existe un movimiento de carga a travs de la membrana por medio de tomos de sodio,
son estos iones los que establecen la comunicacin entre la solucin de prueba y el
compartimiento de referencia. Dentro del bulbo de vidrio existe un electrodo de
Ag/AgCl que sensa el potencial en esa fase. El potencial de la solucin exterior se
determina por medio de otro electrodo de Ag/AgCl conectado hacia el exterior a travs de
una membrana permeable.
Procedimiento
Conseguir una col morada y hervirla en agua para extraer el colorante, tambin se
pueden utilizarse ptalos de rosa o betabel. El colorante extrado se separa en tres partes
y se adiciona a cada uno de ellos una solucin de cido diluido como vinagre, una
sustancia neutra y una sustancia alcalina como hidrxido de potasio diluido. De manera
independiente se conecta el electrodo de vidrio al medidor de pp., se coloca las
soluciones amortiguadoras de 4, 7 y 10 en vasos de precipitado y se sigue la rutina de
calibracin sealada en el manual del equipo. Se introduce el electrodo de vidrio en cada
una de las soluciones de prueba y registra en una tabla el pH obtenidos. Algunas
sustancias recomendadas para la prueba pueden ser productos de uso cotidiano como
shampoo para el pelo, refrescos de cola, leche, sal de uvas, melox, vinagre, etc.
44
Prcticas de laboratorio de Electroqumica y Corrosin
Reportar
Una tabla de pHs de todas las sustancias ensayadas. Comentar acerca de los
valores de pH de productos como la leche, la coca cola, shampoo, etc. Qu determina el
pH de la coca cola?
45
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #18 Amperometra de dos electrodos
Objetivos
Conocer la tcnica de amperometra de dos electrodos y aplicarla en una titulacin
yodomtrica directa.
Emplear la tcnica de amperometra de dos electrodos para obtener la
concentracin de hipoclorito de sodio en un blanqueador comercial, determinada por
yodometra indirecta.
Construr el circuito elctrico necesario para llevar a cabo las titulaciones.
Teora
La amperometra de dos electrodos es una tcnica electromtrica que se emplea
para detectar el punto final de muchos tipos de titulaciones. Se basa en imprimir una
diferencia de potencial muy pequea (del orden de milivoltios) a dos electrodos
indicadores inertes. La corriente se monitorea en el transcurso de la titulacin, y
dependiendo de las caractersticas de reversibilidad de las reacciones involucradas, se
obtienen distintos tipos de curvas que permiten determinar el punto final del anlisis.
En esta prctica se realizar una titulacin biamperomtrica de yodo con tiosulfato
de sodio. La pareja yodo/yoduro es reversible electroqumicamente, mientras que la
pareja tiosulfato/tetrationato no lo es. El plan general para determinar un agente oxidante
mediante una titulacin de este tipo es:
+ I ( exceso ) A red + I2
+ 2 S O 2 2 I + S O 2
A ox
I
2
El yodo formado en la primera reaccin es equivalente a la cantidad de agente oxidante
en la muestra que se analiza. En esta reaccin, el yoduro (que se aade en forma de
yoduro de potasio o yoduro de sodio) se encuentra en gran exceso y no es una solucin
estndar. El yodo formado se titula con solucin estndar de tiosulfato de sodio y los
iones yoduro y tetrationato se forman como productos de la titulacin.13
La especie escasa es el yodo, mientras que el yoduro se encuentra en exceso.
Mientras exista el par inico yodo/yoduro, en un electrodo se oxidar yoduro a yodo,
mientras que en el otro ocurrir la reaccin opuesta. Esto mantendr fluyendo una
corriente en el circuito. Sin embargo, conforme agregamos tiosulfato con la bureta se
lleva a cabo la reaccin:
13 Fritz y Schenk, pg. 333.
46
Prcticas de laboratorio de Electroqumica y Corrosin
I2
+ 2 S2 O 3
2 I + S 4 O 6
de modo que la cantidad total de la especie I2 disminuir continuamente. Como el par
tiosulfato/tetrationato es irreversible, en el punto de equivalencia la corriente llegar a un
mnimo, y ya no aumentar ms con la adicin de titulante. Es por ello que algunas veces
a este mtodo de deteccin del punto final se le conoce como punto muerto.
En el primer experimento se determinar la cantidad de yodo presente en una
muestra de tintura de yodo, utilizada como antisptico (yodometra directa). En el
segundo experimento, se seguir el esquema general mostrado anteriormente para
determinar la cantidad de hipoclorito de sodio presente en un blanqueador para ropa
(titulacin indirecta de yodo).
Aparatos necesarios
Un multmetro capaz de medir corrientes en microamperios
Balanza analtica
Soporte universal
Pipetas graduadas de 2 5 ml
Bureta y pinzas para bureta
Vasos de precipitados
Agitador magntico
Dos electrodos de platino
Un circuito elctrico que permita aplicar entre los electrodos una diferencia de potencial
constante de 0.1-0.2 V. Se sugiere un arreglo sencillo14 que funciona a base de bateras, y
para el cual se necesitarn:
- Dos bateras AA de 1.5 V cada una
- Una resistencia de 100 K
- Un potencimetro (resistor variable) de 10 K
- Caimanes, soldadura y cables de conexin
14 Consltese la obra de Strobel, pg. 702, y la obra de Walton, pg. 265 para observar circuitos
alternativos.
47
Prcticas de laboratorio de Electroqumica y Corrosin
3V
100 K
Circuito para la
10 K
titulacin amperomtrica
celda
electroltica
Reactivos
Acido clorhdrico concentrado
Yoduro de potasio
Tintura de yodo
Blanqueador para ropa
Solucin 0.01 N de tiosulfato de sodio, que se prepara disolviendo 0.2482 g de Na2S2O35H2O en agua y aforando a 100 ml. La solucin debe ser estandarizada contra xido
arsenioso o contra yodo (ambos son estndares primarios). Si se desea estandarizar contra
yodo, disuelva 1.5-2.0 g de KI en 50 ml de agua destilada; agregue a la solucin 0.6345 g
de yodo resublimado pesados con exactitud de miligramos y afore a 100 ml. Etiquete la
solucin como yodo 0.05 N y embotllela en un recipiente color mbar. Proceda
entonces a valorar el tiosulfato.
Procedimiento
EXPERIMENTO #1: ANALISIS DE LA TINTURA DE YODO
Mida con la pipeta 1 ml de tintura de yodo comercial y virtala en un vaso de
precipitados donde se hayan colocado previamente los electrodos de platino. Agregue
agua destilada suficiente para cubrir los electrodos, adicione 2 gotas de HCl concentrado
y coloque sobre el agitador magntico.
Coloque las bateras al circuito elctrico y mida el potencial entre las terminales
utilizando un voltmetro sensible. Gire el cursor del potencimetro hasta que el aparato
registre una diferencia de potencial de 0.1-0.2 V y aplique entonces dicha diferencia de
potencial a los electrodos de platino de la celda electroqumica. Conecte el ampermetro
48
Prcticas de laboratorio de Electroqumica y Corrosin
en serie con el circuito con el fin de monitorear la corriente que circula por los electrodos.
Es sumamente importante recordar que el ampermetro debe conectarse en serie, pues si
por error se conectara en paralelo podra daarse irreversiblemente.
Titule el yodo agregando incrementos iguales (por ejemplo, de 0.5 ml) de la
solucin de tiosulfato de sodio 0.01 N. Mida la corriente despus de agregar cada
incremento y anote los datos de corriente y volumen de titulante. El punto de
equivalencia se encontrar cuando la corriente registre un mnimo y se mantenga en dicho
valor sin importar las subsecuentes adiciones de titulante.
EXPERIMENTO #2: DETERMINACION DE HIPOCLORITO EN UN
BLANQUEADOR
Pipetee 2 ml de blanqueador y diluya con agua destilada hasta completar 100 ml de
solucin. Tome una alcuota de 2 ml de la solucin anterior, colquela en un vaso de
precipitados que contenga agua destilada suficiente para cubrir los electrodos y agregue
2-3 g de KI. Acidifique la solucin aadiendo 3-5 gotas de cido clorhdrico concentrado
y titule con tiosulfato siguiendo las indicaciones del experimento anterior.
Clculos y reporte
EXPERIMENTO #1
Reporte la cantidad de yodo presente en la muestra como gramos de yodo por cada
100 ml de tintura. Compare sus resultados con el anlisis mostrado en la etiqueta del
producto y justifique las diferencias encontradas, si las hay.
EXPERIMENTO #2
Determine el porcentaje de hipoclorito de sodio en el blanqueador (gramos de
NaClO/gramos de blanqueador) y comprelo con el porcentaje de cloro activo que se
expresa en la etiqueta. Considere que la densidad de la solucin de blanqueador es 1
g/cm^3.
PROYECTO
Construya el circuito elctrico que se muestra y adptelo a alguna base, gabinete o
caja con el fin de conseguir la mejor presentacin posible del aparato. Procure darle un
aspecto comercial. Presntelo con su instructor al momento de entregar su reporte y
compruebe su funcionamiento con un voltmetro.
49
Prcticas de laboratorio de Electroqumica y Corrosin
PREGUNTAS
Justifique el empleo del tiosulfato de sodio como agente anticloro en los acuarios.
Qu esperara que ocurra al pH del agua al agregarle tiosulfato de sodio, si sta contiene
cloro disuelto?15
La sal de mesa contiene yodato de potasio como fuente de yodo para el ser humano.
Sabiendo que el ion yoduro es oxidado a yodo por el ion yodato de acuerdo a la reaccin:
IO 3
+ 5 I + 6 H + 3 I2 + 3 H 2 O
proponga un mtodo de anlisis para determinar la cantidad de KIO3 presente en una
muestra de sal de mesa.
Titulacin amperomtrica de yodo
con tiosulfato de sodio 0.01 N
2 0 .0 0
1 5 .0 0
i, A
1 0 .0 0
5 .0 0
0 .0 0
- 5 .0 0
0
1 0
12
V, ml
15 Para responder esta pregunta puede consultar el libro de Nekrsov, pg. 252.
50
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #19 Bateras
Objetivos
Establecer la curva de descarga de un acumulador de plomo cido en funcin del
tiempo y su densidad de corriente, ensayar conexiones en serie y en paralelo para
modificar voltajes y corrientes disponibles en una celda.
Teora
Una batera secundaria o celda de almacenamiento es una celda galvnica que
puede restablecerse o recargase repetidamente a sus condiciones originales. De las celdas
de almacenamiento el acumulador de plomo cido es el de uso ms comn. Todos los
automviles de combustin interna utilizan un acumulador de plomo cido para arrancar.
La FEM que desarrolla este tipo de celdas es de aproximadamente 2.2 V. Los electrodos
del acumulador de plomo cido estn compuestos inicialmente de los mismos materiales.
Una pasta consistente de una combinacin de xidos de plomo y cido sulfrico
presionados en una rejilla hecha de plomo. Estos son inmersos en una solucin de cido
sulfrico y es pasada una corriente directa a travs de la celda. El ctodo se transforma
en un plato de plomo esponjoso y el nodo en dixido de plomo. Las placas tienen un
rea elevada y son puestos cerca uno de otro para tener mejor conduccin y una
resistencia interna pequea, de alrededor de 0.001 .
Durante el ciclo de descarga la energa qumica se transforma en energa elctrica.
Tanto el ctodo como el nodo son convertidos a sulfato de plomo y agua. La accin
qumica se resume en las siguientes ecuaciones:
Pb + SO4= = PbSO4 + 2e2H+ + PbO2 + H2SO4 + 2e- = PbSO4 + 2H2O
___________________________________________
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O (reaccin en la celda)
Durante el ciclo de carga, la energa elctrica es convertida a energa qumica y la
celda es restablecida. La accin qumica se resume en las siguientes ecuaciones:
PbSO4 + 2e- = Pb + SO4=
PbSO4 + 2H2O = PbO2 + H2SO4 + 2 H+ + 2e________________________________________________
2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4
51
Prcticas de laboratorio de Electroqumica y Corrosin
Se observa que la reaccin en la celda es el inverso de la reaccin en la descarga.
Las dos reacciones pueden escribirse como una reaccin
Equipo
Mltimetro digital
Cables con caimanes
Cargador de bateras
Computadora con sistema de adquisicin de datos experimentales
Programa LabVIEW
Programa Virtual Bench, Data Logger
Foco de 2 V
Resistencia de 10
Reactivos
Placas de Pb y PbO2 rescatadas de un acumulador de plomo
Solucin 1 M de H2SO4
Procedimiento
Preparar una solucin de H2SO4 con una gravedad especfica de 1.3. A partir de
las placas de Pb/PbO2 rescatadas del acumulador recortar con una tijera de hojalatero un
pedazo de aproximadamente 5 cm de lado y pesarlo. Cortar un total de 10 placas de las
mismas dimensiones. Proceder a pesar cada placa y a etiquetarla para su identificacin
posterior. Colocar las placas en un recipiente de plstico de proporciones adecuadas para
ser acomodadas de manera vertical. Verter la solucin de cido sulfrico y a las placas y
medir inmediatamente la diferencia de potencial entre dos placas as como la temperatura.
Proceder a conectar por medio de un cable con caimanes una resistencia de 100 entre
dos placas para descargarlas.
En las terminales de la resistencia se colocan dos cables con caimanes para
monitorear la diferencia de potencial inicial y seguir el proceso de descarga en funcin
del tiempo. Para tener el registro del potencial en funcin del tiempo se conectan loas
alambres con caimn al canal 3 y 4 del sistema de adquisicin de datos experimentales
(SCB-68) NI. La adquisicin de los datos de voltaje en funcin del tiempo de descarga se
efecta usando el programa Data Logger. Se Conecta un multmetro digital en serie para
medir la corriente que circula en la celda. A partir de los datos de corriente, potencial y
peso de las placas se establece la densidad de corriente de la batera.
Una vez
descargadas las placas stas son recargadas nuevamente mediante un cargador de
bateras. Tome el tiempo de carga de la batera hasta el momento de observar
desprendimiento de gases en los electros de las bateras. Mida la cada de potencial en
los bornes en funcin empleando un multmetro digital.
Conectar una serie de tres celdas en serie y medir la diferencia de potencial
mediante el multmetro digital, conectar una diferencia de descarga y medir la cantidad
de corriente circulando en la celda. Hacer una conexin en paralelo y medir la diferencia
de potencial y la corriente en la celda.
52
Prcticas de laboratorio de Electroqumica y Corrosin
Reportar
Las reacciones ocurriendo en la celda en el proceso de descarga y carga de la
batera, la curva de descarga en funcin del tiempo. La densidad de corriente de la
batera. Los valores de corriente y potencial observados al conectar las bateras en serie y
en paralelo. De una representacin simplicada del acumulador de plomo y evalu la FEM
terica esperada. Evalu tambin la densidad de energa esperada en funcin del peso de
plomo y xido de plomo empleados en el experimento. Cuales son los factores que
pueden determinar el decaimiento del acumulador de plomo.
53
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #20 Electrodo detector de O2
Objetivo
Construir un electrodo sensor de oxgeno del tipo Clark utilizando una membrana de
tefln y acetato.
Teora
El electrodo sensor de oxgeno fue desarrollado por Clark en 18XX. Es un
electrodo cuyo funcionamiento depende directamente de una membrana permeable al
oxgeno. Esta formado por dos electrodos uno de Ag/AgCl y otro de platino. Entre
ambos electrodos se aplica una diferencia de potencial con una fuente de poder exterior o
una batera. El oxgeno que se difunde a travs de la membrana que normalmente
esacetato de celulosa celofn o de tefln reacciona en el electrodo de plation formando
perxido de hidrgeno. La cantidad de oxgeno se detecta a partir de la medicin de la
corriente de oxidacin de O2 a perxido de hidrgeno. La medicin de la corriente se
hace directamente por medio de un multmetro digital. La membrana de polmero
determina la selectividad para la deteccin de oxgeno en particular. Otras membranas
permten sensar gases como CO2 y SO2 , aunque la medicin es directamente de cambios
el el pH del medio inducidos por el paso del gas que se desea detectar a travs de la
membrana.
Procedimiento
Se prepara un electrodo de Ag/AgCl de acuerdo al procedimiento descrito en el
experimento 3. Enseguida se introduce dentro de un tubo de ensayo a l cual se ha limado
la parte inferior. Se coloca alrededor de la abertura un pedazo de cinta de tefln y se
ajuata por medio de una liga. En el interior se coloca una solucin saturada de cloruro de
potasio. Se coloca un tapn. Los extremos del electrodo de platino y de Ag/AgCl se
conectan a una fuente de poder regula o una batera. La diferencia de potencial entre los
electrodos es de 0.6 V. El multmetro se conecta en serie para medir la cantidad de
corriente que circula en la celda. Para calibrar se utiliza agua destilada a diferentes
temperaturas. Se utilizan datos reportados en la literatura para hacer una curva de
calibracin O2 vs. corriente. Hay que tomar en cuenta que los datos estn dados a una
presin absoluta de 760 mm de Hg. Para hacer la correccin es necesario calcular la
presin parcial multiplicando la presin total del lugar por la fraccin mol del aire (0.21).
54
Prcticas de laboratorio de Electroqumica y Corrosin
Reportar
La curva de corriente vs. temperatura del agua. La curva de calibracin de O2 vs.
temperatura del agua. Las mediciones de la concentracin de O2 en agua de la llave y
una solucin de agua con fructuosa.
55
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #21 Electrodo detector de tensoactivos
Objetivo
Preparar un electrodo sensor de tensoactivos empleando una membrana de PVC.
Teora
Un tensoactivo o surfactante es una molcula amfiflica que se caracteriza por
tener una parte polar y otra no polar en la misma molcula. Ejemplos de este tipo de
molculas son los jabones y detergentes, asimismo, cristales capaces de formar cristales
lquidos y paredes celulares. Es importante contar con mediciones de tensoactivos es
particular en medios contaminados como sonda para detectar el tipo de estructura
molecular presente. Los electrodos de tensoactivos permiten detectar la concentracin
crtica micelar de sistemas amfiflico.
Procedimiento
Preparar una membrana selectiva a partir de polvo de PVC y un poco del
tensoactivo que se desea detectar. Se incorpora en la membrana un poco de plastificante
ftalato de di-octilo para evitar que la membrana se vuelva quebradiza. Una vez preparada
la membrana se coloca en un tubo de ensaye al cual se le ha removido la parte inferior.
Se coloca la membrana en un extremo. En la parte interior se colocan dos electrodos de
Ag/AgCl a los cuales se les aplica una diferencia de potencial. Se prepara una serie de
soluciones de diferente concentracin y se mide el voltaje desarrollado ente ellas. Se
prepara una curva de calibracin se prepara una solucin de concentracin desconocida
par probar el sensor.
Reportar
Las curvas de calibracin del electrodo sensor voltaje vs. concetracin de
tensoactivo.
56
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #22 Recubrimiento de cobre alcalino
Objetivo
Realizar un recubrimiento electroltico de cobre por el mtodo alcalino.
Teora
Los recubrimientos electrolticos de cobre son relativamente sencillos de obtener, y
son empleados con mucha frecuencia como una etapa preliminar antes de recubrir con
cualquier otro metal al sustrato. El cobre permite la adherencia de los recubrimientos de
metales ms valiosos tales como nquel, plata, cromo y algunos otros, por lo que se
emplea extensamente como paso intermedio en procesos de electroplateado ms
complejos.
Al salir del bao galvnico, los depsitos de cobre son brillantes y de color rojo.
Fcilmente se opacan al contacto con el aire, por lo que se recomienda secar las piezas en
cuanto salen del bao y pulirlas con algn producto que deje una capa protectora que
impida la oxidacin del recubrimiento.
Se conoce un gran nmero de frmulas para preparar soluciones de cobrizado
electroltico; se acostumbra nombrarlas por grupos, tales como los baos de cobre cido
(como el que se emple en la prctica de distribucin de corriente y potencial), de cobre
alcalino, de cianuro, de fluoborato, de pirofosfato y otros. Cada uno de ellos puede
encontrarse descrito a fondo en la bibliografa sobre el tema.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Lmina de cobre (nodo).
Lmina de latn (ctodo).
Solucin de cobrizado en medio alcalino:
Cu(CN)2
11.25 g
KCN
21.25 g
KOH
5
g
Sal de Rochelle16
11.25 g
Las cantidades son para preparar 250 ml de solucin.
16 Tartrato doble de sodio y potasio, llamado tambin sal de Seignette.
57
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
Limpie la superficie de acuerdo con las instrucciones generales que se mencionan
al principio de esta seccin de prcticas y proceda al electrorrecubrimiento, teniendo
cuidado de no tocar el metal con los dedos (utilizar pinzas).
OBTENCION DEL RECUBRIMIENTO DE COBRE
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo una placa de cobre previamente preparada
como se indic, y como ctodo una placa de latn. Las condiciones recomendadas para el
recubrimiento son:
pH
8-10
2
j, A/dm
1-3, mejor el valor inferior
Agitacin
favorable, con aire
Temperatura, C
45-60
Tiempo, min
3
Saque las placas del bao galvnico, enjuguelas con agua, squelas con una toalla
de franela suave y si lo desea plalas.
Reporte e investigacin
Investigue que sustancias qumicas se emplean como aditivos para mejorar la
apariencia de los depsitos de cobre (abrillantadores, agentes tensoactivos, etc.). Si es
posible, someta alguno a prueba y obtenga sus propias conclusiones sobre su efectividad.
Consulte la bibliografa apropiada y reporte las frmulas de por lo menos tres baos
de cobrizado electrolticos distintos al que utiliz en su prctica. Si es posible, incluya
tambin las condiciones de operacin para cada bao.
58
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #23 Recubrimiento de nquel
Objetivo
Realizar un recubrimiento electroltico de nquel utilizando una modificacin de la
solucin de Watts clsica.
Teora
El nquel es un metal de brillo argentino, duro, resistente al desgaste y a la
corrosin. Sus caractersticas de dureza y duracin hacen que se utilice mucho para
acuar monedas, en la fabricacin de acero inoxidable y para construr equipo empleado
en la industria qumica.
Los diferentes baos de electrorrecubrimiento con nquel proporcionan distintos
acabados del depsito. Por ejemplo, existen frmulas para depositar nquel negro, una
forma ennegrecida del metal que tiene aplicacin en superficies absorbentes de luz,
acabado de armas de fuego, partes de mquinas de escribir, joyera y ornamentos.
Normalmente los depsitos de nquel brillante se emplean como recubrimientos
decorativos y de proteccin contra la corrosin, as como en electroformado de piezas
mecnicas donde la dureza es importante. Tambin puede usarse como una capa previa
antes de aplicar un recubrimiento de plata.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Lmina de nquel electroltico o carbn laminado (nodo).
Lmina de latn (ctodo).
Solucin de niquelado:
NiSO4 6 H2O
85
g
NiCl26 H2O
28.3 g
H3 BO3
12.7 g
Las cantidades son para preparar 250 ml de solucin. La solucin es ms fcil de preparar
en caliente (50 C).
59
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
Limpie la superficie de acuerdo con las instrucciones generales que se mencionan
al principio de esta seccin de prcticas y proceda al electrorrecubrimiento. La limpieza
de la superficie es crtica para la obtencin de un buen niquelado.
OBTENCION DEL RECUBRIMIENTO DE NIQUEL
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo una placa de nquel purificado
electrolticamente, o bien un trozo de carbn laminado (grafito). El ctodo ser la placa
de latn. Las condiciones recomendadas para el recubrimiento son:
pH
2-5
2
j, A/dm
1-10, mejor el valor inferior
Agitacin
favorable, con aire
Temperatura, C
50-65
Tiempo, min
2
El depsito se hace ms brillante a valores bajos de pH; A valores altos de pH es
conveniente disminuir la densidad de corriente. Es muy importante evitar la
contaminacin de la solucin con iones cuprosos, ferrosos, de zinc o cromo hexavalente,
por lo que deben usarse nodos inertes o de la mayor pureza posible.
Reporte e investigacin
Investigue que sustancias qumicas se emplean como aditivos para mejorar la
apariencia de los depsitos de nquel. Si es posible, someta alguno a prueba y obtenga sus
propias conclusiones sobre su efectividad. Averige otros usos de los depsitos de
nquel e investigue frmulas y condiciones para otros baos de nquel que no se
mencionan aqu (fluoborato, de cloruros, de sulfamato, etc).
60
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #24 Recubrimiento de cromo
Objetivo
Realizar un cromado electroltico con solucin de cido crmico sobre un metal
previamente niquelado.
Teora
El cromo, un metal fundamental en la tcnica moderna, fue descubierto en 1797 por
Vauquelin. Es un metal pesado, duro, de brillo argentino, cuyos compuestos
generalmente muestran coloraciones intensas y son empleados como pigmentos. Se
extrae del mineral cromita y se utiliza extensamente en la fabricacin de aleaciones de
hierro (aceros inoxidables), para construir resistencias elctricas de precisin y como
recubrimiento.
Los recubrimientos de cromo se emplean con fines decorativos sobre cobre y
nquel, pues estos ltimos pueden aplicarse sobre cualquier metal base. Algunas
herramientas de hierro y acero se recubren con capas de cromo con el fin de darles
dureza, por ejemplo en dados, calibradores y tarrajas; como capa protectora en
electrotipos, placas de grabado y otros objetos, y para mejorar la lubricacin y disminuir
el desgaste en pistones y cilindros de los motores de combustin.
La solucin para cromar tiene una baja eficiencia, y el xito de la operacin
depender a menudo de la manera en que se coloquen suspendidos los artculos en el
bao. En algunos casos puede ser necesario disponer de varios nodos a fin de asegurar
una distribucin de corriente ms uniforme y con ello un depsito ms satisfactorio.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Aleaciones de Pb-Sn, Pb-Sb, Pb o Sn puro (nodo).
Una lmina de latn previamente niquelada (ctodo).
Solucin de cromado:
CrO3
47
g
H2SO4 concentrado (densidad 1.84 g/cm 3 )
0.21 ml
Las cantidades son para preparar 250 ml de solucin. La solucin se prepara disolviendo
el trixido de cromo ("cido crmico") en agua destilada caliente a 60 C. Una vez
terminada la disolucin se agrega el cido sulfrico.
61
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
El cromado se realiza sobre una placa de latn previamente niquelada de acuerdo
con el procedimiento de la prctica anterior, pues no se obtienen buenos resultados
directamente sobre el latn. Si se quiere aumentar la adherencia del depsito de cromo,
anodice la placa a j=10 A/dm2 en el bao de cromado durante 15-30 segundos y despus
invierta la corriente para obtener el recubrimiento.
OBTENCION DEL RECUBRIMIENTO DE CROMO
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo una placa de plomo, estao o una aleacin de
estos metales. El ctodo ser la placa de latn previamente niquelada. Las condiciones
recomendadas para el recubrimiento son:
pH
cido, determinado por el H2SO4
j, A/dm2
6-10
Agitacin
no indispensable
Temperatura, C
45-50
Tiempo, seg
15
La razn entre los gramos de CrO3 y los gramos de H2SO4 debe mantenerse
cercana a 100, agregando trixido de cromo cuando sea necesario. Los iones hierro, cobre
y el exceso de Cr III perturban la reaccin. La eficiencia es baja (menor al 15 %) y se
requieren densidades de corriente altas, reportando la literatura valores entre 13 y 80
A/dm2 .
Reporte e investigacin
Investigue otras frmulas que se empleen con xito en la obtencin de
recubrimientos de cromo Es alta su eficiencia ?
La relacin CrO3 / H2SO4 es un parmetro importante para el control de la calidad
de los depsitos de cromo. Obtenga el valor de dicha relacin para las frmulas que
report en el apartado anterior y comprelo con el valor optimo de 100 que se sugiere
en esta prctica.
Los nodos que se emplean en el cromado, como ya se mencion, estn formados
fundamentalmente de plomo y otro metal, que suele ser antimonio o estao. Consulte la
bibliografa y averige en qu proporcin se encuentran los metales en la aleacin
andica.
Si le es posible, someta a prueba algn aditivo y observe su efecto en el
recubrimiento. Haga una evaluacin de la calidad del recubrimiento: reporte brillo,
uniformidad, color y cualquier otra caracterstica que considere relevante.
62
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #25 Recubrimiento de cinc: galvanizado electroltico
Objetivo
Llevar a cabo el galvanizado electroltico de una lmina de latn, con el mtodo
alcalino.
Teora
El zinc, cuyo nombre probablemente proviene de la palabra alemana zin, que
significa estao, fue descubierto y empleado por primera vez en el siglo VI en Persia. Es
un metal gris azulado, quebradizo a temperaturas normales, relativamente blando y con
un alto coeficiente de dilatacin trmica. Es muy activo qumicamente y tiene gran
tendencia a oxidarse. El zinc de ms alta calidad (99.999 %) se obtiene por refinacin
electroltica del zinc bruto (97-98 %).
Cerca de la mitad de la produccin mundial de Zn se consume en procesos de
galvanizado de hierro. Otros usos son: obtencin de latn y sus aleaciones, construccin
de bateras, en pinturas, en polvo como agente reductor y como nodo de sacrificio en
instalaciones de proteccin catdica contra la corrosin (barcos, plataformas petroleras
marinas, puentes, etc.).
Al hierro recubierto con zinc se le conoce como hierro galvanizado, de donde viene
el nombre genrico que se le da a los recubrimientos de zinc sobre otros metales. El
galvanizado protege al hierro de la oxidacin a un costo bastante bajo. Tambin se usa en
menor medida el galvanizado brillante con fines decorativos.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Lmina de zinc,o en su defecto acero (nodo).
Lmina de latn (ctodo).
Solucin alcalina para galvanizado:
ZnO
9.4
g
NaCN
21
g
NaOH
20
g
Las cantidades son para preparar 250 ml de solucin. La solucin se prepara agregando
en orden agua destilada, cianuro de sodio, hidrxido de sodio y xido de zinc.
63
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
OBTENCION DEL RECUBRIMIENTO DE CINC
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo la placa de cinc. Si utiliza acero, la
concentracin de zinc en el bao tendr que controlarse con frecuentes adiciones de ZnO.
El ctodo ser la placa de latn. Las condiciones recomendadas para el recubrimiento
son:
pH
alcalino, dado por el hidrxido de sodio (pH >13)
j, A/dm2
1-5, se recomienda el valor medio
Agitacin
favorable, mecnica
Temperatura, C
30
Tiempo, min
2
Se recomienda mantener la relacin de gramos de NaCN entre gramos de ZnO
cercana a 2. La densidad de corriente puede aumentarse hasta 8 A/dm2 sin quemar la
chapa, pero se reduce la eficiencia y el aumento en la velocidad de depositacin no es
apreciable. Carbonatos, sulfatos y cloruros merman la eficiencia del depsito.
Para producir chapado brillante puede agregarse glucosa, gelatina, melaza, betanaftol, glicerina y muchos otros tensoactivos. Su concentracin se regula por inspeccin
peridica de las piezas.
Reporte e investigacin
Someta a prueba algn aditivo y evale el efecto obtenido en el recubrimiento.
Investigue como se lleva a cabo el galvanizado no electroltico del hierro. Estime
ventajas y limitaciones de ambos mtodos.
Mencione otras frmulas de soluciones para galvanizado electroltico (por ejemplo,
galvanizado cido y al cianuro) incluyendo las condiciones de operacin recomendadas
para cada una de ellas y, si es posible, caractersticas y usos particulares del
recubrimiento que se obtiene.
64
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #26 Recubrimiento de cadmio
Objetivo
Obtener un recubrimiento electroltico de cadmio en solucin alcalina.
Teora
El cadmio es un metal de color blanco argentino, maleable y estable en condiciones
normales. Fue descubierto en 1817 por Stromeyer. Se obtiene a partir de los minerales del
zinc y se purifica por electrlisis. Los vapores y las sales del metal son venenosos.
Los recubrimientos electrolticos de cadmio se emplean sobre metales ferrosos para
protegerlos de la corrosin, y en partes mviles donde los productos de la oxidacin del
zinc podran ser contraproducentes, especialmente en equipo e instrumentos de
comunicaciones. Tambin tienen aplicacin cuando es importante evitar la fragilidad por
hidrgeno en los aceros.
El metal puro tiene usos limitados: se emplea en la preparacin de aleaciones de
bajo punto de fusin, para soldaduras, como fusible en sistemas elctricos, para construir
bateras recargables de Ni-Cd y en los reactores nucleares de fisin para controlar las
reacciones en cadena (absorbe neutrones). Su brillante sulfuro encuentra uso como
pigmento.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Cadmio metlico (nodo).
Lmina de latn (ctodo).
Solucin para el recubrimiento:
CdO
4.5
g
NaCN
32
g
NaOH
3.75 g
Las cantidades son para preparar 250 ml de solucin. La solucin se prepara agregando
en orden agua destilada, cianuro de sodio, hidrxido de sodio y xido de cadmio.
65
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
OBTENCION DEL RECUBRIMIENTO DE CADMIO
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo la placa de cadmio. Lvese muy bien las manos
si toca el metal; evite aspirar los vapores. El ctodo ser la placa de latn. Las
condiciones recomendadas para el recubrimiento son:
pH
alcalino, dado por el hidrxido de sodio
2
j, A/dm
1-3, mejor el valor inferior
Agitacin
no indispensable, puede hacerse con aire
Temperatura, C
30
Tiempo, min
2
Se recomienda mantener la relacin de gramos de NaCN entre gramos de CdO
cercana a 7. La eficiencia catdica est entre 70-95 %. Vigilar que la temperatura se
mantenga en el rango de 30 2.5 C. La absorcin de CO2 del aire provoca la formacin
de carbonato de sodio, que disminuye la eficiencia. Para eliminarlo, se puede enfriar la
solucin a -1 C o precipitarlo con sulfato de calcio.
Reporte e investigacin
Investigue o sugiera otros usos para los recubrimientos de cadmio. Es posible
emplearlos en objetos que van a estar en contacto con alimentos?
Someta a prueba algn aditivo y evale el efecto obtenido en el recubrimiento.
Existen relativamente pocas frmulas para baos galvnicos con cadmio. Si le es
posible encontrar una distinta a la aqu empleada, inclyala en su reporte junto con las
condiciones de operacin y posibles usos.
66
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #27 Plateado
Objetivo
Llevar a cabo un recubrimiento electroltico de plata con una solucin de cianuro.
Teora
La plata fue uno de los primeros metales que se logr depositar por medios
electrolticos. La superficie blanca y brillante del metal es muy atractiva a la vista, y se
pule y conserva fcilmente en buen estado excepto en atmsferas muy contaminadas,
donde el ennegrecimiento de los objetos de plata por formacin de una capa de sulfuro es
ms bien la regla que la excepcin.
Los recubrimientos de plata se clasifican en dos grandes grupos: decorativos y de
ingeniera. Gran cantidad de objetos de joyera se recubren con capas delgadas de plata
para darles una apariencia ms atractiva. Cubiertos de mesa, vajillas, teteras, bateras de
cocina, adornos, candiles, relojes y otros artculos de uso cotidiano pueden llevar un
recubrimiento de plata brillante. Mencin especial merecen los espejos, en donde el metal
se deposita sobre un soporte de vidrio pulido transparente. Generalmente en la
fabricacin de espejos no se emplean tcnicas electrolticas, sino pulverizacin del metal
o bien reduccin del ion plata con agentes reductores suaves, tales como la glucosa y el
formaldehdo. En la actualidad, el aluminio compite con la plata en la manufactura de
estos artculos.
En ingeniera, la plata encuentra aplicacin como recubrimiento para reducir la
friccin en piezas mviles tales como baleros y chumaceras. La industria electrnica
tambin la utiliza, por su excelente conductividad elctrica.
Los artculos de acero o metales ferrosos que se tengan que platear debern ser
recubiertos antes con nquel o con soluciones especiales de recubrimiento previo (striking
baths) con plata a fin de asegurar la adherencia del depsito, especialmente si se desea
una capa gruesa del metal.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Plata 99.95 % de pureza (nodo).
Lmina de latn previamente cobrizada o niquelada (ctodo).
Solucin para plateado:
KOH
1.88 g
67
Prcticas de laboratorio de Electroqumica y Corrosin
KCN
K2CO3
5.62
37.5
g
Las cantidades son para preparar 250 ml de solucin. Los componentes se disuelven en
agua destilada en el orden en que se mencionan, se agrega 1 g de carbn activado por
cada litro de solucin y se deja reposar durante dos horas. Posteriormente se filtra y se
embotella en un frasco de color mbar.
Procedimiento
OBTENCION DEL RECUBRIMIENTO DE PLATA
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo la lmina de plata y como ctodo la placa de
latn, que debe estar previamente cobrizada o niquelada de acuerdo a los procedimientos
ya conocidos. Las condiciones recomendadas para el plateado son:
pH
alcalino, dado por el hidrxido de potasio y el
cianuro
j, A/dm2
0.5-2.5
Agitacin
favorable, mecnica (no por aire)
Temperatura, C
25 2
Tiempo, min
2
El plateado tiene una eficiencia catdica cercana al 100 %. Si la placa se limpi con
algn detergente, eliminarlo completamente mediante un enjuague cuidadoso para evitar
obtener un depsito opaco. Las densidades de corriente altas y la presencia de reductores
enrgicos predisponen a la formacin de depsitos quemados de plata negra pulverulenta,
muy poco adherente.
Reporte e investigacin
Investigue posibles aditivos para mejorar la apariencia del recubrimiento. No se
recomiendan los tensoactivos (detergente).
Incluya al menos dos frmulas de soluciones para recubrimiento previo de metales
ferrosos y sus condiciones de operacin.
En el mercado existen preparados capaces de platear objetos de cobre, latn y otros
metales sin necesidad de corriente elctrica, simplemente frotando el metal con el polvo o
la solucin para platear. De qu podra estar compuesto un polvo o lquido para platear?
Puede serle de ayuda consultar un recetario industrial.
El coulombmetro de plata es un aparato que puede emplearse en algunas tcnicas
electroanalticas para determinar la cantidad de corriente que pasa por un circuito.
Sugiera una razn por la cual se eligi a la plata como el metal a depositar. Por qu no
existen coulombmetros de cromo?
68
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #29 Lpiz decorador de bisutera
Objetivo
Preparar un lpiz de decorador a partir de marcador comercial.
Teora
Una herramienta importante en el decorado de piezas de joyera es el lapiz
decorador. El lapiz decorador consiste en un cuerpo metlico dentro del cual se
encuentra un material poroso o una solucin de cianuro urico que sirve para recubrir
piezas de joyera de fantasa. El decorado normalmente se hace sobre materiales
recubiertos de una pelcula de plata. En los cuales se aplica posteriormente una pelcula
de oro. El lapiz decorador es el nodo y la pieza a dorar el ctodo.
Procedimiento
Se utliza para este fin un marcador comercial al cual se le ha agotado la tinta. Los
marcadores ms apropiados son aquellos que no utilizan esponjas o material de relleno.
Se perfora un extremo del marcador y se introduce una solucin de cianuro urico similar
a la utilizada en la prctica 28. Se coloca un alambre de oro que acta como nodo. La
pieza a recubrir es planteada inicalmente antes de llevar a cabo el proceso de decorado.
69
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #30 Latonado
Objetivo
Depositar electrolticamente una aleacin de cobre y zinc (latn).
Teora
El latn es una aleacin de cobre y zinc, de color dorado y de fcil pulimento. No
es muy resistente a la corrosin, pero su apariencia es agradable y puede conservarse
brillante con si se pule con frecuencia. Existen muchas frmulas para las aleaciones de
latn dependiendo de las proporciones de cobre y zinc que la forman; una de las ms
comunes es el latn de 70 % Cu y 30 % Zn.
Las soluciones de latonado contienen cianuros de cobre y de zinc en solucin. La
aleacin depositada tendr ciertas variaciones de acuerdo con las condiciones del
recubrimiento y la composicin del nodo. El latonado se utiliza principalmente como
acabado ornamental para el acero y piezas ornamentales, por ejemplo plafones para
iluminacin, candiles, artesanas, etc. Puede usarse como recubrimiento previo para el
niquelado del aluminio y de piezas fundidas de zinc. Pueden latonarse muchas piezas
pequeas (por ejemplo, botones) colocndolas dentro de un cilindro metlico o barril que
gira dentro del bao electroltico.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y un recipiente que servir de celda electroltica.
Reactivos
Lmina de latn de la misma composicin que se desea depositar (nodo).
Una placa de nquel u otro metal previamente niquelado (ctodo).
Solucin para latonado:
Cu(CN)2
6.75 g
Zn(CN)2
2.25 g
NaCN
13.5 g
Na2CO3
7.5
g
Las cantidades son para preparar 250 ml de solucin.
Procedimiento
OBTENCION DEL RECUBRIMIENTO DE LATN
70
Prcticas de laboratorio de Electroqumica y Corrosin
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Coloque como nodo la lmina de latn y como ctodo la placa de
nquel o de latn previamente niquelado de acuerdo a los procedimientos ya conocidos.
Las condiciones recomendadas para el recubrimiento son:
pH
10.5
j, A/dm2
0.5-4, parece que es mejor el lmite inferior
Agitacin
conveniente, mecnica
Temperatura, C
25-40
Tiempo, min
3
La eficiencia se encuentra entre 35-50 %. El pH debe mantenerse en su valor
ptimo para obtener uniformidad en la composicin de la chapa.
Reporte e investigacin
Utilice algn aditivo para observar su efecto en el aspecto del recubrimiento.
Calcule la composicin probable de la aleacin electrodepositada, a partir de la
composicin de la solucin. Reprtela como porcentaje de cobre y zinc.
Consiga una frmula que permita electrodepositar latn de una composicin
distinta a la que aqu se ofrece.
71
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #31 Anodizado y coloreado de aluminio
Objetivo
Llevar a cabo el anodizado de aluminio en solucin cida para obtener un
recubrimiento decorativo.
Teora
Algunos metales, como por ejemplo el aluminio, titanio y cromo, tienen tendencia a
cubrirse de pelculas de xido estables en su superficie que los protegen de posterior
corrosin. La formacin de esta capa de xido puede favorecerse conectando el metal al
nodo de una cuba electroltica, donde sufrir una reaccin de oxidacin. Por la razn
antes expuesta, este proceso se conoce como anodizado.
En el caso del aluminio, la pelcula superficial de xido es continua y porosa.
Protege al metal contra la corrosin y adems es posible colorearla con fines decorativos.
La capa porosa presenta una estructura celular hexagonal con un poro central cilndrico.
Aunque es aislante trmica y elctrica, su porosidad permite que exista continuidad
elctrica entre el circuito externo y el electrolito.
Una vez cubierta la pieza de una capa de xido poroso, se somete a un tratamiento
con agua caliente, proceso que recibe el nombre de colmatacin. La capa de xido se
vuelve menos porosa y protege ms al metal. Posteriormente puede convertirse la pelcula
transparente en una coloreada por inmersin en una solucin que contiene el colorante,
por deposicin catdica a partir de iones metlicos o por anodizacin autocolorante.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica, un recipiente de 250 ml de capacidad para
realizar el teido y otro que servir de celda electroltica.
Reactivos
Aluminio en lmina o perfiles (nodo).
Lminas o barras de plomo (ctodo).
Solucin de anodizado:
Es una solucin acuosa de H2SO4 concentrado 5-20 % volumen.
Solucin de teido:
Disolver 50 g de colorante para textiles o algn otro que se desee probar en 250 ml de
agua destilada caliente (60-75 C). Si es necesario, acidificar con cido actico hasta
lograr la disolucin.
72
Prcticas de laboratorio de Electroqumica y Corrosin
Procedimiento
En esta prctica el procedimiento de limpieza de la placa de aluminio es distinto;
basta con limpiarla con bicarbonato y agua, enjuagar, limpiar con detergente frotando en
fro, enjuagar y sumergirla en una solucin diluda (10 %) de hidrxido de sodio caliente.
Dependiendo de qu tan enrgica sea la disolucin, se deja el aluminio por un mximo de
60 segundos, se enjuaga con agua destilada y se procede al anodizado.
ANODIZADO
Monte una celda electroltica de tamao apropiado para contener aproximadamente
250 ml de solucin. Anodice el aluminio empleando un ctodo de plomo y las siguientes
condiciones de operacin:
pH
el de la solucin cida de anodizado
j, A/dm2
3-6
Agitacin
no imprescindible
Temperatura, C
25
Tiempo, min
6
TEIDO DEL ALUMINIO
Se pasa la placa anodizada de inmediato al bao colorante y se sumerge en el
mismo durante un tiempo de 2-3 minutos o hasta que se observe que no se adsorbe ms
colorante. Enjuague la placa con agua y deje secar.
Reporte e investigacin
La literatura reporta que los colores obtenidos en el anodizado son ms intensos
si las soluciones de cido son concentradas. Intente comprobar este efecto.
Utilice tantos colorantes como sea posible (para textiles, orgnicos, minerales, de
distintas marcas, etc.) y evale la calidad de cada muestra obtenida en base a parmetros
tales como firmeza del color, presencia de zonas jaspeadas o sin teir, acabado opaco o
brillante, etc. Reporte sus conclusiones sobre el mejor colorante.
Para el proceso de anodizado en cido sulfrico, la literatura reporta valores
distintos para la densidad de corriente, el voltaje y el tiempo empleado en el anodizado
dependiendo de la fuente consultada. Obtenga esta informacin en la bibliografa
especializada y llegue a sus propias conclusiones acerca de las condiciones de operacin
sugeridas en esta prctica.
Adems del proceso de anodizacin con cido sulfrico, se conocen los procesos
del cido crmico y del cido oxlico. Elija uno de ellos e investigue las condiciones de
operacin, frmula del bao y ventajas y desventajas de dicho proceso comparado con la
anodizacin con cido sulfrico.
73
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #32 Metalizado de plsticos
Objetivo
Realizar un recubrimiento metlico en un plstico por medio del mtodo
"electroless".
Teora
Los recubrimientos metlicos sobre plstico son relativamente recientes, y pueden
obtenerse por varios mtodos. En la actualidad es comn disfrutar de dulces y alimentos
envueltos en bolsas de plstico aluminizado, que disminuyen el deterioro causado por la
luz. Los aparatos electrodomsticos incluyen piezas plsticas metalizadas (generalmente
cromadas), tales como botones, interruptores y controles. Lo mismo ocurre con artculos
de escritorio y juguetes.
Dentro de las tecnologas de almacenamiento de datos, los CD-ROM, discos
compactos, minidiscos y videodiscos son ejemplos de soportes en los que una pelcula
metlica de aluminio se deposita sobre un sustrato plstico que la protege del deterioro
ambiental. Estas pelculas, sin embargo, no se depositan por mtodos electroqumicos,
sino por medios fsicos.
Aparatos necesarios
Un rectificador por medio del cual pueda controlarse la corriente y el voltaje,
caimanes, termmetro, parrilla elctrica y varios vasos de precipitado u otros recipientes
similares.
Reactivos
Una placa de plstico, por ejemplo, polietileno17 . La placa deber ser lo ms lisa posible y
no tener grabados complicados.
Solucin limpiadora:
Na2CO3
20
g
NaOH
5
g
Detergente
2
g
Aforar con agua hasta 1000 ml
Solucin oxidante:
K2Cr2O7
50
g
H2SO4 concentrado
50
ml
H2O
120 ml
17 Puede obtenerse como material de desecho de los envases para productos alimenticios.
74
Prcticas de laboratorio de Electroqumica y Corrosin
Solucin sensibilizadora:
SnCl2
60
g
HCl concentrado
60
ml
Solucin activadora:
PdCl2
0.1
g
HCl 0.01 M
200 ml
Soluciones para el metalizado electroless:
En el momento de usarse, se mezclan a partes iguales las soluciones A y B
Solucin A:
CuSO45 H2O
14
g
NiCl26 H2O
4
g
Formaldehdo, sln. concentrada
52
ml
Disolver en 1000 ml de agua destilada
Solucin B:
Sal de Rochelle18
45
g
Na2CO3
4
g
NaOH
11
g o hasta conseguir 11<pH<12
Disolver en 1000 ml de agua destilada
Solucin para el electrorrecubrimiento:
Se usa la solucin de cobre cido que se emple en la prctica de distribucin de
corriente y potencial, con j 0.5 A/dm^2 durante 3 minutos a temperatura ambiente.
Procedimiento
PREPARACION DE LA PLACA DE PLASTICO
Limpiar la placa de la suciedad y el aceite sumergindola en la solucin
limpiadora concentrada y caliente durante 15 minutos, entre 50 y 60 C. Enjuagar con
agua destilada o corriente y pasar a la solucin oxidante.
OXIDACION
Deje las placas en la solucin oxidante durante 5 minutos a 70 C. Lave con agua
tibia y despus con agua corriente. Si el tratamiento fue exitoso, la pelcula de agua debe
adherirse al polietileno en forma uniforme, lo que demuestra que el plstico se ha vuelto
hidroflico. Proceda a la sensibilizacin.
SENSIBILIZACION
Sumerja las placas en la solucin sensibilizadora a temperatura ambiente por 3
minutos. Lave con agua corriente, luego con agua destilada y proceda a la activacin.
ACTIVACION
Se colocan las placas en la solucin cida de cloruro de paladio por 3 minutos. Se
lavan con agua corriente, luego con agua destilada y se contina con el depsito
electroless.
18 Tartrato doble de sodio y potasio
75
Prcticas de laboratorio de Electroqumica y Corrosin
DEPOSITO ELECTROLESS
El recubrimiento electroless se lleva a cabo por inmersin de las placas en una
mezcla a partes iguales de las soluciones A y B a temperatura ambiente durante 20
minutos. Cuando las placas tengan una capa delgada y uniforme de cobre se procede al
recubrimiento galvnico.
ELECTRORRECUBRIMIENTO
Se realiza un recubrimiento de cobre cido sobre el recubrimiento electroless, para
dar mayor espesor a este ltimo. Debe emplearse baja densidad de corriente (j 0.5
A/dm2 ) y temperatura ambiente. Posteriormente puede hacerse cualquier otro
recubrimiento que se desee, por ejemplo cromado, niquelado, etc.
Reporte e investigacin
Investigue la funcin de cada uno de los pasos que se siguen en la obtencin de un
recubrimiento de este tipo. Mencione aplicaciones de los recubrimientos metlicos sobre
plstico.
El cloruro de paladio es un producto sumamente caro. Investigue si existen caminos
alternativos para evitar su uso.
Comente sobre la calidad del recubrimiento obtenido y la influencia que tuvo el
sustrato (plstico) en esta variable.
76
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #33 Influencia del ambiente en la velocidad de corrosin
Objetivo
Este experimento examina la influencia de varios ambientes en la estabilidad de
materiales comunes de ingeniera.
Teora
La velocidad de corrosin de los metales est fuertemente influida por el ambiente
que los rodea. Dentro del trmino ambiente se incluyen las condiciones fsicas y
qumicas del medio en que se encuentra el metal.
Todos los ambientes son corrosivos en mayor o menor grado; existen muchos
factores que pueden afectar la velocidad de corrosin. Algunos ejemplos son:
- Ambiente acuoso vs. ambiente seco
- Presencia de oxgeno o, por el contrario, condiciones anaerobias
- Presencia de iones
- Potencial de hidrgeno (pH) del medio
- Radiaciones ionizantes (como las emitidas por desechos radiactivos)
- Suciedad y contaminantes superficiales
- Pureza del metal o composicin de la aleacin
- Esfuerzos de tensin o compresin en el metal
- Temperatura
Los factores meteorolgicos son tambin muy importantes en los estudios sobre
corrosin. La corrosin atmosfrica es la causa ms frecuente de la destruccin de
metales y aleaciones. Contaminantes naturales (como el cloruro de sodio suspendido en la
atmsfera de las zonas costeras) y de origen humano (por ejemplo, dixido de azufre)
pueden potenciar el efecto corrosivo de los factores meteorolgicos.19 Las caractersticas
corrosivas de los diferentes climas mundiales se pueden consultar en los mapas de
corrosin que se incluyen en muchos libros relacionados con el tema.
Reactivos y aparatos necesarios
Lmina delgada de acero de espesor conocido
Lmina delgada de cobre de espesor conocido
Solucin de FeCl3 0.1 M
Solucin de FeCl2 0.1 M
Solucin de H2SO4 0.1 M
Solucin de HNO3 0.01 M
Acido ntrico concentrado (15 M)
19 Genesc, Ms all de la herrumbre III, pgs. 24-25.
77
Prcticas de laboratorio de Electroqumica y Corrosin
Vasos de precipitados o tubos de ensayo
Procedimiento
Corte las lminas metlicas en rectngulos pequeos, por ejemplo de 2 cm x 1 cm.
Deber preparar 5 muestras de acero y 2 de cobre. Lmpielas cuidadosamente con algn
solvente o detergente para remover la suciedad y la grasa. No las toque con los dedos,
utilice pinzas de plstico.
Mida las dimensiones de la muestra con precisin de 0.2 mm, y pese cada una de ellas
hasta dcimas de mg. Prepare las soluciones necesarias y coloque las muestras en tubos
de ensayo o vasos de precipitados pequeos como sigue:
Acero en agua destilada.
Acero en solucin de cloruro frrico.
Acero en solucin de cloruro ferroso.
Acero en cido sulfrico 0.1 M a temperatura ambiente.
Acero en cido sulfrico 0.1 M caliente, cercano a la ebullicin.
Cobre en cido ntrico diluido.
Cobre en cido ntrico concentrado, directamente de la botella, en la campana de humos.
Exponga las muestras al ambiente correspondiente durante por lo menos 1 hora.
Retrelas, enjuague con agua destilada y deje secar sobre papel absorbente. Pese de nuevo
las muestras e inspeccinelas a simple vista, con una lente de aumento o al microscopio.
Si la muestra est cubierta de una pelcula, remuvala y psela de nuevo.
Clculos y reporte
Reporte la apariencia fsica de cada muestra antes y despus de la exposicin.
Determine la prdida de peso y las velocidades de corrosin en:
a) kg/m2 -ao
b) Densidad de corriente equivalente (A/m2 )
c) ngstrom por segundo, MPY y capas atmicas por segundo.
Si ocurre picado, reporte las dimensiones de la picadura lo mejor posible, el nmero de
picaduras observadas, calcule el factor de picado, la densidad de corriente en el fondo de
los orificios y el tiempo necesario para perforar completamente la muestra.
78
Prcticas de laboratorio de Electroqumica y Corrosin
Universidad de Guadalajara
Centro Universitario de Ciencias Exactas e Ingenieras
Laboratorio de Electroqumica y Corrosin (LEC)
Prctica #34 Corrosin: experimentos de Evans
Objetivos
Entender el carcter electroqumico de los fenmenos de corrosin mediante la
construccin de una celda de corrosin por aireacin diferencial.
Comprobar que en el proceso de corrosin localizada de un metal se generan en
ste zonas con actividad andica y catdica (experimento de la gota de Evans).
Teora
El objetivo de esta prctica es observar los fundamentos electroqumicos de la
corrosin de los metales, tomando como ejemplo al hierro.
Se puede demostrar que la corrosin ocurre mediante reacciones que involucran
transferencia de electrones. El primer experimento, realizado en 1923 por el profesor
Ulick R. Evans ilustra la construccin de lo que se conoce como una pila de corrosin,
en la que la diferencia de potencial que se genera durante el proceso de corrosin puede
detectarse y medirse.20 La presencia de gradientes de concentracin de oxgeno disuelto
es suficiente para originar la aparicin de una diferencia de potencial que es indicativa de
las reacciones de oxidacin y reduccin que estn ocurriendo en el sistema.
En el segundo experimento, conocido como experimento de la gota de Evans,
puede comprobarse que durante el proceso de corrosin de un metal estn involucradas
reacciones de oxidacin y reduccin en el sustrato metlico, generndose en forma
espontnea zonas catdicas y andicas en una misma pieza de metal.
Aparatos y reactivos
CELDA DE AIREACION DIFERENCIAL
Soluciones de NaCl 0.1 M y K3[Fe(CN)6] 0.1 M, indicador de fenolftalena en
alcohol, vasos de precipitados, una tira de papel filtro empapada en solucin de NaCl 0.1
M o un puente salino de agar, caimanes, un voltmetro y una bomba de aire para acuario,
en caso de que el laboratorio no cuente con lneas de aire comprimido. Se necesitan
adems varios clavos de hierro grandes y limpios de grasa y xido.
EXPERIMENTO DE LA GOTA DE EVANS
Se necesita una pieza de hierro o acero pulido con lija del nmero 600, y unas gotas
de la solucin de Evans, compuesta de:
KCl
0.1 M
K3[Fe(CN)6] 0.001 M
20 Avila y Genesc, Ms all de la herrumbre, pgs. 36-38.
79
Prcticas de laboratorio de Electroqumica y Corrosin
Unas gotas de indicador alcohlico de fenolftalena
Procedimiento
CELDA DE AIREACION DIFERENCIAL
Llene dos vasos de precipitados con aproximadamente 40 ml de solucin de cloruro
de sodio y agregue a uno de ellos 1 ml de solucin de ferricianuro de potasio y al otro 5
gotas de indicador de fenolftalena. Monte en seguida el siguiente arreglo:
Celda De Corrosin De Evans
V
a la bomba de
aire
puente salino
clavo
Con la bomba de aire apagada, mida el potencial entre los dos clavos usando el
voltmetro. Encienda ahora la bomba de aire y burbujee continuamente en la solucin que
contiene indicador de fenolftalena durante por lo menos 5 minutos. Apague la bomba de
aire, deje que la solucin se estabilice y observe con atencin los cambios de coloracin
que ocurren en cada vaso. Mida de nuevo el potencial entre los dos clavos de hierro.
Coloque la salida de aire en el otro vaso (el que contiene ferricianuro de potasio) y
observe lo que sucede con el potencial de la celda al burbujear nuevamente aire.
Lleve a cabo un ensayo en blanco montando de nuevo el aparato mostrado, pero sin
los clavos de hierro. Ocurre algn cambio de coloracin en los vasos?
EXPERIMENTO DE LA GOTA DE EVANS
Coloque una gota de ms o menos 2 cm de dimetro en la muestra de acero pulido y
registre sus observaciones de la muestra durante media hora o hasta que se alcance el
estado estacionario.
80
Prcticas de laboratorio de Electroqumica y Corrosin
Reporte
CELDA DE AIREACION DIFERENCIAL
Investigar las reacciones que ocurren en cada media celda y la reaccin global.
Cul de los clavos es el ctodo y cul es el nodo? Es espontnea la reaccin de la
celda? Averige la funcin que tienen cada uno de los rectivos empleados (fenolftalena,
ferricianuro de potasio, cloruro de sodio).
De acuerdo con el experimento realizado, qu condiciones en el medio ambiente
que rodea un metal parecen favorecer la corrosin? Cmo pueden presentarse
condiciones similares en la naturaleza? Sugiera algunas razones por las cuales los objetos
de hierro y acero (bicicletas, carroceras, vigas, etc.) se corroen cuando permanecen a la
intemperie.
EXPERIMENTO DE LA GOTA DE EVANS
Sintetice sus observaciones y explique los procesos de corrosin en trminos de los
procesos qumicos y fsicos que tienen lugar en la gota. Apoye su explicacin con datos
termodinmicos, lo mismo con lo que haya ledo acerca de la corrosin localizada del
hierro.
Si se prepara la solucin de Evans utilizando ferrocianuro de potasio en vez de
ferricianuro, se observa que el color azul no aparece instantneamente, sino que es
necesario exponer un buen tiempo la muestra al aire para que se desarrolle la coloracin.
Lo mismo sucede si en la celda de aireacin diferencial se sustituye al ferricianuro por
ferrocianuro. Explique.
81
También podría gustarte
- Examen de CorrosionDocumento6 páginasExamen de CorrosionHernandezbAngie100% (1)
- Normalizacion y MetrologiaDocumento9 páginasNormalizacion y Metrologiahigienequimica504170% (10)
- Galvanoplastia para Calcular Constante de Faraday y No. Avogadro.Documento19 páginasGalvanoplastia para Calcular Constante de Faraday y No. Avogadro.rogermax100100% (1)
- Criterio de Diseño ElectricoDocumento21 páginasCriterio de Diseño ElectricoFloyd MGAún no hay calificaciones
- Práctica #3 Electrodos de ReferenciaDocumento6 páginasPráctica #3 Electrodos de ReferenciaJANE BARAJASAún no hay calificaciones
- Sistemas de Calidad TotalDocumento8 páginasSistemas de Calidad Totalhigienequimica504180% (5)
- Celda ElectroliticaDocumento7 páginasCelda Electroliticaedgar yadhir perez hernandezAún no hay calificaciones
- Practica 4 CorrosiónDocumento14 páginasPractica 4 CorrosiónVictor RamirezAún no hay calificaciones
- Electrodeposicion y Leyes de FaradayDocumento7 páginasElectrodeposicion y Leyes de FaradayFranz Pérez100% (1)
- Posicion 1F y 1GDocumento9 páginasPosicion 1F y 1GGerli TeranAún no hay calificaciones
- EjerciciosDocumento4 páginasEjerciciosshownistAún no hay calificaciones
- Electrodeposicion BuenoDocumento20 páginasElectrodeposicion BuenoJennifer BocanegraAún no hay calificaciones
- Analisis de Riesgos y Puntos CriticosDocumento10 páginasAnalisis de Riesgos y Puntos Criticoshigienequimica5041100% (2)
- 06 - Iec 60364Documento23 páginas06 - Iec 60364Mikel IglesiasAún no hay calificaciones
- Practica 7Documento7 páginasPractica 7nicolas cardenasAún no hay calificaciones
- Practica 2 - LEQIDocumento5 páginasPractica 2 - LEQIJANE BARAJASAún no hay calificaciones
- Galvanostegia Informe.Documento47 páginasGalvanostegia Informe.Matty Vw Quadrado100% (1)
- Termodinamica de La CorrosionDocumento30 páginasTermodinamica de La CorrosionLuis Calanche Arias100% (1)
- Demostracion de La Ley de LenzDocumento18 páginasDemostracion de La Ley de LenzvanessaAún no hay calificaciones
- Mecanismos de La CorrosiónDocumento5 páginasMecanismos de La CorrosiónOscar Luis Guinto Parra100% (1)
- Electro ObtenciónDocumento9 páginasElectro ObtenciónJose Ignacio Salinas OjedaAún no hay calificaciones
- Manual de Practicas Electrometalurgía2015-1Documento15 páginasManual de Practicas Electrometalurgía2015-1Carlos Alberto Soto RamirezAún no hay calificaciones
- Tarea RPL JuanValenciaDocumento13 páginasTarea RPL JuanValenciajuan valencia100% (1)
- Universidad Nacional Autónoma de México: Práctica Extracción Por SolventesDocumento10 páginasUniversidad Nacional Autónoma de México: Práctica Extracción Por SolventesJesus Vite MedinaAún no hay calificaciones
- Reporte Práctica 2 - "Determinación de Corrosión Por Picaduras en Metales Pasivos" 2021-1Documento5 páginasReporte Práctica 2 - "Determinación de Corrosión Por Picaduras en Metales Pasivos" 2021-1Jose Luis Acosta RosalesAún no hay calificaciones
- Infografia Ley de GrahamDocumento6 páginasInfografia Ley de GrahamRodriguez Robles IsaacAún no hay calificaciones
- Practica 10Documento6 páginasPractica 10Uriel Ramos0% (1)
- Teoria de Electrolisis AlumnosDocumento12 páginasTeoria de Electrolisis AlumnosJulio C V100% (1)
- Laboratorio #1 de CorrosionDocumento10 páginasLaboratorio #1 de CorrosionJhoan Roy Ramirez SolisAún no hay calificaciones
- Ecuacion de NernstDocumento7 páginasEcuacion de NernstAngela aponteAún no hay calificaciones
- Corrosion en Medios AcuososDocumento10 páginasCorrosion en Medios AcuososmoisesAún no hay calificaciones
- El Ozono PDFDocumento12 páginasEl Ozono PDFluceroca100% (1)
- PolarizaciónDocumento3 páginasPolarizaciónalejandraardilamAún no hay calificaciones
- Difraccion de Rayos XDocumento13 páginasDifraccion de Rayos XAngelica ArangoAún no hay calificaciones
- Ecuación de Nernst y Diagrama de PourbaixDocumento4 páginasEcuación de Nernst y Diagrama de PourbaixLalaAún no hay calificaciones
- Dependencia de La Fem Con TDocumento17 páginasDependencia de La Fem Con Tgisela2592Aún no hay calificaciones
- Soluciones Y Propiedades ColigativasDocumento128 páginasSoluciones Y Propiedades ColigativasFranciscoLara0% (1)
- Práctica No 3 Crecimieto de Cristales TerminadaDocumento5 páginasPráctica No 3 Crecimieto de Cristales TerminadaVin Doyle BravoAún no hay calificaciones
- TAFELDocumento13 páginasTAFELGustavo CabreraAún no hay calificaciones
- ManualDocumento45 páginasManualFernando MendozaAún no hay calificaciones
- Electroquimica 2019Documento27 páginasElectroquimica 2019ulises michelinAún no hay calificaciones
- Cuestionario Electrodo de Referencia - Lopez Barreto Pedro MiguelDocumento4 páginasCuestionario Electrodo de Referencia - Lopez Barreto Pedro MiguelPEDRO LOPEZ BARRETOAún no hay calificaciones
- Electrólisis de Sales FundidasDocumento2 páginasElectrólisis de Sales FundidasJhon Cesar Palma LopezAún no hay calificaciones
- REDOXDocumento47 páginasREDOXBladi MamaniAún no hay calificaciones
- Desti Laci OnDocumento12 páginasDesti Laci OnPamela Chambi RamosAún no hay calificaciones
- Determinacion Catalitica de Trazas de SelenioDocumento5 páginasDeterminacion Catalitica de Trazas de SelenioElenaL100% (2)
- Practica N 9 Proteccion CatodicaDocumento6 páginasPractica N 9 Proteccion Catodicarafaga9012Aún no hay calificaciones
- Problemas Básicos-Cyrhom - R. Simples - MLHPDocumento3 páginasProblemas Básicos-Cyrhom - R. Simples - MLHPGilberto ObregónAún no hay calificaciones
- Laboratorion 9 Quimica Organica1Documento40 páginasLaboratorion 9 Quimica Organica1rosaAún no hay calificaciones
- Práctica No.2 Manejo Del PotenciostatoDocumento5 páginasPráctica No.2 Manejo Del PotenciostatoLuz CasteleyroAún no hay calificaciones
- Electroquimica EjerciciosDocumento6 páginasElectroquimica EjerciciosFabiola CalderonAún no hay calificaciones
- Síntesis de Una PerovskitaDocumento6 páginasSíntesis de Una PerovskitaDiana LopezAún no hay calificaciones
- Reporte8-Protección CatódicaDocumento6 páginasReporte8-Protección CatódicaOmar AlexAún no hay calificaciones
- Cuestionario de CorrosionDocumento11 páginasCuestionario de CorrosionDarwin Enrique Ocsa YucraAún no hay calificaciones
- Nùmero de TransporteDocumento6 páginasNùmero de TransporteLandyAlpizarAún no hay calificaciones
- Catalizadores y Catalisis HeterogeneaDocumento36 páginasCatalizadores y Catalisis HeterogeneajuliancardonaAún no hay calificaciones
- Teoria de Potenciales MixtosDocumento5 páginasTeoria de Potenciales Mixtoscoreano63Aún no hay calificaciones
- Previo de Poder CubrienteDocumento2 páginasPrevio de Poder CubrienteItzelitaiqmAún no hay calificaciones
- Práctica 3 TafelDocumento3 páginasPráctica 3 TafelNairo MejiaAún no hay calificaciones
- UMSADocumento4 páginasUMSAErika ApazaAún no hay calificaciones
- Electrodos - de - Referencia - III 1er Avance GiuseppeDocumento7 páginasElectrodos - de - Referencia - III 1er Avance Giuseppediego floresAún no hay calificaciones
- Electroquimica - Diferencia de PotencialDocumento20 páginasElectroquimica - Diferencia de Potencialivan real garciaAún no hay calificaciones
- Pract Electrodo AgAgClDocumento3 páginasPract Electrodo AgAgClSamuelBriseñoAún no hay calificaciones
- 3técnicas ElectroquímicasDocumento4 páginas3técnicas ElectroquímicasCARLOS ALFREDO FRANCIS CABRERAAún no hay calificaciones
- P4 Electro Introduccion y CuestionarioDocumento3 páginasP4 Electro Introduccion y CuestionarioDonaldo ValenciaAún no hay calificaciones
- Guia 06 - Construcción de Un Electrodo de Ag-AgClDocumento7 páginasGuia 06 - Construcción de Un Electrodo de Ag-AgClCAMILA SUAZAAún no hay calificaciones
- Planes de Muestreo y Graficas deDocumento10 páginasPlanes de Muestreo y Graficas dehigienequimica5041Aún no hay calificaciones
- Unidad 1. Filosofia y Tecnicas Internacionales deDocumento63 páginasUnidad 1. Filosofia y Tecnicas Internacionales dehigienequimica5041Aún no hay calificaciones
- Practica 9 - Obtención de Un AlcanoDocumento4 páginasPractica 9 - Obtención de Un Alcanohigienequimica5041Aún no hay calificaciones
- Practica 6 - Estudio de Las Reacciones QuímicasDocumento11 páginasPractica 6 - Estudio de Las Reacciones Químicashigienequimica504150% (4)
- Unidad 2. Administracion de La CalidadDocumento20 páginasUnidad 2. Administracion de La Calidadhigienequimica504167% (6)
- Practica 2 - Instrumentos de MediciónDocumento14 páginasPractica 2 - Instrumentos de Mediciónhigienequimica5041100% (3)
- ZzzMANUAL de Q Analitica-1 SEP28Documento67 páginasZzzMANUAL de Q Analitica-1 SEP28higienequimica5041Aún no hay calificaciones
- Practica 1 - Clasificación e Identificación Del Mate de LabDocumento6 páginasPractica 1 - Clasificación e Identificación Del Mate de Labhigienequimica5041Aún no hay calificaciones
- Practica 7 - Reacciones QuímicasDocumento4 páginasPractica 7 - Reacciones Químicashigienequimica50410% (1)
- Practica 4 - Sulfato CúpricoDocumento5 páginasPractica 4 - Sulfato Cúpricohigienequimica5041Aún no hay calificaciones
- Practica 3 - Imorga Des de Los Metales AlcalinosDocumento8 páginasPractica 3 - Imorga Des de Los Metales Alcalinoshigienequimica504150% (4)
- Practica 5 - Relación EstequiométricaDocumento8 páginasPractica 5 - Relación Estequiométricahigienequimica5041100% (3)
- Practica 4 - Sintesis de La AspirinaDocumento9 páginasPractica 4 - Sintesis de La Aspirinahigienequimica5041Aún no hay calificaciones
- Practica 2 Sintesis de La CiclohexanonaDocumento6 páginasPractica 2 Sintesis de La Ciclohexanonahigienequimica5041Aún no hay calificaciones
- Practica 6 - de AminasDocumento10 páginasPractica 6 - de Aminashigienequimica5041100% (1)
- Practica 1 - BUTIRALDEHIDODocumento5 páginasPractica 1 - BUTIRALDEHIDOhigienequimica5041Aún no hay calificaciones
- Practica 3 Eter B NaftilicoDocumento6 páginasPractica 3 Eter B Naftilicohigienequimica5041Aún no hay calificaciones
- AcetatoDocumento6 páginasAcetatohigienequimica5041100% (2)
- SecadoDocumento17 páginasSecadohigienequimica5041100% (7)
- AdsorcionDocumento14 páginasAdsorcionhigienequimica5041100% (3)
- Practica 5 - Sintesis Del BenciloDocumento7 páginasPractica 5 - Sintesis Del Bencilohigienequimica504150% (2)
- Integral IIIDocumento6 páginasIntegral IIIhigienequimica5041100% (3)
- P DestilacionDocumento27 páginasP Destilacionhigienequimica5041100% (3)
- SecadoDocumento17 páginasSecadohigienequimica5041100% (7)
- TermoDocumento72 páginasTermohigienequimica5041100% (2)
- ManualDocumento39 páginasManualhigienequimica5041100% (2)
- Instrumentos de Medicion y El ResistorDocumento8 páginasInstrumentos de Medicion y El ResistormaemsomaAún no hay calificaciones
- Lab - Fisica Moderna - CorregidoDocumento6 páginasLab - Fisica Moderna - CorregidoLuis Eduardo Romero MorenoAún no hay calificaciones
- Cuadro Comparativo de Las Características de Los Generadores y Motores de CDDocumento3 páginasCuadro Comparativo de Las Características de Los Generadores y Motores de CDNathaly TorresAún no hay calificaciones
- Evidencia 1 CDLMDocumento4 páginasEvidencia 1 CDLMEricka TreviñoAún no hay calificaciones
- Tarea 3Documento3 páginasTarea 3CrisAún no hay calificaciones
- ComparadoresDocumento3 páginasComparadoresAlex RemacheAún no hay calificaciones
- 677292-Permiso Consignacion MaquinasDocumento15 páginas677292-Permiso Consignacion MaquinasJosé Alberto Mass BriceñoAún no hay calificaciones
- Leccion 1Documento5 páginasLeccion 1Esteban LopezAún no hay calificaciones
- Ensayo de Vacío o Circuito AbiertoDocumento2 páginasEnsayo de Vacío o Circuito AbiertoFederico FloresAún no hay calificaciones
- Control de Velocidad Del Motor de Inducción Empleando Linealización Por Realimentación de EstadosDocumento8 páginasControl de Velocidad Del Motor de Inducción Empleando Linealización Por Realimentación de Estadossebastian iglesias mierAún no hay calificaciones
- Sa Tema 04-Resistivos 1Documento31 páginasSa Tema 04-Resistivos 1Bruno Balbino Castillejos CruzAún no hay calificaciones
- Fuentes de PoderDocumento20 páginasFuentes de PoderJorge Yagual OcampoAún no hay calificaciones
- Motores Monofasicos Con CapacitorDocumento11 páginasMotores Monofasicos Con CapacitorJosé Esquivel100% (2)
- Semana 14 Metrologia Vega Aldo PresentarDocumento7 páginasSemana 14 Metrologia Vega Aldo PresentarHernanPedrozoVillanuevaAún no hay calificaciones
- Listaiii Matiii Unaat 2021iDocumento1 páginaListaiii Matiii Unaat 2021iCarlos Erick Barrera VelaAún no hay calificaciones
- Termistores y Detectores ResistivosDocumento7 páginasTermistores y Detectores ResistivosAngel NajarroAún no hay calificaciones
- Formato de Condiciones de Infraestructura ElectricaDocumento2 páginasFormato de Condiciones de Infraestructura ElectricaJessica VanegasAún no hay calificaciones
- SOLUCIONES ProblemasAutoevaluacionTema6-7Documento13 páginasSOLUCIONES ProblemasAutoevaluacionTema6-7Juan GarciaAún no hay calificaciones
- 14.4 Tarea Ley de Faraday LenzDocumento2 páginas14.4 Tarea Ley de Faraday LenzGUILLEN ZEGARRA ELIZABETHAún no hay calificaciones
- Tarea - 3 Aislamiento - ElectricoDocumento4 páginasTarea - 3 Aislamiento - ElectricoCesar Mauricio DavidAún no hay calificaciones
- Laboratorio 7 - G03 - Electrónica Del VehículoDocumento26 páginasLaboratorio 7 - G03 - Electrónica Del VehículoAngelo Maguiña OsorioAún no hay calificaciones
- Tableros de Alumbrado NDP - NHDP - 06 PDFDocumento9 páginasTableros de Alumbrado NDP - NHDP - 06 PDFjesus bastardo100% (1)
- Informe 1-Mesa 2Documento9 páginasInforme 1-Mesa 2Johnn NarváezAún no hay calificaciones
- Dokumen - Tips Amplificador Con Tda2050 BDocumento8 páginasDokumen - Tips Amplificador Con Tda2050 BMario RazielAún no hay calificaciones
- Previo 4 MalcaDocumento15 páginasPrevio 4 MalcaLuis Fernando Osorio SanchezAún no hay calificaciones
- Catálogo IsoelectricDocumento16 páginasCatálogo IsoelectricManuel MontalvoAún no hay calificaciones
- Las Dinamos CCDocumento23 páginasLas Dinamos CCFernando Palacios SanchezAún no hay calificaciones