Documentos de Académico
Documentos de Profesional
Documentos de Cultura
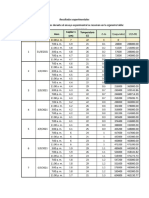
Luyben Ejemplo
Luyben Ejemplo
Cargado por
Hugo Fredy Quinonez BarretoDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Luyben Ejemplo
Luyben Ejemplo
Cargado por
Hugo Fredy Quinonez BarretoCopyright:
Formatos disponibles
Ejemplo 2.
1
Figura 2.1
Tanque con un mezclado perfecto
En la figura 2.1 se muestra un tanque que tiene un lquido que est
perfectamente mezclado. No se muestra la paleta de agitacin.
Por la parte izquierda del tanque, est entrando un flujo lquido, con un
caudal volumtrico Fo, [pies
3
/min o m
3
/min] y cuya densidad es
,
[lbm/pie
3
o kg/m
3
].
El lquido dentro del tanque ocupa un volumen de V [pies
3
o m
3
], y la
densidad del lquido dentro del tanque es , [lbm/pie
3
o kg/m
3
].
Por la parte derecha del tanque, est saliendo el flujo lquido mezclado
perfectamente, que est dentro del tanque, y lo hace con un caudal
volumtrico F, [pies
3
/min o m
3
/min] y la densidad de este flujo que sale
del tanque es la misma que la que est dentro del tanque, es decir,
[lbm/pie
3
o kg/m
3
] ya que tenemos mezclado perfecto.
Hallar la ecuacin de balance de masa.
Solucin
El sistema para el cual queremos escribir la ecuacin de continuidad total
es toda la fase liquida dentro del tanque.
Este sistema es llamado un sistema macroscpico porque el balance de
masa se hace alrededor de todo el tanque, no solo en un elemento
diferencial y pequeo dentro del tanque.
A este sistema tambin se le llama un sistema macroscpico ya que a
diferencia de un sistema microscpico, este tiene un tamao definido y
finito.
La ecuacin de balance de masa es:
[
] [
] [
]
Vamos a ver cada uno de los trminos de esta ecuacin:
[
]
[
]
[
]
Colocando cada uno de estos trminos en la ecuacin de balance de masa
total obtenemos:
Fo
- F = tasa de cambio de V) (2.2)
Como el liquido dentro del tanque est perfectamente mezclado, la
densidad es la misma en cualquier punto dentro del tanque; la densidad
no vara con la posicin axial o radial dentro del tanque; es decir, no hay
gradientes de densidad en todo el espacio dentro del tanque. Esto
significa que la densidad , no es funcin de las coordenadas ; y que
el volumen tampoco es funcin de las coordenadas .
Esto tambin significa que la nica variable independiente es el tiempo, t.
Esta es la razn por la que podemos usar un sistema macroscpico.
Puesto que y V solamente son funciones de , entonces en el lado
derecho de la ecuacin (2.2) usaremos una ecuacin diferencial ordinaria.
Fo
- F =
( V) (2.3)
Vamos a verificar las unidades de esta ecuacin (2.3):
*
+ *
+ *
+
[
] [
] [
]
Es decir las unidades coordinan bien.
Adems como el lquido que entra al tanque es el mismo que sale y es
incompresible, entonces
Tambin como el volumen del liquido dentro del tanque es:
Volumen del liquido dentro del tanque =
Reemplazando estas dos ltimas ecuaciones en la ecuacion (2.3),
obtenemos:
Fo - F =
simplificando:
Tenemos que eliminar F y poner la ecuacioin en funcion de las dos
incognitas que ya tenemos que son h y v. Como el flujo volumetrico F que
sale de la tubera con caudal acoplado esta dado por Flujo = velocidad por
Area de la tubera, tenemos:
Reemplazando tenemos:
Ejemplo 2.2
En la figura 2.2, se muestra una tubera cilndrica de dimetro constante A
y por la cual est pasando un fluido cuya densidad y velocidad dependen
de la posicion axial z, es decir, que la velocidad v y la densidad son
funciones de t y de z: y . Hallar la ecuacin de
continuidad total, asumiendo que el flujo es turbulento.
Solucin
Como el flujo es turbulento, podemos asumir que tenemos condiciones
de flujo acoplado (plug flow), es decir, que cada porcin (o seccin
transversal) del lquido fluye a lo largo de la tubera como si fuera una
unidad.
Decir flujo acoplado tambin significa que ni la velocidad del fluido, ni
ninguna otra propiedad del fluido tienen gradientes radiales, es decir no
pueden haber variaciones de las propiedades del fluido en un area de
seccin transversal dada; sin embargo, si pueden existir gradientes axiales,
es decir si pueden haber variaciones a lo largo del eje de la tubera, en
otras palabras, que las propiedades del fluido en diferentes secciones
transversales si pueden variar entre s, pero no puede haber variaciones
de las propiedades del fluido en una misma seccin transversal de la
tubera.
La densidad y la velocidad del fluido, conforme el fluido pasa por la
tubera, pueden cambiar a lo largo del eje z o direccin axial
Por lo tanto, ahora tenemos dos variables independientes: el tiempo t y la
posicin z. Esto quiere decir, que la velocidad v y la densidad son
funciones de t y de z: y y por lo tanto ahora tenemos
que usar ecuaciones diferenciales parciales, a diferencia del ejemplo
anterior en el que solo usbamos derivadas simples porque solo dependa
del tiempo.
Ahora tenemos que aplicar la ecuacin de balance de masa total [Ec. (2.1)]
a un sistema que consiste de una pequea porcin o rodaja, o un pequeo
corte del rea de la seccin transversal de la tubera.
Este sistema es llamado un sistema microscpico. El elemento diferencial
est ubicado en un lugar arbitrario z a lo largo de la tubera. Este
elemento diferencial tiene un espesor de dz y tiene un rea igual al rea
de la seccin transversal de la tubera, la cual es A [pie
2
o m
2
].
Vamos a aplicar la ecuacin de balance de masa total a esta pequea
porcin diferencial de la tubera que est ubicada en la coordenada z:
Vamos a ver cada uno de los trminos de esta ecuacin:
Empezamos con la masa que entra al sistema por z. Ver figura 2.2
Masa = flujo volumtrico por densidad =F [m
3
/min x lb/m
3
]= [lbm/min]
Si la velocidad del fluido en z es v, entonces el flujo volumtrico que entra
por z es
Por tanto, la masa que entra a travs de la frontera en z, es:
Note que las unidades de esta ltima ecuacin son: [lbm/min] o [kg/min]
Vamos a ver ahora la masa que sale del sistema. Ver figura 2.2
Como la velocidad v del fluido y la densidad del fluido dependen de la
posicin z, estas dos propiedades tienen otro valor en la posicion (z+dz).
La velocidad en (z+dz) es la velocidad en z ms un delta de velocidad. Pero
el delta de velocidad o variacin de velocidad originada por la distancia
axial dz es
. As, la velocidad en (z+dz) es
.
De igual manera la densidad en (z+dz) es igual a la densidad en z mas la
variacin de la densidad originada por la distancia axial dz, la cual es:
En consecuencia, la densidad en (z+dz) es *
+.
Por lo tanto, la masa que sale por (z+dz) es el producto deL rea de la
tuberia, la velocidad, y la densidad en ese punto (z+dz).
En forma de ecuacion, la masa que sale del sistema a travs de la frontera
(z+dz) es:
Nota: Esta ultima ecuacin (2.6) que representa el flujo msico que sale
por (z+dz), tiene la forma de una expansin de la serie de Taylor, de una
funcin f(z) alrededor de z.
Recordando lo que hemos estudiado en clculo diferencial, una expansin
de la serie de Taylor o el valor de una funcin a una distancia dz de z, est
dada por:
Si es muy pequeo, entonces todos los trminos que contengan y
que estn elevados a una potencia mayor o igual al exponente 2, se
podran despreciar. Es decir despus del trmino de la derivada, o lo que
es lo mismo a partir del tercer trmino se desprecian.
De esta manera obtenemos la ecuacin (2.6), si hacemos que f(z) = .
Ahora calcularemos el trmino de la derecha, de la ecuacin (2.1), es decir
la variacin de masa dentro del sistema:
La tasa de cambio en el tiempo de la masa dentro del sistema es:
es el volumen del sistema; es decir es el volumen de la porcin
de fluido cilndrico con rea A y altura dz. es la densidad del fluido.
Las unidades de esta ecuacin (2.4) son: [lbm/min] o [kg/min].
Sustituyendo las tres ecuaciones (2.4), (2.5) y (2.6) en la ecuacin de
balance de masa total, obtenemos:
Simplificando:
Cancelando los dos trminos dz que estn a ambos lados de la ecuacin y
asumiendo que A es constante, obtenemos:
Pregunta
Para qu nos sirven los resultados obtenidos que son las ecuaciones (2.3)
y (2.8)? Es decir en que las voy a usar?
Respuesta
Estas ecuaciones tienen tres usos importantes:
1- Si las resolvemos usando la transformada de Laplace, y despejamos
la salida, podemos obtener las funciones de transferencia del
modelo.
2- Nos sirven para que cuando diseemos un sistema de control, el
controlador debe cumplir forzosamente esta ecuacin porque es
una ley fsica.
3- Nos sirve para tener el modelo matemtico de ese sistema y disear
el control precalculado.
B. ECUACIONES DE CONTINUIDAD POR COMPONENTE
Tambin llamadas ecuaciones de balance de masa por componente. A
diferencia de la masa que si se conserva, los componentes qumicos no se
conservan.
Es decir si tomamos al reactor como nuestro volumen de control,
Tasa de ingreso Tasa de salida tasa de cambio
del componente i - del componente i del componente i
al reactor del reactor dentro del reactor
Las moles no necesariamente se conservan en una reaccin qumica.
Definicin: en una reaccin qumica, en la ecuacin estequiometrica que
nos relaciona las proporciones de los componentes de la misma, a los
trminos que estn antes del signo igual se les llama los reactivos, y a los
trminos que estn a la derecha del signo igual se les llama los productos.
As, si una reaccin ocurre dentro de un sistema, el nmero de moles de
un componente individual aumentara si este es un producto de la
reaccin, o al revs, el nmero de moles disminuir si este es un reactivo.
Considere por ejemplo el caso de la siguiente reaccin:
Como podemos apreciar de la ecuacin, en condiciones de estado
estacionario, las moles del reactivo A que salen del reactor no son las
mismas moles que estn entrando, porque a la salida no hay A ( se ha
consumido el reactivo A!!).
De manera similar, vemos que se estn usando 3 moles de reactivos, y sin
embargo se estn formando 4 moles como producto, de tal manera que
tampoco se estn conservando las moles totales. Sin embargo, no se
confunda y no se olvide que la masa total si se conserva. Las moles no se
conservan, pero la masa s se conserva.
En consecuencia, las ecuaciones de balance molar, deben tomar en cuenta
la produccin o el consumo de moles debido a la reaccin.
Por lo tanto la ecuacin de balance de masa por componente, de la
especie qumica j-esima, del sistema, que toma en cuenta esta produccin
o agotamiento, se expresa como:
[Flujo de moles del componente j que entran al sistema]-[Flujo de moles del componente j que
salen del sistema]+ [velocidad de formacin de moles del componente j por las reacciones
qumicas]=[velocidad de cambio de moles del componente j dentro del sistema].
(2.9)
Las unidades de esta ecuacin son moles del componente j por unidad de
tiempo.
Como la estequiometria de las reacciones se da en moles, los balances de
las reacciones qumicas generalmente se dan en moles.
Vamos a repasar el concepto de mol.
Qu es una mol? Es el peso molecular expresado en unidades de peso.
Si tenemos 1 mol de H
2
O, entonces un mol de H
2
O pesara 18 gr, o 18 kg o
18 toneladas, o 18 lbs, o 18 en las unidades de peso que elijamos.
Continuando con nuestro tema, los flujos de entrada y de salida pueden
ser flujos por conveccin (debido al flujo msico) o flujos moleculares
(debido a la difusin).
La velocidad de produccin (o agotamiento) del componente i en el
reactor esta dado por la formula:
Tasa de produccin del componente i =
+
donde:
= Coeficiente estequiometrico del componente i en la reaccin.
V = volumen de la mezcla que est reaccionando en el reactor.
= tasa de reaccin del componente clave en la reaccin.
Esta tasa de reaccin,
siempre es un nmero positivo, y generalmente
est dada en las siguientes unidades:
Como podemos ver, un trmino muy importante en estas definiciones que
estamos dando, es el de componente clave. El componente clave puede
ser cualquier componente de la reaccin, un reactivo o un producto. Por
definicin, el coeficiente estequiometrico del componente que ha sido
elegido como el componente clave se hace igual a 1. Un
positivo indica
produccin del componente i; mientras que un
negativo indica
consumo o agotamiento del componente i.
En consecuencia, la tasa de cambio de cualquier componente i, se expresa
como: la multiplicacin de la tasa de reaccin del componente clave
,
por el volumen de la mezcla que est reaccionando, y por el numero de
moles del componente i que estn cambiando,
, por cada mol del
componente clave que este reaccionando.
Para demostrar aun ms la aplicacin de este balance molar por
componente, considere la reaccin qumica que hemos dado en la formula
anterior:
Supongamos que el componente clave es el B, y que para esta reaccin
especifica, se ha hallado experimentalmente que la tasa de reaccin
es:
Por lo tanto:
Entonces, el balance molar dinmico sobre el componente A, es:
Tasa de moles de A Tasa de moles de A
que entran al reactor - que salen del reactor + (-2)
V =
donde
es el numero de moles de A acumulados dentro del reactor
Si ahora hacemos, el balance molar de estado no estacionario sobre el
componente S, este ser:
Tasa de moles de S Tasa de moles de S
que entran al reactor - que salen del reactor + 3
V =
donde
es el numero de moles de S acumulados dentro del reactor.
El balance de moles total, esta dado por:
[Flujo de moles totales que entran al sistema]-[Flujo de moles totales que salen del sistema]+
[velocidad de formacin de moles totales por las reacciones qumicas]=[velocidad de cambio
de las moles totales dentro del sistema].
y,
la velocidad o tasa de produccin de moles totales=
+
donde:
, desde i=1 hasta i=nmero de componentes.
Para el caso de la anterior reaccin,
Podemos escribir una ecuacin de continuidad por componente para cada
uno de los componentes del sistema. Si por ejemplo, hay NC
componentes, habr NC ecuaciones de continuidad por componente, para
un sistema dado. Sin embargo, la nica ecuacin de balance de masa total
y las NC ecuaciones de balance por componente, no son todas
independientes, ya que la suma de todos los moles multiplicados por sus
respectivos pesos moleculares es igual a la masa total.
Por lo tanto en un sistema dado, se tiene nicamente NC ecuaciones de
continuidad independientes.
En consecuencia, generalmente se escogen (NC-1) balances por
componente ms el nico balance de masa total, lo que nos da un total de
(NC) ecuaciones independientes.
Por ejemplo, en un sistema binario (de dos componentes), podramos
plantear un balance de masa total y un balance por componente, o dos
balances de componente.
Ejemplo 2.3
Considere el mismo tanque con liquido perfectamente mezclado que
usamos en el ejemplo 2.1, excepto que ahora si ocurre una reaccin
qumica en el liquido dentro del tanque.
Al sistema anterior, ahora se le conoce con el nombre de CSTR, que
significa, Tanque reactor con agitacin continua, y se muestra en la figura
2.3.
Dentro del tanque, el componente A, reacciona irreversiblemente a una
taza especifica de reaccin k, para formar el producto componente B,
segn la siguiente formula de reaccin qumica.
La concentracin del componente A en el flujo de entrada es
(moles
de A por unidad de volumen) y la concentracin del componente A dentro
del reactor es
(moles de A por unidad de volumen).
Si asumimos que la reaccin es una reaccin simple de primer orden,
entonces la tasa de consumo del reactivo A por unidad de volumen ser
directamente proporcional a la concentracin instantnea de A en el
tanque. Es decir:
Para poder obtener la ecuacin del balance de masa del componente A,
ecuacin (2.9), necesitamos tener cada uno de los trminos que la
componen. Vemoslo.
Flujo de A que entra al sistema =
[moles de A/tiempo]
Flujo de A que sale del sistema =
[moles de A/tiempo]
Tasa de formacin de A por la reaccin qumica =
-V k
El signo menos proviene del hecho que A se est consumiendo (para
formar B) y no se est produciendo.
Como las unidades de cada uno de los trminos anteriores deben ser las
mismas e igual a [moles de A por unidad de tiempo], entonces el termino
-V k
tambin debe tener las mismas unidades de [moles de A por
unidad de tiempo].
Si por ejemplo, las unidades del flujo son [pies
3
/min], y las unidades de V
son [pies
3
] y las unidades de la concentracin de A son [moles de A por
pies
3
], entonces las unidades de k en este sistema deben de ser [
].
El ltimo trmino que nos falta hallar de la ecuacin, es el trmino de la
acumulacin:
Tasa de cambio de A dentro del tanque =
[moles de A/tiempo]
Combinando todas estas ecuaciones anteriores en la ecuacin (2.9),
obtenemos:
Como en este sistema con concentracin, t es la nica variable
independiente, por eso hemos usado una derivada ordinaria.
Las unidades de esta ecuacin de continuidad por componentes son:
[moles de A por unidad de tiempo].
El primer trmino, el de la izquierda, es el trmino dinmico. Los dos
primeros trminos en el lado derecho de la ecuacin, son los trminos
convectivos (que se transportan por conveccin). El ltimo trmino es el
trmino de generacin.
Veamos otra manera de realizar el balance de masa por componente.
Puesto que el sistema es un sistema binario (dos componentes A y B),
podramos escribir la otra ecuacin de continuidad del componente B.
Si C
B
es la concentracin de B, en [moles de B por unidad de volumen],
entonces la ecuacin de balance de masa del componente B ser:
Observe que ahora tenemos el signo positivo antes del trmino de
generacin, ya que en este caso se est produciendo B por la reaccin.
Como tenemos dos incgnitas C
A
y C
B
, tenemos que tener dos ecuaciones
para resolver este sistema de ecuaciones. Estas dos ecuaciones que se
necesitan para resolver el sistema, podran ser las dos ecuaciones de
balance de componente que hemos obtenido arriba.
Alternativamente, podramos haber usado solo una de las ecuaciones de
balance por componente, como por ejemplo, la ecuacin (2.10)y la otra
podra ser la ecuacin de continuidad total, ecuacin (2.3), puesto que C
A,
C
B,
estn relacionadas en forma nica por la siguiente ecuacin de
balance de masa total:
Donde M
A
, y M
B
son los pesos moleculares de los componentes A y B
respectivamente.
No se confunda que la densidad que nos da la ecuacin (2.11) es la
densidad que se debe de usar en el trmino de la acumulacin, es decir en
el que tiene la derivada con respecto al tiempo, por ejemplo la ecuacin
(2.3).
Ejemplo 2.4
Supongamos que tenemos el mismo sistema macroscpico que hemos
descrito anteriormente, excepto que ahora ocurren reacciones
consecutivas de la siguiente manera:
Al igual que antes, el reactivo A reacciona a una tasa especifica k
1
y forma
el componente B, pero ahora B puede reaccionar a una tasa especifica k
2
y
formar un tercer componente C.
Si asumimos que las reacciones son de primer orden, las ecuaciones de
continuidad por componente, para los componentes A, B, y C son las
siguientes:
La primera ecuacin indica que el flujo de A que entra al sistema el flujo
de A que sale del sistema los As que se estn perdiendo porque se estn
convirtiendo en B, es igual a la variacin de A dentro del sistema.
La segunda ecuacin indica que el flujo de B que entra al sistema el flujo
de B que sale del sistema + los Bs que se estn ganando o produciendo
porque los As se estn convirtiendo en B, - los Bs que se estn perdiendo
porque se estn convirtiendo en C por la reaccin qumica, es igual a la
variacin de B dentro del sistema.
La tercera ecuacin indica que el flujo de C que entra al sistema el flujo
de C que sale del sistema + los Cs que se estn ganando o produciendo
porque los Bs se estn convirtiendo en C, por la reaccin quimica, es igual
a la variacin de C dentro del sistema.
Para resolver este sistema, podramos usar estas tres ecuaciones de
balance de masa por componente, o podramos usar dos de las ecuaciones
de balance de masa por componente y la ecuacin de balance de masa
total.
Las concentraciones de los componentes estn relacionadas con la
densidad por la siguiente frmula:
Donde:
M
A
, es el peso molecular del componente A
C
A
, es la concentracin del componente A, expresada en moles de A por
unidad de volumen.
Si armamos la sumatoria de los productos anteriores obtenemos la
densidad.
EJEMPLO 2.5
Supongamos que a diferencia del ejemplo 2.2 en el que circulaba un fluido
por una tubera, ahora en vez de la tubera el fluido est circulando en un
reactor tubular, dentro del cual ocurre la misma reaccin que la del
tanque reactor del ejemplo 2.3, es decir
A medida que la tajada o porcin de material se va moviendo a lo largo de
la longitud del reactor, la concentracin del reactivo C
A
disminuye ya que
A se va consumiendo.
La densidad , la velocidad , y la concentracin C
A
, todas son funciones
del tiempo t y de la posicin axial z.
Seguiremos asumiendo que se mantienen las condiciones de flujo
acoplado, de tal manera, que no van a haber gradientes radiales de
velocidad, ni de densidad, ni tampoco de concentracin.
La concentracin de A, que est siendo alimentada a la entrada del reactor
en z=0, est definida como:
La concentracin de A en el lado efluente del reactor es decir en z=L est
definida como:
Debido al gradiente axial, ahora tenemos que aplicar nuestras ecuaciones
de continuidad de componentes para el reactivo A, a una porcin pequea
diferencial de ancho dz tal como se muestrea en la figura 2.4.
Figura 2.4 Reactor tubular.
Los trminos del flujo de entrada pueden dividirse en dos tipos: flujo por
conveccin y flujo por difusin. La difusin puede ocurrir debido al
gradiente de concentracin en la direccin axial. La difusin es el proceso
por medio del cual se produce un flujo neto de materia desde una regin
de alta concentracin hacia otra de menor concentracin. Por lo general,
en la mayora de los sistemas prcticos, el flujo por difusin es mucho ms
pequeo que el flujo volumtrico, pero lo estamos incluyendo aqu para
ver cul es su contribucin al modelo de este reactor en forma de tubo.
Al flujo por difusin de A, se le representa como N
A
, y tiene las unidades
de
Al flujo por difusin de A esta dado por la primera ley de Fick:
donde D
A
es el coeficiente de difusin debido a la difusin y a la
turbulencia en el caudal del fluido (a D
A
tambin se le conoce como la
Difusividad Eddy).
D
A
tiene las mismas unidades que una velocidad, es decir unidades de
longitud por unidad de tiempo.
El flujo molar que entra por z (compuesto del flujo volumtrico y del flujo
por difusin) est dado por:
Tasa de masa que entra =
[moles de A/seg]
La tasa de masa que sale por (z+dz) debida al flujo molar est dada por:
Tasa de masa que sale =
dz
Tambin est dada en unidades de [moles de A/seg]
Como las moles de A van disminuyendo porque la concentracin
disminuye con z y al final va a desaparecer A, entonces por la reaccin
qumica el agotamiento de A esta dado por:
Tasa de agotamiento de A =
La tasa de cambio de masa de A dentro del sistema est dada por:
Tasa de cambio de A dentro del sistema =
Como ya tenemos los cuatro trminos de un balance de masa con
reaccin qumica, entonces los sustituimos en la ecuacin (2.9) y
obtenemos:
Sustituyendo la ecuacin del flujo por difusin, que es la ecuacin (2.16),
en la ecuacin anterior, obtenemos:
Las unidades de esta ecuacin son *
+
2.2.2 Balance de Energa.
La primera ley de la termodinmica establece el principio de la
conservacin de la energa.
La ecuacin del balance de energa para un sistema abierto (es decir un
sistema en el cual puede ocurrir la entrada y la salida de un flujo de
materiales), est dada por la siguiente relacin:
[
=
[
]
Similarmente el balance de energa debe tomar en consideracin la
energa que libera o absorbe una reaccin. Por lo general el balance de
energa se escribe de la siguiente manera:
Tasa de energa Tasa de energa tasa de energa tasa de
que entra - que sale - asociada a la = acumulacin
al reactor del reactor reaccin de energa
El estado que generalmente se toma como referencia para las entalpias y
las energas internas son los componentes puros en la fase (liquida,
gaseosa o solida) a la cual ocurre la reaccin, una temperatura de 25C, y
la presin del sistema.
Si usamos este estado de referencia, podemos escribir que:
{
; las unidades son [energa/tiempo]
donde:
es la entalpia de la reaccin evaluada a 25C *
+
EJEMPLO DE UN PROCESO TERMICO AISLADO TERMICAMENTE
Considere el tanque que se muestra en la Figura 3.31.
En este proceso se asume lo siguiente:
- Los flujos volumtricos de la entrada y la salida, son iguales y
constantes
- Las Capacidades calorficas del lquido en la entrada y en la salida
son iguales y constantes.
- Las Densidades del lquido en la entrada y en la salida son iguales y
constantes.
- El lquido en el tanque est bien mezclado.
- El tanque tiene un buen aislamiento trmico de tal manera que las
prdidas de calor al medio ambiente son despreciables.
- La energa de entrada del agitador de paletas es despreciable.
Figura 3.31 Proceso Trmico
Estamos interesados en desarrollar el modelo matemtico y la funcin de
transferencia que nos permita describir este proceso, es decir, como es
que la temperatura de salida T(t) responde a cambios en la temperatura
de entrada T
i
(t).
Si tomamos como nuestro volumen de control al contenido del tanque, el
balance de energa de estado no estacionario esta dado por:
[
] [
] [
]
Vamos a ver cada uno de los trminos de la ecuacion anterior:
[
]
[
]
[
]
Colocando cada uno de estos trminos en la ecuacin del balance de
energa anterior obtenemos:
donde:
= caudal volumtrico, [m
3
/s]
densidades del liquido en la entrada y del liquido en la salida
respectivamente, [kg/ m
3
]
V = Volumen del liquido dentro del tanque, [m
3
]
Entalpias del lquido en la entrada y en la salida, [J/kg]
energa interna del liquido en el tanque, [J/kg]
Si deseamos poner la ecuacin anterior en funcin de las temperaturas, y
si tomamos como el estado de referencia para y al componente
puro en el estado liquido a 0F y a la presin del sistema, la ecuacin
anterior se convierte en:
donde:
Capacidades calorficas a presin constante del liquido en la
entrada y en la salida, respectivamente, *
Capacidad calorfica a volumen constante del liquido, *
Temperaturas del liquido en la entrada y en la salida, [C]
Como hemos asumido que las densidades y las capacidades calorficas son
constantes e iguales en todo el rango de operacin de temperaturas,
podemos escribir la ecuacin (3.31) como:
Esta ecuacin es una ecuacin diferencial lineal ordinaria de primer orden
que nos relaciona la temperaturas de entrada
y de salida .
Es importante observar que en esta ecuacin solamente hay una
incgnita, y es
La Temperatura de entrada
no es una incognita, es una variable de
entrada, y es la que fuerza a que la temperatura de salida cambie.
En este ejemplo, deseamos estudiar cmo es que
afecta a en
consecuencia somos nosotros los que decidimos como es que esta
temperatura de entrada va a cambiar. Por lo tanto
no se considera
una incgnita.
En lo que sigue del libro, las variables de entrada no las consideraremos
incgnitas, porque somos nosotros los que tenemos la libertad de
cambiarlas a nuestra voluntad. Podemos cambiarlas en la forma de un
escaln, de una rampa etc.
Para mostrar que esta es una ecuacin con una incgnita, explcitamente
escribiremos la ecuacion as:
1 ec., 1 inc., []
La ecuacin (3-3.3) es el modelo matemtico de este proceso.
La solucin de esta ecuacin diferencial da la respuesta de la temperatura
de salida en funcin del tiempo.
Como lo hemos mencionado hace solo un momento, la temperatura de
entrada
es la variable de entrada, a la cual algunas veces se le llama
la funcin forzante, o la funcin de excitacin, ya que es la variable que
fuerza a que la temperatura de salida cambie.
A la temperatura de salida se le conoce como la variable de salida, a la
cual algunas veces se le conoce con el nombre de la respuesta, debido a
que es la variable que responde a la funcin forzante, o variable de
entrada.
Como ya tenemos el modelo del proceso, el siguiente paso es resolver
esta ecuacin diferencial. Para resolverla, vamos a utilizar el mtodo de la
transformada de Laplace.
Pero para simplificar la solucin por Laplace y para que no hayan
condiciones inciales, vamos a usar las variables de desviacin, que en
realidad son variables que miden la desviacin de la variable con respecto
al valor de estado estacionario, y que en realidad no es nada ms que un
cambio de variables por traslacin de eje.
Como lo mencionamos al inicio de este ejemplo, lo que nos interesa es
obtener la funcion de transferencia que nos relacione a
.
Para obtener la funcin de transferencia,
vamos a seguir una serie de
pasos, y al final de este ejemplo vamos a formalizar este procedimiento.
Empezamos haciendo un cambio de variable que nos simplifique el
desarrollo de la funcin de transferencia requerida.
Escribimos el balance de energa en estado estacionario (como es en
estado estacionario y no hay cambios, la derivada es cero, y tambin como
no hay nada que vari en el tiempo quitamos la variacin o dependencia
del tiempo) tomando como volumen de control el contenido del tanque y
todo evaluado a las condiciones iniciales
(3-3.4)
donde:
valores de estado estacionario de las temperaturas de salida y de
entrada, respectivamente, []
Si restamos la ecuacin (3-3.4) de la (3-3.3) obtenemos:
(3-3.5)
Observe que hemos hecho un artificio en la derivada de la temperatura
que es el siguiente:
Con lo cual hemos demostrado que:
El cual es el resultado de restar los lados derechos de las ecuaciones (3-
3.3) y (3-3.4).
Este es solamente un artificio que siempre usaremos, porque resulta til
en la definicin de las variables de desviacin y en el desarrollo de las
funciones de transferencia.
Ahora haremos el cambio de variables (o translacion de ejes) y para esto
definiremos las siguientes variables de desviacin:
donde:
variables de desviacin de las temperaturas de salida y entrada,
respectivamente, []
Sustituyendo las ecuaciones (3-3.6) y (3-3.7) en la (3-3.5) nos da:
(3-3.8)
La ecuacin (3-3.8) es la misma que la ecuacin (3-3.3) excepto que est
escrita en trminos de variables de desviacin.
La solucin de esta ecuacin (3-3.8) nos dar como resultado la variable
de desviacin para una cierta entrada
Si quisiramos obtener la verdadera temperatura de salida la
obtendramos de la ecuacin (3-3.6), es decir sumndole
a
Las variables de desviacin se usan ampliamente en la teora de control.
Por consiguiente debemos tener bien claro el significado y la importancia
que las variables de desviacin tienen en el anlisis y diseo de los
sistemas de control de procesos.
El valor de la variable de desviacin indica el grado de desviacin que
tiene, del valor de estado estacionario inicial
.
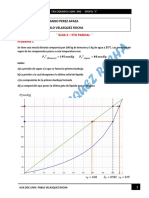
Pregunta quisiera una mayor explicacion del parrafo anterior?
su compaero indica que quiere un poco mas de explicacion sobre : El
valor de la variable de desviacin indica el grado de desviacin que tiene
esa variable, del valor de estado estacionario inicial
.
solucion
La variable de desviacion, su nombre lo indica, es una desviacion tomada
a partir de donde? No se si se acuerdan que les he dicho que la variable de
desviacion es una traslacion de ejes, ya no se mide desde el cero absoluto,
sino el cero ahora pasa a ser el valor de estado estacionario en t=0-,
entonces como el valor de estado estacionario es el cero, a partir de alli
cualquier desviacion que haya para arriba o para abajo es justamente eso
pues, cuando no se hace una translacion de ejes todo se mide con
respecto a un cero, temperatura cero absoluta, en este caso lo que
estamos haciendo es nuestro cero pasa a ser la condicion inicial en t=0-,
eso es; el valor en t=0- pasa a ser el valor de nuestro eje en el tiempo. A
partir de alli mido cualquier cosa, desde alli empiezo a medir mis
variaciones o mis desviaciones es por eso que ese parrafo dice eso.
Por eso mientras mas se aleja del valor inicial, mas se desvia, esta mas
lejos. Puede ser Ti o puede ser T, es indiferente, es que justamente la
desviacionm se hace partiendo del T, no del Ti. cual es la variable de este
sistema?. Para empezar este sistema de que grado o orden es?
es de primero. cuantas incognitas tiene? una, cual es la incognita T, la
T, entonces tenemos que havlar solo de la T, la Ti es una variable
accesoria, es una entrada o una perturbacion, es una variable constante o
conocida. Hay dos desviadas, la T y la Ti, pero la que me interesa es la T,
como responde la T con respecto al Ti. Y alli justamente en la grafica se
muestra como responde miren: mire el Ti es un escalon que es el que esta
aca justamente, y el sistema responde asi, que significa eso, que esta
entrando una temperatura desde t=-inf hasta t=0- lo cual nos indica que
en t=0- esta en una temperatura T barra, y logicamente Ti barra es igual a
T barra, los dos son iguales. El ti barra y el T barra son iguales porque
estamos en estado estacionario y nada se mueve todo esta sin moverse,
igual,todo esta estatico. Entonces en el tiempo 0- esta donde esta el
cursor del mouse alli se aplica un escalon en 0+, justo alli pasa el 0+. 0+ se
aplica el escalon y entonces a partir del 0+, la temperatura comienza a
gradualmente subir como si fuera un condensador, hasta que al final se
hace igual al Ti. Si hubiera bajado igual se hubiera bajado.y se hubiera
hecho en el tiempo infinito igual al Ti. esmuy parecido al tanque siempre
debemos pensar que el 0- es el que esta desde el inf al cero menos, y
tambien las condiciones iniciales salen con la ecuacion igualada a cero, no
puede salir cualquier condicion inicial ahi. Para un Ti debe salir un T.
Es por esto que este M que ven aca que seria, el eje de que, el eje de de
temperaturas esta bien, pero que mas, cual esla diferencia entre este eje y
este otro eje paralelo, hay dos ejes, por eso les digo, en este eje estoy
tomando el cero aca, es un cero verdero absoluto de temparatura, uy en
el otro eje hemos tromado el cero donde empieza la variable inicial. Aqui
hemos trasladado eleje, el cero esta aca, el cero esta aca. hay dos cero, un
cero esta aca que es el verdadero cero, y este es un cero, relativo. relativo
a que? relativo al T barra. Es igual que cuando medimos presion, cuando
medimos presion miren, el cero absoluto que es el vacio absoluto esta al
fondo, pero el ser humano que ha hecho, esta presion que se llama la
presion atmosferica, que es la que recibe toda esta columna de aire aca,
ha dicho para mi el cero esta aca, y ha tomado el cero alli. asi ha hecho
pues elser humano todo se ha hecho en ingenieria para tomar un cero de
referencia, igual cuando mide potencial, no se toma el potencial absoluto,
sino se toma el de referencia el que nos interesa en ese momento. De
igual manera como dice que este es el cero de presion, entonces si
ustedes bajan debajo del cero, ya es un vacio, ES UN VACIO para la presion
atmosferica o negativo. Pero si lo ven desde el punto de vista de aca de la
presion cero, del vacio absoluto, no es el cero pues absoluto. porque al
ser el cero aca, que significa que este eje cuanto vale aca? el valor inicial
vale cero, ya no vale T barra, entonces se me simplifica algebraicamente
Laplace porque vale cero.
En la prctica, este valor de estado estacionario
podra ser el valor
deseado de la variable. Al valor deseado, tambin se le llama la variable
controlada, o el punto de consigna SP del controlador.
Otra de las ventajas que se obtienen con el uso de estas variables de
desviacin, es que si asumimos que partimos del estado estacionario
inicial, (es decir nuetra referencia o translacion de ejes la hacemos
partiendo desde
), entonces, el valor inicial de la variable de desviacion,
es cero. Como la nueva ecuacion que vamos a resolver solo contiene las
variables llamadas de deviacion, al ser cero su condicion inicial, esto
simplifica grandemente la solucin de las ecuaciones diferenciales si las
resolvemos por el mtodo de la transformada de Laplace, tales como la
ec. (3-3.8), ya que su valor inicial seria cero y de esta forma se hace mas
simple la ecuacion algebraica en s, que ha resultado de aplicarle la
tranformada de Laplace.
Reordenando la ecuacin (3-3.8) obtenemos:
Si hacemos
Si chequeamos las unidades de la ecuacin (3-3.9) vemos que son:
Es decir son unidades de tiempo, por lo que definimos a como la
constante de tiempo.
Reemplazando la constante de tiempo, obtenemos:
(3-3.10)
Como la ecuacin (3-3.10) es una ecuacin diferencial lineal, aplicando la
transformada de Laplace obtenemos:
De la ecuacin (3-3.6),
, pero como el valor inicial de la
temperatura,
entonces
Este resultado, , lo hubieramos colocado sin pensar, ni
demostrarlo, ya que por definicion de las variables de desviacion, las
condiciones iniciales de las variables de desviacion son cero.
Reemplazando este valor y realizando algunas manipulaciones algebraicas
simples, obtenemos:
(3-3.11)
o
(3-3.12)
La ecuacin (3-3.12) es la funcin de transferencia deseada. Es una
funcin de transferencia de primer orden porque fue obtenida de una
ecuacin diferencial de primer orden. Es decir este proceso trmico es
descrito o caracterizado por una funcin de transferencia de primer orden
y por eso a estos procesos se les llama procesos de primer orden, o
sistemas de primer orden, o tambin retardos de primer orden. Todas
estas formas de llamarlos, son sinnimos.
Recordamos que la forma general de una funcin de transferencia de
primer orden es:
donde:
K= es la ganancia, el numerador
es la constante de tiempo, es el coeficiente de s.
No se olvide que el segundo trmino del denominador siempre debe ser 1.
La raz del denominador de la funcin de transferencia es
(tambien
se le llama el valor propio o el polo)
En este ejemplo del proceso trmico, comparando la ecuacion general con
la ecuacin (3-3.12) vemos que K es 1.
La palabra funcin de transferencia, proviene del hecho que la solucin de
la ecuacin traslada, o transfiere la entrada,
a la salida,
Como la temperatura de entrada al tanque podemos variarla a nuestra
voluntad, asumamos que esta aumenta desde el valor que tiene
actualmente, (
), la cantidad de Es decir que la temperatura
de entrada experimenta un cambio en escaln de M grados de
magnitud.
Esto se representa matemticamente de la siguiente forma:
Otra forma de representar lo mismo, pero con variables de desviacin es
la siguiente:
donde representa un cambio en escaln de magnitud uno.
Aplicando la transformada de Laplace a
obtenemos:
Si sustituimos esta expresin de
en la ecuacin (3-3.11) nos resulta:
Usando el mtodo de solucin por fracciones parciales, nos da:
Despejando algebraicamente los valores de A, y de B, y luego volviendo al
dominio del tiempo, nos da:
(3-3.13)
Esta solucin es en variables de desviacin, pero en variables normales:
(3-3.14)
Las soluciones dadas en las ecuaciones (3-3.13) y (3-3.14) se muestran
grficamente en la figura 3-3.2.
Figura 3-3.2 Respuesta de un proceso de primer orden a un cambio en escaln en la variable de entrada
Observamos que la pendiente mas empinada de la curva (de respuesta)
ocurre al comienzo de la curva; esta es la respuesta tpica de un sistema de
primer orden a un cambio en escaln en la entrada.
Ahora vamos a ver el significado de la constante de tiempo del proceso,
Para calcular el valor de la temperatura cuando , en la ecuacin
(3-3.13), hacemos que , y esto nos da:
Es decir, cuando la variable de entrada, sufre un cambio en escaln,
entonces en , la variable de salida alcanze el 63.2% de su cambio
total; esto se muestra grficamente en la Figura 3-3.2.
Tambin observamos que el proceso alcanza el 99.3% de su cambio total
en aproximadamente, cinco constantes de tiempo, ; es decir, que en
podemos decir que practicamente la respuesta se ha completado, o que
ya ha llegado a su estado final.
Por lo tanto, podemos decir, que, la constante de tiempo , est
relacionada a la velocidad de respuesta del proceso. Mientras ms lento
un proceso responda a una entrada, es porque ms grande es la constante
de tiempo, , y al revs, mientras ms rpido responda un proceso a una
entrada, es porque ms pequeo es el valor de la constante de tiempo
Es importante que nos demos cuenta que la constante de tiempo, dada
por la ecuacin (3-3.9)
,est formada de:
- diversas propiedades fsicas del proceso
- diversos parmetros de operacin del proceso
Es decir, la constante de tiempo depende:
- del volumen de liquido en el tanque (V),
- de las capacidades calorficas (
), y
- del flujo del proceso (f).
Si cualquiera de estas caractersticas cambia, tambin cambiara el
comportamiento del proceso, y este cambio se ver reflejado en la
velocidad de respuesta del proceso, o en la constante de tiempo.
EJEMPLO DE UN PROCESO TERMICO SIN AISLAMIENTO TERMICO
Hasta hora habamos asumido que el tanque estaba bien aislado
trmicamente, es decir, que las prdidas de calor al medio ambiente
exterior eran despreciables. En consecuencia, en el balance de energa
anterior, no exista un trmino de prdidas de calor.
Ahora retiraremos esta suposicin, y desarrollaremos un modelo
matemtico y una funcin de transferencia, que nos relacione la
temperatura de salida, , con la temperatura de entrada,
, y con la
temperatura del medio ambiente,
.
Al igual que hemos hecho anteriormente, usando el mismo estado de
referencia para las entalpias y para la energa interna, (el estado de
referencia que hemos tomado es el componente puro en el estado
lquido, la temperatura de referencia es 0F y a la presin de referencia es
la presin del sistema), vamos a empezar con un balance de energa de
estado no estacionario:
1 ec. 1 incgnita (3-3.15)
Pero como el calor debido a las perdidas, , se est transmitiendo
hacia afuera del tanque por un rea que es el rea del tanque, las prdidas
de calor , se modelan mediante la siguiente ecuacin:
donde:
= tasa de transferencia de calor hacia el exterior del tanque, [J/s]
U = coeficiente de transferencia de calor total, [J/m
2
-K-s]
A = rea por donde se esta transfiriendo el calor, [m
2
]
Temperatura en los exteriores del tanque, [], esta se considera
una variable de entrada o una perturbacin.
El coeficiente de transferencia de calor total, , es funcin de varias
variables, una de ellas es la temperatura. Sin embargo, en este ejemplo en
particular, asumiremos que es una constante. Como hemos asumido
que la densidad del lquido y la masa de lquido en el tanque tambin son
constantes, entonces la altura del lquido en el tanque tambien es
constante, y en consecuencia, el rea por donde se transfiere el calor
hacia el exterior A, tambin es constante.
La ecuacin (3-3.15) es el modelo matemtico del proceso. En este
modelo, todava seguimos teniendo una ecuacin y una incgnita, por lo
que s sera posible solucionar matemticamente la ecuacin.
Lo que ha aumentado, es que ahora tenemos una nueva variable que es la
temperatura en las afueras del tanque,
, la cual es otra entrada. No
olvidemos que la otra entrada es
. Cuando esta temperatura
cambia, afecta las prdidas de calor y en consecuencia tambin afecta la
temperatura del liquido dentro del tanque.
Para obtener las funciones de transferencia, empezaremos introduciendo
las variables de desviacin.
Esto se logra primero escribimos el balance de energa en estado
estacionario del proceso a las condiciones inciales; segundo, restamos la
ecuacin de balance de energa en estado no estacionario con la anterior
ecuacin, y por ultimo definimos las nuevas variables de desviacin de la
resta resultante.
Vamos a hacerlo.
Primero hallamos el balance de energa del proceso en estado
estacionario a las condiciones inciales:
No se olvide que esta ecuacion la hemos obtenido a partir de la ecuacion
de balance en estado no estacionario (3-3.15) haciendo la derivada cero y
reemplazando las variables T(t),
, y
por sus valores iniciales en
.
Continuando con el procedimiento para pasar la ecuacion a variables de
desviacion, luego restamos la ecuacin (3-3.16) de la ecuacin (3-3.15), lo
cual nos da:
Observe que hemos aplicado nuevamente el artificio con el trmino de la
derivada (el de la acumulacin).
Por ltimo definimos una nueva variable de desviacin como:
Sustituyendo las ecs. (3-3.6), (3-3.7), y (3-3.18) en la ec. (3-3.17),
obtenemos:
Note, que la ecuacin (3-3.19) es tambin una ecuacin diferencial lineal
ordinaria de primer orden, y que tambin es la misma que la ecuacin (3-
3.15), solo que la (3-3.15) est escrita en variables normales y la otra (3-
2.19) esta escrita en variables de desviacin.
Reordenando la ecuacin (3-3.19), tenemos:
Simplificando, tenemos
donde:
El lado derecho de la ecuacin (3-3.20) nos muestra claramente que en
esta ecuacin, hay dos variables de entrada,
, las cuales
estn actuando sobre la variable de salida ,
Aplicando la transformada de Laplace a ambos lados de la ecuacin (3-
3.20) nos queda:
Pero, el valor inicial de la temperatura, , es
, por lo tanto
Reordenando esta ecuacin, nos da:
Si en la ecuacin (3-3.24) hacemos que la temperatura exterior al tanque
permanezca constante, es decir hacemos que
entonces,
, y la funcin de transferencia que nos relaciona la temperatura
de salida a la temperatura de entrada es:
Si ahora, en la ecuacin (3-3.24) hacemos que la temperatura del liquido
que entra al tanque permanezca constante, es decir hacemos que
entonces,
, y la funcin de transferencia que nos
relaciona la temperatura de salida con la temperatura exterior al tanque
es:
Si las dos temperaturas cambian, la temperatura del liquido que est
entrando al tanque, y la temperatura externa al tanque, entonces la
ecuacin (3-3.24) es la que nos proporciona la solucin completa, sin
embargo en este caso ya no sera una funcin de transferencia, ya que una
funcin de transferencia relaciona solo una salida con una sola entrada y
en este caso habran dos entradas y una salida.
Las ecuaciones (3-3.25) y (3-3.26) siguen siendo funciones de
transferencia tpicas de primer orden; sin embargo, en este caso las
ganancias de estado estacionario (a las cuales tambin se les llama
ganancias del proceso), K
1
y K
2
, ya no son la unidad, como si, fue el caso de
la ecuacin (3-3.12) del tanque con aislamiento trmico.
Para revisar brevemente el significado de las ganancias de estado
estacionario, asumamos que solamente la temperatura de entrada al
tanque aumenta, en la forma de un escaln, en , es decir:
Otra forma de representar lo mismo, pero con variables de desviacin es:
Aplicando la transformada de Laplace a
obtenemos:
Si sustituimos esta expresin de
en la ecuacin (3-3.25)
obtendremos la respuesta de la temperatura a esta funcin forzante:
De la cual obtenemos la respuesta en el tiempo usando expansin por
fracciones parciales:
O
La respuesta de la salida se muestra grficamente en la figura 3-3.3.
Figura (3-3.3) Respuesta de un proceso de primer orden a un cambio en escaln de la variable de entrada.
De la grafica vemos que el cambio total de es
, o sea, la cantidad
total de cambio, es la ganancia multiplicada por el cambio en la entrada.
Por lo tanto, se puede decir que la ganancia indica cuanto cambia la
salida por unidad de cambio en la entrada, o lo que es lo mismo, cuanto
es que afecta la entrada a la salida. Es decir, la ganancia define la
sensibilidad del proceso, relacionando las variables de entrada y de
salida!.
La ganancia se define matemticamente como la variacin de la variable
de salida sobre la variacin de la variable de entrada, as:
La ganancia es otro parmetro que describe las caractersticas del proceso
que se controla y, en consecuencia, depende de las propiedades fsicas y los
parmetros de operacin del proceso, como se muestra mediante las
ecuaciones (3-3.22) y (3-3.23).
Las ganancias de este proceso dependen del flujo , de la densidad ,
de la capacidad calorfica del lquido que se procesa (Cp), del coeficiente
global de transferencia de calor (U) y del rea de transferencia de calor (A).
Si cambia cualquiera de estos factores, el comportamiento del proceso
cambia y repercute sobre la ganancia.
En este ejemplo particular, vemos que las ganancias son constantes, sobre
todo el rango de operacin, al igual que nos salio con la constante de
tiempo.
En este ejemplo existen dos ganancias: K1, que relaciona la temperatura de
salida con la temperatura de entrada; y K2, que relaciona la temperatura de
salida con la temperatura del medio ambiente. Las unidades de la ganancia
deben ser las unidades de la variable de salida, divididas entre las unidades
de la funcin de forzamiento o variable de entrada, lo cual se puede
apreciar en la ecuacin (3-3.29).
Observe que la ganancia indica en forma clara las caractersticas del
proceso. En la primera parte de este ejemplo asumimos que el tanque
estaba bien aislado trmicamente y la ganancia que fue dada en la ecuacin
(3-3.12) fue uno 1.
Es decir, en estado estacionario toda la energa que est entrando con el
caudal de entrada sale igual por el caudal de salida, y las temperaturas de
entrada y de salida son iguales.
Este no es el caso cuando ya no mantenemos la suposicin de que hay un
buen aislamiento trmico en el tanque, ya que en este caso se permite que
el tanque transfiera calor al ambiente exterior.
Observe que K
1
dada por la ecuacin (3-3.22) es menor de la unidad, lo
cual indica que cuando la temperatura de entrada aumenta, en M grados, la
temperatura de salida no aumenta en la misma cantidad de grados.
Es decir, si la energa en el caudal de entrada aumenta, la energa en el
caudal de salida no aumenta en la misma cantidad debido a que ahora
existe una transferencia de energa al ambiente exterior del tanque;
naturalmente que esto tambin tiene sentido.
Tambin tiene sentido que si
la temperatura de entrada tendr
un mayor impacto en la temperatura de salida que la temperatura del medio
ambiente, es decir,
En la ecuacin (3-23) se aprecia que a pesar de que existen dos ganancias,
slo existe una constante de tiempo en el proceso.
Es decir, el tiempo que se necesita para que la temperatura alcance un
cierto porcentaje de su cambio total, debido a un cambio en la temperatura
de entrada, es igual al tiempo que se necesita para que alcance el mismo
porcentaje cuando es la temperatura ambiente la que cambia.
Este caso en el que solo hay una constante de tiempo, no siempre se
produce, en el presente ejemplo existe ms de una ganancia, hay una por
cada funcin de forzamiento; en algunos procesos puede haber ms de una
constante de tiempo, probablemente una por cada funcin forzante.
Conforme se avance en el estudio se vern algunos ejemplos de esto.
Durante el anlisis del proceso, siempre es importante detenerse en algn
punto para verificar si hay errores en el desarrollo. Un punto conveniente se
encuentra generalmente despus del desarrollo de la ecuacin (3-3.20).
Se puede realizar una verificacin rpida mediante el examen de los signos
de las ecuaciones, para comprobar si tienen sentido en el mundo real. Por
ejemplo, en dicha ecuacin (3-3.20), ambas ganancias son positivas, lo cual
indica que si la temperatura de entrada se incrementa, la temperatura de
salida tambin aumenta; lo cual tiene sentido en este proceso.
La ecuacin (3-3.20) tambin muestra que si la temperatura ambiente
aumenta, la temperatura de salida tambin se incrementa; esto tiene sentido
porque, al aumentar la temperatura ambiente, decrece la tasa de prdidas de
calor del tanque y, por tanto, aumenta la temperatura del contenido del
tanque.
Otra verificacin que se puede hacer consiste en examinar las unidades de
y
Ya sabemos que unidades deben tener estos parmetros y por lo tanto, las
ecuaciones desde la (3-3.21) hasta la (3-3.23) de este ejemplo, en las que se
definen estos dos trminos, deben de confirmar las unidades que esperamos
obtener.
Con esta verificacin rpida se aumenta la confianza y se puede continuar
el anlisis con la renovada expectativa del posible xito de obtener la
respuesta del proceso.
Resumen:
El procedimiento para desarrollar las funciones de transferencia es el
siguiente:
1. Escribir el conjunto de ecuaciones de estado no estacionario que
describen al proceso. Esto es lo que se llama el modelo del sistema.
2. Escribir las ecuaciones de estado estacionario a las condiciones
inciales.
3. Restar los dos conjuntos de ecuaciones, y definir las variables de
desviacin.
4. Aplicar la transformada de Laplace al modelo obtenido con variables
de desviacin.
5. Obtener las funciones de transferencia resolviendo la transformada
de Laplace explcitamente para la variable de salida en el dominio s.
TIEMPO MUERTO
Considrese el proceso que se muestra en la figura 3-4.1, que es
esencialmente el mismo proceso trmico de la figura 3-3.1.
La diferencia consiste en que, en este caso, se ha colocado una tuberia bien
larga a la salida del tanque, y lo que interesa es conocer cmo responde
a los cambios en la temperatura de entrada
y en la temperatura
ambiente
.
Figura 3-4.1 Proceso trmico con tiempo muerto.
Se hacen las dos siguientes suposiciones acerca del conducto de salida, que
est ubicado entre el tanque y el punto 1:
Primera, el conducto est bien aislado trmicamente; es decir no hay
perdidas termicas de calor al medio ambiente por esta tuberia.
Segunda, el flujo del lquido a travs del conducto de salida es altamente
turbulento, en el que no hay transferencia de energa por dispersin ni por
difusin, de tal manera que bsicamente no hay mezcla de retorno en el
lquido de la tubera de salida, en consecuencoia podemos decir que se trata
de un flujo con acoplamiento. Es decir no hay gradientes de velocidad en la
direccin radial cuando se da un corte transversal a la tubera.
Bajo estas suposiciones, la respuesta de
a los disturbios
ser la misma que la respuesta de , con la excepcin de que
ahora tiene un retardo de cierto intervalo de tiempo.
Es decir, existe una cantidad finita de tiempo entre el momento en el que se
produce la respuesta inicial de y el cambio inicial de
y este
retardo de tiempo se ilustra grficamente en la figura 3-4.2, para un cambio
en escaln de la temperatura de entrada
.
Figura 3-4.2 Respuesta de un proceso trmico a un cambio en escaln en la temperatura de entrada.
Esta cantidad finita de tiempo que existe entre el momento en que el
disturbio entra al proceso y el tiempo en el que la temperatura
empieza a responder se conoce como tiempo muerto, retardo de tiempo o
retardo de transporte y se representa mediante el termino
. Este tiempo
muerto, se ha producido debido al tiempo que demora el lquido para
moverse desde la salida del tanque hasta el punto 1.
En este ejemplo en particular, el tiempo muerto
puede calcularse de la
siguiente manera:
(3-4.1)
donde:
caudal volumtrico, [m
3
/s]
rea de una seccin cuadrada de la tubera, [m
2
]
Longitud de la tubera de salida, [m]
tiempo muerto, [segundos]
Recordemos, que las diferentes variables fsicas viajan a diferentes
velocidades:
- El voltaje y la corriente viajan a la velocidad de la luz: 300,000 km/s,
984,106 ft/s.
- El caudal y la presin de un lquido viajan a la velocidad del sonido
en el fluido: 340 m/s 1100 ft/s.
- La temperatura, la concentracin y algunas otras propiedades de los
fluidos viajan a la velocidad del fluido: generalmente la velocidad
tpica de los fluidos lquidos es de 5 m/s (15 ft/s) y para los gases es
de 60 m/s (200 ft/s).
- Las propiedades de los slidos, viajan a la velocidad a la que est
viajando el slido, por ejemplo, el carbn en una faja transportadora,
el queque o torta de la cama de un filtro, y el papel en una maquina
de papel.
De la informacin anterior, podemos apreciar que para las distancias tpicas
que se manejan en los sistemas de control de procesos industriales, el
tiempo muerto solamente es importante para la temperatura, para la
concentracin y para algunas otras propiedades de los slidos y de los
fluidos que se propagan a travs del espacio por el fluido o slido que se
est moviendo.
Como hemos visto en este ejemplo, el tiempo muerto se desarrolla a causa
del tiempo que toma para que el lquido se mueva desde la salida del
tanque hasta el punto 1. Sin embargo, en la mayora de los procesos el
tiempo muerto no se define tan fcilmente como aqui, generalmente es
inherente y se distribuye a lo largo del proceso, es decir, en el tanque, el
reactor, la columna, etc.; en tales casos, el valor numrico no se evaluara
tan fcilmente como en el presente ejemplo, sino que se requiere un modelo
muy detallado o una evaluacin emprica.
Aun cuando el tiempo muerto de un proceso sea despreciable, en
comparacin con su constante de tiempo, la respuesta de muchos procesos
puede dar la impresin que tienen tiempo muerto, cuando se les combina en
serie, por ejemplo cuando se combinan en serie varios procesos de primer
orden, tal como veremos posteriormente en los captulos 4 y 6.
Este seudo tiempo muerto no se puede calcular fcilmente usando los
principios fundamentales de la fsica, y por lo tanto se deben de obtener
empricamente por aproximacin de la respuesta del proceso.
Los mtodos para calcular empricamente los tiempos muertos los veremos
ms adelante.
El tiempo muerto es parte integral de un proceso y, consecuentemente, se
debe tomar en cuenta en las funciones de transferencia que relacionan
con los disturbios
.
La ecuacin (2-1.8) expresa que la transformada de Laplace de una funcin
con retardo es igual al producto de la transformada de Laplace de la
funcin, sin retardo, multiplicada por el trmino
.
El trmino
es la transformada de Laplace del tiempo muerto puro y,
por tanto, si lo que interesa es la respuesta de
a los cambios en
, usando las suposiciones que se hicieron al comienzo de la
seccin, se deben multiplicar las funciones de transferencia, que son las
ecuaciones (3-3.25) y (3-3.26), por el termino
, o en otras palabras:
(3-4.2)
y
(3-4.3)
En este punto se debe reconocer que el tiempo muerto es otro parmetro
que ayuda en la definicin de las caractersticas del proceso. En la ecuacin
(3-4.1) se aprecia que
depende de algunas propiedades fsicas y
caractersticas operativas del proceso, como son K y . Si cambia
cualquiera de las condiciones del proceso, esa variacin se puede reflejar
en un cambio de
.
Antes de concluir esta seccin es necesario mencionar que la presencia de
una cantidad significativa de tiempo muerto en un proceso, es la peor cosa
que le puede ocurrir a un sistema de control; como se ver en los captulos
6 y 7, el tiempo muerto afecta severamente el funcionamiento de un
sistema de control con realimentacin.
Por lo tanto, los procesos y los sistemas de control se deben disear
manteniendo el tiempo muerto lo ms pequeo que sea posible.
Se pueden tomar algunas medidas para minimizar el tiempo muerto,
incluyendo poner los sensores de medicin lo ms cerca posible al equipo,
o seleccionar sensores que respondan rpidamente y seleccionar elementos
de control final que respondan rpidamente, y usar instrumentacin
electrnica en lugar de usar instrumentacin neumtica para procesos con
constantes de tiempos pequeas, ya que el tiempo muerto no se evala si es
grande o chico por su valor absoluto grande o pequeo, sino por su valor en
relacin a la constante de tiempo del proceso..
EJEMPLO 2.6
Una vez ms vamos a considerar el sistema del tanque reactor que vimos
en el ejemplo 2.3, y donde escribimos el balance de masa. Pero esta vez
vamos a agregarle un serpentn de enfriamiento dentro del tanque, y cuya
funcin ser retirar el calor que libera la reaccin exotrmica. Las
unidades de se expresan en :
*
+ en el sistema SI de unidades, o en
*
+ en el sistema de unidades en ingles
El sistema se muestra en la figura 2.5.
Figura 2.5 CSTR con enfriamiento del calor.
Vamos a usar la convencin normal de que es negativo para una
reaccin exotrmica (que libera calor) y que es positivo para una
reaccin endotrmica (que absorbe calor).
La velocidad o tasa de generacin de calor, (energa por tiempo), debida a
la reaccin es la tasa de consumo de A multiplicada por
La tasa de enfriamiento del calor proveniente de la masa que reacciona
hacia el serpentn de enfriamiento es Q (energa sobre tiempo).
La temperatura del flujo de alimentacin es T
0
y la temperatura dentro del
reactor es T (en R en K).
La ecuacin general de balance de energa para este sistema (ec. 2.18) es:
donde:
U = energa interna (energa por unidad de masa)
K = energa cintica (energa por unidad de masa)
= energa potencial (energa por unidad de masa)
W = trabajo en el eje hecho por el sistema (energa por tiempo)
P = presin del sistema.
P
0
= presin del flujo de alimentacin.
Observe que todos los trminos de la ecuacin (2.20) deben tener las
mismas unidades (energa sobre tiempo), de tal manera que los trminos
de la energa FP de la ecuacin, deben multiplicarse por sus respectivos
factores de conversin para que estn en las mismas unidades que el
resto de los trminos.
En el sistema de ingeniera de unidades inglesas, este factor de conversin
que se usa es: 778 ft. Lb
f
/ Btu
En el sistema que se muestra en la figura 2.5 no se realiza trabajo en el eje
mecnico, por lo que W = 0.
Si las velocidades de entrada y salida no son muy altas, podemos
despreciar el trmino de la energa cintica. De igual forma, si las alturas
de los flujos de entrada y salida son aproximadamente iguales, podemos
despreciar el trmino de la energa potencial.
Por lo tanto la ecuacin (2.20) se reduce a:
donde:
es el volumen especifico, expresado en [pies
3
/lbm] o [en m
3
/kg] y es el
reciproco de la densidad.
La entalpia con el smbolo H h, est definida como:
Por convencin, la notacin que vamos a usar es: h la usaremos para la
entalpia de lquidos y H la usaremos para la entalpia de gases.
Por lo tanto, con todas las simplificaciones que hemos realizado, la
ecuacin (2.21) se convierte en :
Para lquidos, el termino P
es despreciable en comparacin con el
termino U, y por consiguiente usaremos h que es el cambio de la entalpia
del sistema en lugar de usar U que es el cambio de la energa interna del
sistema. Con estas simplificaciones, la ecuacin (2.23) se transforma en:
Las entalpias son funcin de la concentracin, de la temperatura y de la
presin, pero principalmente dependen de la temperatura. De los cursos
de termodinmica sabemos que, el calor especfico a presin constante C
p
,
y el calor especfico a volumen constante C
v
son:
Para indicar que la energa interna depende principalmente de la
temperatura, simplificaremos el problema asumiendo que la entalpia del
lquido podemos expresarla como el producto de la temperatura absoluta
y de una capacidad calorfica promedio que es constante, es decir:
Tambin vamos a asumir que las densidades de todos los caudales
lquidos, son constantes. Con todas estas simplificaciones, la ecuacin
(2.24) se convierte en:
EJEMPLO 2.7
Para mostrar cual es la forma que toma la ecuacin de balance de energa
para un sistema con dos fases, considere la figura 2.6, que es un proceso
de un tanque reactor con agitacin continua CSTR.
Figura 2.6 CSTR de dos fases con enfriamiento
Son dos los productos que se extraen del tanque: un caudal liquido F y un
flujo (volumtrico) de vapor F
v
.
La presin en el tanque del reactor es P. Los volmenes del lquido y del
vapor son V
L
y V
V
respectivamente.
La densidad y la temperatura en la fase vapor son
respectivamente
La fraccin molar de A en la fase vapor es y.
Si las dos fases se encuentran en equilibrio trmico, las temperaturas del
vapor y del liquido son iguales (T = T
V
).
Si las dos fases se encuentran en equilibrio de fases, las concentraciones
del vapor y del lquido deben estar relacionadas por alguna de estas
formulas:
a) Por la ley de Raoult, o
b) Por alguna de las ecuaciones de volatilidad relativa, o
c) Por alguna otra ecuacin de equilibrio vapor-liquido (ver la seccin
2.2.6)
La entalpia de la fase vapor, H, es funcin de la concentracin y, de la
temperatura T
V
y de la presin P. H =f(y, T
V
, P)
,
Las unidades de H son: *
+ *
+
Si despreciamos los trminos de la energa cintica, de la energa
potencial, y del trabajo, y reemplazamos en el trmino de la derivada con
respecto al tiempo lo que son las energas internas por entalpias,
entonces la ecuacin del balance de energa del sistema, (que abarca los
contenidos de vapor y de lquido del tanque) es la siguiente:
Con el objeto de poder expresar la ecuacin anterior en forma explcita en
funcin de la temperatura, una vez ms usaremos una expresin simple
para la entalpa en el lquido h:
e igualmente una expresin simple para la entalpia en el vapor H:
donde:
es el calor de vaporizacin promedio de la mezcla.
Si usramos un modelo ms riguroso,
no sera constante, sino mas
bien seria funcin de la temperatura T
V
, de la concentracin y, y de la
presin P.
Con las simplificaciones anteriores, la ecuacin (2.27) se convierte en:
EJEMPLO 2.8
Para ilustrar la aplicacin de la ecuacin de balance de energa a un
sistema microscpico, retornaremos a nuestro reactor tubular con flujo
acoplado, que vimos anteriormente, solo que ahora vamos a hacer un
seguimiento a los cambios de temperatura conforme el fluido pasa por la
tubera.
Una vez mas y debido al flujo acoplado, asumiremos que no existen
gradientes radiales en la velocidad, ni en la concentracin, ni en la
temperatura. Esta suposicin es una aproximacin pobre para sistemas
fuertemente exotrmicos (que liberan grandes cantidades de calor) si es
que el dimetro de la tubera del reactor no es pequea.
Supongamos que al reactor tubular se le ha colocado a su alrededor una
chaqueta de enfriamiento, tal como se muestra en la Figura 2.7.
El calor se puede transferir desde los reactivos y los productos del fluido
del proceso, hasta la pared metlica del reactor.
Figura 2.7 Reactor tubular con chaqueta.
La pared metlica del reactor esta a una temperatura T
M
, y los reactivos y
los productos estn a una temperatura T.
Desde all el calor es transferido al agua de enfriamiento que est dentro
de la chaqueta.
Si quisiramos hacer una descripcin completa de este sistema,
tendramos que derivar las ecuaciones de balance de energa para el fluido
del proceso, para la pared metlica, y para el agua de enfriamiento.
Por lo pronto, solo vamos a realizar las ecuaciones del balance de energa
para el proceso.
Si tomamos como nuestro volumen de control o sistema una pequea
porcin de fluido, podemos obtener cada uno de los trminos de la
ecuacin de balance de energa (2.18).
Asumiremos que los trminos de la energa cintica, la energa potencial y
el trabajo realizado son despreciables.
Tambin asumiremos que estamos usando las formas simplificadas de la
energa interna y de la entalpia.
Se asume tambin que el flujo volumtrico es mucho mayor que el flujo
por difusin.
Incluiremos la posibilidad de conduccin del calor axialmente en toda la
longitud del reactor debido a la conduccin molecular o turbulenta.
La energa que entra en z por la temperatura (entalpia) que trae el flujo
volumtrico es:
donde
V = velocidad del fluido en [ft/min]
A = rea del reactor tubular [ft
2
]
= densidad del fluido [lbm/ft
3
]
=capacidad calorfica *
+
T = temperatura con la que ingresa el fluido en z, [R]
Reduciendo unidades, nos queda:
ft/min] [ft
2
] [lbm/ft
3
] *
+ [R] = Btu/min
La energa que sale por (z+dz) es:
Calor generado por la reaccin qumica =
Calor que se transfiere a la pared metlica =
donde:
= coeficiente pelicular de transferencia de calor [Btu/min ft
2
R]
D = dimetro de la tubera en pies
Calor por conduccin, que entra en z =
donde :
es el flujo de calor en la direccin z debida a la conduccin.
Usaremos la ley de Fourier para expresar
como una fuerza de
excitacin de temperatura:
donde
k
T
es la conductividad trmica eficaz [Btu/ft min R]
El calor que sale por conduccin en (z+dz) =
Tasa de cambio de
energia interna (entalpia) =
dentro del sistema
Combinando todas las ecuaciones anteriores obtenemos:
2.23 ECUACIONES DE MOVIMIENTO
Tal como se aprendi en el colegio en secundaria, la segunda ley del
movimiento de Newton establece que, para un sistema con masa
constante M, la fuerza es igual a la masa multiplicada por la aceleracin.
donde:
Fuerza [lbf]
masa [lbm]
aceleracin [pie/s
2
]
32.2 *
+ ; es una constante de conversin. Esta
constante, se utiliza cuando se usan las unidades del sistema ingles, para
que las unidades tengan coherencia.
No se confunda con la constante universal de la gravedad , la cual es una
constante, que en el sistema ingles de unidades es igual a 32.2 pies/s
2
La ecuacin (2.32) es la relacin fundamental que se usa para plantear las
ecuaciones de movimiento de un sistema.
Para el caso ms general, en el que la masa puede variar con el tiempo, la
ecuacin de movimiento es:
donde:
velocidad en la direccin i, [pies/s]
jesima fuerza que est actuando en la direccin i.
La ecuacin (2.33) nos indica que:
la tasa de cambio del momento en la direccin i, es igual a la suma neta de
las fuerzas que actan en la direccin i.
La palabra tasa, significa el cociente de algo con respecto al tiempo, y el
momento en la direccin i, es igual a la masa multiplicada por la velocidad
en la direccin i.
Podemos decir que la ecuacin de movimiento (2.33), es la ecuacin del
balance de fuerzas en estado dinmico o en estado no estacionario. A esta
ecuacin, tambin se le conoce como la ecuacin de conservacin del
momento.
En el mundo real hay tres direcciones: y . Por lo tanto, para cualquier
sistema, se pueden escribir tres ecuaciones de balance de fuerzas.
En consecuencia, todo sistema consta de:
- Tres ecuaciones de movimiento, mas,
- Un balance de masa total,
- Una ecuacin de balance de energa, y
- (NC-1) ecuaciones de balance por componente.
En lugar de escribir tres ecuaciones de movimiento, por lo general es ms
conveniente (y siempre resulta ms elegante) escribir las tres ecuaciones
como una sola ecuacin vectorial.
En este libro no usaremos la notacin (forma) vectorial ya que todos
nuestros ejemplos sern simples balances de fuerza en una dimensin.
En el campo de la mecnica de fluidos se hace un uso extensivo de la ley
de la conservacin del momento.
EJEMPLO 2.9
El sistema del tanque de flujo por gravedad que se describi en el captulo
1, nos sirve como un ejemplo simple de la aplicacin de las ecuaciones de
movimiento a un sistema macroscpico.
Figura 1.1 Tanque en el que el flujo fluye por gravedad.
Hallar la ecuacin de balance de fuerzas para la figura 1.1.
Solucin
Refirindonos a la figura 1.1; sea L (pies) la longitud de la tubera
horizontal de salida, y sea A
p
el rea de su seccin cuadrada (pies
2
). Sea A,
(pies
2
) el rea de la seccin cuadrada del tanque cilndrico vertical.
Solo vamos a aplicar la ecuacin de balance de fuerzas a una parte de este
proceso, al lquido que fluye a travs de la tubera de salida. No vamos a
aplicar al tanque cilndrico principal.
Para aplicar la ecuacin de balance de fuerzas, tenemos que hallar todas
las fuerzas que actan sobre el lquido de la tubera y luego reemplazarlas
todas esta fuerzas en la ecuacin (2.33) que es la ecuacin del balance de
fuerzas.
El lquido en la tubera se mueve de izquierda a derecha, por la presin
que ejerce la altura del lquido en el tanque. Esta altura de liquido en el
tanque, aplica una fuerza por el extremo izquierdo de la tubera, y la nica
fuerza que se le opone, es la fuerza de la viscosidad que fricciona de
derecha a izquierda. Por lo tanto tenemos que hallar estas dos fuerzas que
actan en la tubera.
Calculo de la fuerza hidrulica.
Si la densidad del lquido es , la masa total de lquido dentro de la
tubera, ser la densidad del lquido multiplicada por el volumen de la
tubera:
(
)
Recuerde que para este tanque con flujo por gravedad, hemos asumido
que por la tubera tenemos flujo con acoplamiento y que el liquido es
incompresible y por lo tanto todo el liquido se est moviendo con la
misma velocidad por toda la tubera, casi como si fuera una varilla solida
(en otro instante de tiempo puede haber otra velocidad diferente pero
esta velocidad diferente a la anterior es igual en toda la longitud del tubo).
Si el flujo dentro de la tubera de salida es turbulento, esta asuncin que
hemos hecho del flujo acoplado es buena.
Entonces, con la suposicin del flujo acoplado, la masa del lquido en la
tubera tendr una velocidad v, (pies/s) igual al flujo volumtrico dividido
por el rea de la seccin cuadrada de la tubera.
Como estamos asumiendo que la tubera en todo momento est llena, la
masa de lquido en la tubera no va a cambiar con el tiempo, por lo tanto,
si quisiramos cambiar el flujo de salida, la velocidad debe cambiar. Y para
cambiar la velocidad o el momento del lquido, deberemos de ejercer una
fuerza sobre el lquido.
En este problema, la direccin de la fuerza que nos interesa es la
horizontal, ya que hemos asumido que la tubera esta horizontal. La fuerza
que empuja sobre el lquido en el extremo de la parte izquierda de la
tubera, es la fuerza de la presin hidrulica del lquido contenido en el
tanque.
Como :
En el sistema ingles esta fuerza hidrulica se expresa como:
Re-arreglando:
Donde:
En el sistema de unidades inglesas, las unidades de esta fuerza hidrulica
estn dadas en:
Las presiones estticas al inicio y al final de la tubera son las mismas, (la
atmosfrica) por lo que no necesitamos incluirlas ya que se anulan.
Calculo de la fuerza de friccin.
La nica fuerza que empuja en la direccin opuesta a la fuerza hidrulica
de derecha a izquierda y que se opone al movimiento del flujo por la
tubera, es la fuerza de friccin debida a la viscosidad del lquido.
Como el flujo por la tubera es turbulento, esta fuerza de friccin ser
proporcional al cuadrado de la velocidad y a la longitud de la tubera. Su
formula est dada por:
donde:
K
F
= Coeficiente de friccin viscosa (ver apndice)
Sustituyendo estas dos fuerzas en la ecuacin de balance de fuerzas
(2.33), obtenemos:
Como momento es (Masa por velocidad) = (M x v), entonces:
Y en el sistema ingles las fuerzas se expresan:
entonces:
Como la masa que hay dentro de la tubera esta dada por:
Masa = Densidad del lquido x volumen del lquido en la tubera.
Y como el volumen del lquido dentro de la tubera (asumiendo que la
tuberia esta siempre llena de liquido) es:
longitud de la tubera x area de la tubera:
Volumen de la tubera=
Por lo tanto la masa de liquido dentro de la tubera es:
Y el momento es:
En el sistema ingles el momento es:
Por lo tanto, de las ecuciones (2.35) y (2.36)
Simplificando ya que
se pueden sacar de la
derivada y obtenemos:
El signo de la Fuerza de friccin es negativo porque est actuando en la
direccin opuesta al flujo del lquido en la tubera. Hemos definido de
izquierda a derecha como la direccin positiva.
Variantes del tanque por gravedad:
- Teorema de Torricelli, descarga de chorro, cuando la longitud de la
tubera es cero, L=0 y la descarga es por gravedad. Ver libro
Esposito. No hay Flujo de entrada al tanque
- Cuando la tubera esta vertical, y la descarga es por gravedad,
tambin sin flujo de entrada al tanque. Ver Corripio capitulo 9.
Probablemente el mejor ejemplo contemporneo de un sistema con masa
variable seria la ecuacin de movimiento para un cohete espacial, cuya
masa disminuye conforme el combustible se va consumiendo.
Sin embargo no vamos a hacer ese ejemplo, ya que para nuestro curso de
control de procesos ms til es el problema que se muestra en la figura
2.8, en el cual tambin tenemos masa variable.
Como podemos ver de la figura 2.8 la masa es variable, porque cuando la
bola esta en la posicion donde esta la letra v, asumiendo que el eje cero
(z=0) esta al inicio de la tuberia, queda toda la cantidad de liquido que
esta a su derecha, pero cuando esta por ejemplo en una posicion mas
avanzada como donde dice Liquid, ya queda menos liquido, entonces ya la
masa ha cambiado. Es por eso que en este sistema la masa es variable,
igual que con un cohete que conforme va avanzando va consumiendo
combustible y se va quedando con menos masa.
EJEMPLO 2.10
Muchas veces, las tuberas de petrleo (oleoductos y gaseoductos) se
usan para transferir diversos
Figura 2.8 tubera y bola de cuero para purgar la tubera.
productos de una ubicacin a otra usando el mtodo batch o por lotes, es
decir, se pasa un solo producto a la vez.
Para reducir la contaminacin del producto que se va a transferir, cada vez
que se termina una transferencia por lotes de uno de estos lquidos, se
inserta en uno de los extremos de la tubera una bola de cuero, tambin
llamada, chanchito, la cual a las justas cabe en la tubera.
Detrs de la bola se introduce un gas inerte, con una presion
, el cual
empuja la bola por toda la tubera, de esta manera se purga la tubera de
cualquier lquido remanente que pudiera haber quedado dentro de la
tuberia.
Asumamos que la bola no tiene peso ni tiene friccin, la cual es una buena
suposicin, si la comparamos con el peso de la masa de lquido que queda
en la tubera.
Hallar la ecuacion de balance de fuerzas.
Solucion:
Para escribir la ecuacin de balance de fuerzas, en el lquido que todava
queda en la tubera, debemos tener en cuenta el cambio de masa del
material, ya que a medida que el lquido remanente es expulsado por la
bola, este liquido va disminuyendo.
Como el cero del eje desde donde medimos la posicion z es el inicio de la
tuberia, sea z, la posicin axial de la bola en cualquier instante de tiempo.
Tambin asumamos que el lquido dentro de la tubera es incompresible,
que tiene densidad , y que fluye en condiciones de flujo acoplado. (no
tiene gradientes radiales, es decir, en una misma area todas las
propiedades del fluido son constantes).
Para hacer el balance de Fuerzas necesitamos saber que la sumatoria de
fuerzas es igual a la derivada del momento con respecto al tiempo. Como
momento es masa por velocidad tenemos que tener la masa del liquido
que se va a acelerar.
La masa seria densidad por volumen. El volumen del liquido (que queda
dentro de la tuberia) seria el area por la cantidad de longitud neta de
loiquido y esta longitud es (L-z) que es la longitud total menos la longitud
que ha avanzado la bola de purga. multiplicado todo estopor la velocidad,
nos da el momento y la derivada del momento entonces seria la parte de
la derivada de la formula (2.39).
En realidad momento es derivada de masa por velocidad con respecto al
tiempo, cuando la masa es constante sale la masa fuera de la derivada,
pero cuando la masa es variable o cambiante, no se puede sacar.
Asumamos tambin, que este lquido ejerce una fuerza de friccin
proporcional al cuadrado de su velocidad y a la longitud de la tubera que
todava contiene lquido y que le falta terminar de expulsar. Segn esto la
fuerza de friccin est dada por:
Si el rea de la seccin cuadrada de la tubera es (
), entonces la masa
de fluido en la tubera est dada por:
(
)
La presin P
0
, [lbf/pie2], del gas inerte, que est detrs de la bola
empujndola, se puede considerar que es esencialmente constante en
todo el recorrido de la tubera. Esta presion P
0
ejerce una fuerza,sino,no se
moveria para la derecha y esta fuerza es mayor que la de la friccion para
que se pueda mover el liquido a la derecha. Esa presion origina fuerza.
Tambin se asume que el tanque en el cual descarga el lquido que se est
purgando, est a la presin atmosfrica, y que la tubera esta horizontal.
Haciendo un balance de fuerzas en la direccin horizontal z, obtenemos:
es el factor de conversion que vale 32.2 porque estamos trabajando en
el sistema ingles.
Como sabemos que:
Sustituyendo este trmino de la velocidad en la ecuacin (2.39)
obtenemos:
Que es la ecuacin de balance de fuerzas que se peda.
De estas dos ecuaciones se va a obtener posicion z y velocidad v , es decir
voy a saber en que posicion z esta la bola, y lo que nos interesa saber es
en que momento va a llegar al extremo derecho, cuando z= L.
La condicion inicial para esta ecuacion que es en una sola variable esto
significa tener una sola ecuacion, en t=0 seria z=0.
EJEMPLO 2.11
Como un ejemplo de balance de fuerzas para un sistema microscpico,
veamos el problema clsico del flujo laminar de un lquido Newtoniano,
incompresible, en una tubera circular.
Un liquido Newtoniano, es aquel en el que su fuerza de corte es
proporcional a la tasa de corte (fuerza de corte por unidad de rea) o al
gradiente de velocidad. La fuerza de corte es la resistencia que exhiben las
capas adyacentes del fluido, a pasarse unas con otras.
donde:
tasa de corte (fuerza de corte por unidad de area) que acta en la
direccin y perpendicular al eje se expresa en *
velocidad en la direccin z, [pies/s]
gradiente de velocidad de
, en la direccin r.
viscocidad del fluido, [lbm/pie-s]
Pero como la viscosidad se da en poises o centipoises, el factor de
conversin es :
Vamos a tomar como nuestro sistema, un pequeo elemento en forma de
rosca, la mitad de la cual se muestra en la Figura 2.9
Figura 2.9 Flujo laminar en una tubera.
Como el fluido es incompresible, no existe flujo radial del fluido, o lo que
es lo mismo:
El sistema es simtrico con respecto a la coordenada angular (alrededor
de la circunferencia de la tubera), y por lo tanto, solo necesitaremos
considerar dos dimensiones: y
Las fuerzas que actan sobre el elemento en la direccin z, son:
Fuerzas que actan de izquierda a derecha:
Fuerza de corte en la cara en r =
que tiene unidades de
[lbf/ft
2
x ft
2
]= [lbf] (2.42)
Fuerza por la presin en la cara en z = (2.43)
Fuerzas que actan de derecha a izquierda:
Fuerza de corte en la cara en r + dr =
(2.43.a)
Fuerza por la presin en la cara en z+dz =
(2.43.b)
La tasa de cambio de momento es:
Combinando todas las ecuaciones anteriores en la ecuacin (2.33) de
balance de fuerzas, obtenemos:
El termino
de la ecuacin (2.44) o lo que es lo mismo, la cada de
presin por cada pie de tubera, ser una constante si el fluido es
incompresible. Llammosle a ese trmino, . Sustituyendo este
trmino en la ecuacin (2.41) nos da:
2.2.4 ECUACIONES DE TRANSPORTE
En los ejemplos anteriores, ya hemos usado la mayora de las leyes que
gobiernan la transferencia de masa, de energa y de momento.
Todas estas leyes de transporte, tienen la forma de un flujo (tasas de
transferencia por unidad de rea) el cual es proporcional a una fuerza de
excitacin (un gradiente en la temperatura, en la concentracin, o en la
velocidad).
La constante de proporcionalidad es alguna de las propiedades fsicas del
sistema (como la conductividad trmica, la difusividad o la viscosidad).
Para el transporte a un nivel molecular, las leyes llevan los nombres
familiares de Fourier, Fick y Newton.
Pero las ecuaciones de transferencia tambin se usan macroscpicamente
de una forma ms global; as por ejemplo en la transferencia de calor se
usan los coeficientes de transferencia de calor de la pelcula o cara
interna, cuyo smbolo generalmente es
, y los coeficientes globales de
transferencia de calor, cuyo smbolo generalmente es U. Las unidades de
estos dos coeficientes es el mismo y es [J/m2-s-K].
Estos coeficientes de transferencia de calor se usan cuando existe una
transferencia de calor a travs de una superficie o rea.
Aqu, la diferencia en las propiedades totales que existe entre dos
ubicaciones, radica en la fuerza de excitacin. La constante de
proporcionalidad es un coeficiente global de transferencia. En la tabla 2.1
se resume algunas de las diferentes ecuaciones que se usan para derivar
los modelos matemticos de los procesos.
Tambin es muy comn el usar las fuerzas de excitacin en funcin
de las presiones parciales y de las fracciones molares.
El problema ms comn, la determinacin de las cadas de presin
en las tuberas, usa correlaciones del factor de friccin
2.2.5 ECUACIONES DE ESTADO.
Para poder escribir los modelos matemticos, necesitamos tener
ecuaciones que nos indiquen como es varan las propiedades fsicas,
principalmente la entalpia y la densidad, en funcin de los cambios en la
temperatura, la presin y la concentracin.
(2.46)
Algunas veces y con el objeto de describir el sistema en forma ms
precisa, estas relaciones deben ser algo complicadas que las presentadas
en las ecuaciones (2.46). Pero en la mayora de los casos se pueden usar
las simplificadas sin sacrificar mucho la precisin total. Anteriormente ya
hemos usado algunas ecuaciones ms simples de la entalpia en los
ejemplos de balance de energa y estas son:
El siguiente nivel de complejidad, sera hacer las capacidades calorficas C
P
,
funcin de la temperatura:
Generalmente esta funcin de C
P
es un polinomio en T:
Reemplazando la ecuacin (2.49) en la (2.48), obtenemos:
Naturalmente que si estamos trabajando con mezcla de componentes,
tenemos que usar la entalpia total.
Si los efectos del calor de la mezcla son despreciables, se pueden
promediar las entalpias de los componentes puros de la siguiente manera:
donde:
fraccion molar del componente j
peso molecular del componente j
entalpia del componente puro, del componente j, [energa por
unidad de masa].
El denominador de la ecuacin (2.51) es el peso molecular promedio de la
mezcla. En la mayora de los sistemas se considera que las densidades de
los lquidos son constantes, excepto cuando ocurren cambios muy grandes
en la concentracin y en la temperatura del mismo.
Las densidades del vapor por lo general no se consideran constantes y casi
siempre se requiere alguna ecuacin del tipo PVT.
La ms simple de estas ecuaciones y la que ms se usa es la ley de los
gases perfectos:
donde:
Para obtener la densidad
(lbm/pie
3
o Kg/m
3
) de un gas perfecto con
peso molecular M, Reordenamos la ecuacin anterior y obtenemos:
2.26 EQUILIBRIO
Las ecuaciones que nos indican las condiciones que debe tener un sistema
para estar en equilibrio se basan en la segunda ley de la termodinmica.
Hay dos clases de equilibrio, equilibrio qumico y equilibrio de las fases.
A EQUILIBRIO QUIMICO.
Cuando ocurre una reaccin en un recipiente el cual evita que entre o
escape alguna de las sustancias que participan en la reaccin, las
cantidades de estos componentes cambian ya que algunas se consumen y
otras se producen. Al final este cambio terminara, despus del cual la
concentracin permanecer constante siempre y cuando el sistema
contine sin ser perturbado. Se dice entonces que el sistema est en su
estado de equilibrio o simplemente que est en equilibrio.
La direccin en la cual escribimos una reaccin qumica ( y por lo tanto
que componentes son considerados reactivos y cuales son productos) es
arbitraria. Por tanto las dos ecuaciones siguientes:
H
2
+ I
2
2 HI "synthesis of hydrogen iodide"
2 HI H
2
+ I
2
"dissociation of hydrogen iodide"
representan el mismo sistema de reaccin qumica en el cual se han
invertido los papeles de los componentes, y las dos proporcionan la misma
mezcla de componentes cuando se ha completado el cambio.
Este ltimo punto es central para poder entender el concepto de
equilibrio qumico.
Es igual si partimos con dos moles de HI o con una mol de H2 y otra de I2;
una vez que la reaccin se ha completado, las cantidades de estos dos
componentes sern las mismas. En general, entonces, podemos decir que
la concentracin de un sistema con una reaccin qumica tendera a
cambiar en una direccin tal que la lleve lo ms cerca posible a su
concentracin de equilibrio. Una vez que ya se ha logrado esta
concentracin de equilibrio no ocurrir ningn cambio ms en las
cantidades de los componentes siempre que el sistema permanezca sin
ser perturbado.
En un sistema en el que ocurre una reaccin, se dice que est en equilibrio
cuando:
donde:
coeficiente estequiometrico del componente j en el cual los reactivos
tienen signo negativo y los productos signo positivo.
potencial qumico del componente j
La manera ms comn de trabajar con esta ecuacin en una reaccin, es
en funcin de una constante de equilibrio. Por ejemplo, consideremos la
reaccin reversible que ocurre en la fase gaseosa, en la que A produce B a
la tasa de reaccin especifica
y en la que tambin a su vez B reacciona
volviendo a formar el producto A, a la tasa de reaccin especifica
. La
estequiometria de la reaccin es tal que
moles de A reaccionan para
formar
moles de B, tal como se muestra en la siguiente ecuacin:
La ecuacin (2.54) establece que existir equilibrio cuando:
Los potenciales qumicos para una mezcla de gases perfecta, se puede
escribir como:
donde:
potencial qumico estndar del componente j, el cual solamente
depende de la temperatura. Al potencial qumico estndar tambin se le
conoce como la energa libre de Gibbs por cada mol.
presion parcial del componente j.
constante de la ley de los gases ideales.
temperatura absoluta.
Sustituyendo la ecuacin (2.57) en la (2.56) obtenemos:
El lado derecho de esta ecuacin solamente depende de la temperatura.
El trmino entre parntesis de la parte izquierda est definido como la
constante de equilibrio
, y nos informa los cocientes de equibrio de los
reactivos y los productos.
B EQUILIBRIO DE FASES
Se dice que ocurre equilibrio entre dos fases cuando el potencial qumico
de cada componente es el mismo en las dos fases:
donde:
potencial qumico del componente j en la fase I.
potencial qumico del componente j en la fase II.
Puesto que la gran mayora de los sistemas de ingeniera qumica trabajan
con las fases liquida y vapor, se usan muchas ecuaciones de equilibrio
liquido-vapor. Estas ecuaciones van desde las ms simples hasta las ms
complicadas. Algunas de las ecuaciones que son las ms usadas se listan
debajo.
En la mayora de textos sobre termodinmica, se dan tratamientos ms
detallados. Algunos de los conceptos bsicos son presentados por Luyben
y Wenzel en el libro Anlisis de procesos qumicos: balances de energa y
masa, captulos 6 y 7, Prentice Hall 1988.
Para la fase liquida se usan varios mtodos muy conocidos entre los cuales
destacan:
1 Ley de Raoult.
Considere un sistema con dos fases (vapor y liquido) en los que se
conoce la presin y la temperatura.
Lo que nos interesa conocer es la relacin de equilibrio entre las
variables del sistema que se estn midiendo:
P, T, y
1
, y
2
,, x
1
,x
2
,
La mas simple de las relaciones es la ley de Raoult la cual se puede
escribir para cada uno de los componentes y la cual se basa
asumiendo que la fase de vapor es un gas ideal y que la fase liquida
es una solucin liquida ideal.
i
sat
i i
x P Py
La tendencia a escaparse de un sovente se mide por su presin de
vapor, la cual depende de la temperataura.
La presin de vapor mide la concentracin de las molculas del
solvente en la fase gaseosa.
Si asumimos que el soluto no es voltil, las nicas particulas en la
fase gaseosa son las molculas del solvente.
En una solucin, pocas son las molculas que estn en la superficie
comparadas con la dl solvente puro, por tanto una menor
proporcin de las molculas del solvente estarn en la fase gaseosa
y la presin de vapor para la siolucion es menor que la del solvente
puro.
La ley de Raoult establece que para una solucin ideal la presin de
vapor parcial de un componente (voltil) en una solucin es igual a
la fraccin molar de ese componente (en la solucin) multiplicada
por su presin de vapor cuando esta puro:
P
a
= X
a
P
a
o
P
a
= presin de vapor de la solucion
P
T
V
L
P
a
o
= presin de vapor del solvente puro
X
a
= fraccin molar del solvente
La presin de vapor fraccional que decrese es igual a la fraccin
molar del soluto:
X
b
= (P
a
o
- P
a
) P
a
o
P
a
= presin de vapor de la solucion
P
a
o
= presin de vapor del solvente puro
X
b
= fraccin molar del soluto
Soluto es la sustancia que se disuelve en una solucion. Es la
sustancia que esta disuelta en un solvente y forma una solucin.
Solvente es una sustancia capaz de disolver otra sustancia formando
una solucin.
La presin de vapor que decrese se puede usar para calcular la masa
molecular de un soluto (tambin llamada peso formula o peso
molecular).
Los lquidos que obedecen esta ley, son llamados lquidos ideales.
Donde
es la presin de vapor del componente puro j. P es la presin de
vapor de la solucin. Las presiones del vapor solamente dependen de la
temperatura. Esta dependencia frecuentemente se describe mediante la
siguiente ecuacin:
A la ecuacin (2.64) tambin se le conoce como la ecuacin clsica de
Classius-Clapeyron.
Ejemplo 1: Calcular la presin de vapor de un solvente
1.00g de sulfanilamide no volatil, C
6
H
8
O
2
N
2
S, se disuelve en 10.0g de acetona,
C
3
H
6
O.
La presin de bvapor de la acetona pura a la misma temperatura de la slucion es de
400 mmHg.
Calcular la presin de vapor de la solucion.
Solucion
a. Calculamos las moles de soluto: n (C
6
H
8
O
2
N
2
S) = masa MM del soluto
n(C
6
H
8
O
2
N
2
S) = 1.00g (6 x 12 + 8 x 1 + 2 x 16 + 2 x 14 + 32.1) g/mol
= 1.00 172.1 = 0.0058 mol
b. Calculamos las moles del solvente: n(C
3
H
6
O) = masa MM del solvente
n(C
3
H
6
O) = 10.0g (3 x 12 + 6 x 1 + 16) g/mol
= 10.0 58 = 0.172 mol
c. Calculamos la fraccin molar del solvente en la solucion: X
solvent
= n
solvent
(n
solute
+ n
solvent
)
X
a
= n(C
3
H
6
O) [n(C
3
H
6
O) + n(C
6
H
8
O
2
N
2
S)]
= 0.172 [0.172 + 0.0058] = 0.967
d. Calculamos la presin de vapor de la solucion: P
a
= X
a
P
a
o
P
a
= 0.967 x 400 mmHg = 386.8 mmHg = 387 mmHg
Ejemplo 2: Calcular la masa Molecular MM (Peso Formula) deun
Soluto
5.00g de un compuesto no voltil se disolvieron en 100g de agua a 30
o
C.
La presin de vapor de la solucin fue medida y se hallo que era 31.20 Torr.
Si la presin de vapor del agua pura a 30
o
C es 31.82 Torr.
Calcular la masa molecular (peso formula) del soluto que no se conoce.
Solucion
a. Calculamos la fraccin molar del soluto en la solucin: X
b
= (P
a
o
- P
a
) P
a
o
X
b
= (31.82 - 31.2) 31.82 = 0.0195
b. Calculamos las moles del solvente: n(H
2
O) = massa masa molecular
n(H
2
O) = 100g (2 x 1 + 16)g/mol = 5.556mol
c. Calculamos el numero de moles del soluto: X
solute
= n
solute
(n
solute
+ n
solvent
)
0.0195 = n
soluto
(n
soluto
+ 5.556)
0.0195(n
soluto
+ 5.556) = n
soluto
0.0195(n
soluto
) + 0.108 = n
soluto
0.108 = n
soluto
- 0.0195(n
soluto
)
0.108 = 0.9805(n
soluto
)
(n
soluto
) = 0.108 0.9805 = 0.11 mol
d. Calculamos la masa molecular (peso formula) del soluto: MM = masa
moles
MM = 5.00g 0.11 mol = 45.45 g/mol
Calculos que se pueden realizar con la ley de Raoult
Calculo del punto de Burbujeo
Dados T (or P),x hallar P(or T),y.
Este clculo se realiza usando la ley de Raoult para cada componente y
haciendo que la fraccin molar desconocida en la fase de vapor sume uno.
P
x P
y
P
x P
y
i
sat
i
i
i
sat
i
i
1
Si lo que se desea hallar es la temperatura, este clculo es iterativo.
Bsicamente lo que necesitamos tener es una ecuacin que nos permita
calcular la concentracin de vapor si conocemos la concentracin del
lquido, o el problema inverso. El problema ms comn es el clculo del
punto de burbujeo, es decir: calcular la temperatura T y la concentracin
de vapor
, si se conocen la presin P y la concentracin del lquido
.
Por lo general para resolver el punto de burbujeo se tiene que emplear
una solucin iterativa por prueba y error, ya que solamente en los casos
ms simples se puede hallar una solucin explicita en forma de ecuacin
donde se despeje la incgnita.
Algunas veces se tiene que realizar los clculos del punto de burbujeo
partiendo de valores inciales conocidos de
y de T, y lo que se desea
encontrar es P y
Este caso en el que se conoce
y T por lo general es
mucho ms fcil de resolver que el caso en el que se conoce la presin P,
ya que para este caso el clculo del punto de burbujeo por lo general no
es iterativo.
Calculo del punto de roco
El punto de rocio se puede calcular cuando se conoce la concentracin del
vapor
y la presin (o ) y se desea encontrar la concentracin del
liquido
y la temperatura .
Es decir, dados T(o P), e y hallar P(o T), x.
Estos problemas se solucionan escribiendo la ley de Raoult para cada
componente,y forzando a que las fracciones molares en la fase liquida
sumen uno.
sat
i
i
i
sat
i
i
i
P
Py
x
P
Py
x
1
Una vez mas si la temperatura es la incognita, el problema debe ser
solucionado con iteraciones.
El punto de vaporizacin se puede calcular cuando no se conoce la
concentracin del vapor
ni la concentracin liquida
y para hallar las
incgnitas se debe de combinar las ecuaciones de equilibrio de fases, con
las ecuaciones de balance de masa por componentes, y una ecuacin de
balance de energa.
El criterio para el punto de vaporizacin se puede escribir de diferentes
maneras. Una manera til de calcular el punto de vaporizacion se da a
continuacin:
K
y
x
P
P
f P T
z K
V K
i
i
i
i
sat
i i
i
( , )
( )
1
1 1
0
T, P y las concentraciones de la alimentacin (z
i
s) se conocen. El flujo de
alimentacin (F) se toma exactamente como 1 mol. Para hallar V se debe
emplear la tcnica de la prueba y el error (fraccin a flujo de vapor
basndose en moles)
En todos nuestros ejemplos asumiremos un comportamiento ideal de la
fase vapor, es decir:
La presin parcial del componente j en el vapor es igual a la presin total
, multiplicada por la fraccin molar del componente j en el vapor
(Ley
de Dalton).
Cuando se trabaja con presiones muy altas, se puede requerir realizar
correcciones a esta ecuacin.
Ley de Dalton
La presin total que ejerce una mezcla de gases ideales puede ser considerada como la suma
de las presiones de vapor parciales que ejerce cada gas si estuvieran solo y ocupara todo el
volumen. En una solucin ideal, el componente que (en comparacin con los otros
componentes) tiene la mayor presin de vapor ser destilado primero.
2 Volatilidad relativa.
La volatilidad de cualquier sustancia en una solucin puede ser definida
como la presin parcial de equilibrio de la sustancia en la fase vapor
dividida por la fraccin molar de la sustancia en la solucin.
Volatilidad del componente A = presin de vapor parcial de A /fraccin
molar de A en la solucin
Volatilidad del componente A = P
A
/x
A
Volatilidad relativa: considere una mezcla liquida que contiene dos
sustancias A y B. En estos casos la volatilidad de un componente se
expresa en funcin de la volatilidad del segundo componente y se llama
volatilidad relativa.
Volatilidad relativa = vol del componente A / vol del componente B
Volatilidad relativa = P
A
/x
A
/ P
B
/x
B
= P
A
X
B
/(P
B
X
A
)
Segn la ley de Dalton las presiones de vapor parciales de A y de B se
pueden expresar como:
P
A
= Y
A
P
P
B
= Y
B
P
de donde
volatilidad Relativa = Y
A
P X
B
/ Y
B
P X
B
= Y
A
X
B
/ Y
B
X
A
La volatilidad relativa del componente i al componente j tiene el
smbolo
y se define como:
(2.65)
En muchos sistemas, las volatilidades relativas tienen valores que son casi
constantes. Estas volatilidades relativas son convenientes y por tanto se
usan con mucha frecuencia.
En un sistema binario, a la volatilidad relativa de la componente ms
voltil comparada con la del componente menos voltil, se le designa con
la letra griega y est dada por:
Despejando , obtenemos:
3 Valores
Un cociente de equilibrio vapor liquido (valor K) es definido para un
componente como el cociente entre la fraccin molar del vapor y la
fraccin molar en el liquido para ese componente.
Estos valores a los que tambin se les conoce con el nombre de
cocientes de equilibrio en la vaporizacin en se usan ampliamente,
especialmente en la industria petrolera, y se definen como:
Los valores dependen de la temperatura y de la concentracin, y en un
menor grado tambin dependen de la presin.
4 Coeficientes de actividad.
Hemos dicho que para los lquidos ideales se aplica la ley de Raoult, pero
cuando los lquidos no son ideales, debemos modificar la ley de Raoult
para tomar en cuenta el hecho de que la fase liquida ya no es ideal.
A estos factores de correccin que usamos para forzar a hacer ideal a la
solucin no ideal, se les llama los coeficientes de actividad y son una
medida de cuanto es lo que difiere la solucin no ideal de la solucin ideal.
donde:
es el coeficiente de actividad para el componente j.
Si el componente es ideal, el coeficiente de actividad es igual a 1.
Estos coeficientes de actividad dependen de la concentracin y de la
temperatura.
2.2.7 CINETICA QUIMICA
Es la rama de la qumica que tiene que ver con las tasas de cambio de la
concentracin de los reactivos en una reaccin qumica.
Como en este curso se estudiara como es el modelo matemtico de los
reactores qumicos, debemos de conocer las ecuaciones y la terminologa
que se usan para describir la cintica (velocidad de la reaccin) de las
reacciones qumicas.
A. FORMULA DE ARRHENIUS DE LA DEPENDENCIA DE LA
TEMPERATURA DE LA REACCION QUIMICA.
Recordamos que la velocidad con la que se producen o se agotan los
componentes en una reaccin qumica cuando se realiza un balance
de masa en un reactor, esta dada por la tasa de reccion multiplicada
por el volumen y este resultado nos da moles /tiempo.
Tasa de produccin del componente i =
Asi mismo, la ecuacin de la tasa de una reaccin entre dos
sustancias A y B es la siguiente:
:
Esta ecuacin de la tasa de reaccion muestra la dependencia tasa de
reaccin de las concentraciones de los reactivos.
Pero en esta ecuacin, no se muestran las otras variables que tambin
afectan a la tasa de reaccin, como son la temperatura, y los catalizadores?
Todas estas variables estn incluidas en la tasa de reaccin especfica ,
tambin llamada la constante de la tasa de reaccin, la cual en realidad solo
es un valor constante si lo nico que cambiara seria la concentracin de los
reactivos. Si la temperatura o el catalizador cambian la constante de reaccin
tambien cambia. Estos cambios se muestran matematicamente en la
ecuacin de Arrhenius.
La ecuacin de Arrhenius
Que significan los diversos simbolosde esta ecuacion
Temperatura, T
Para que tenga las unidades adecuadas debe medirse en grados kelvin
La constante universal de los gases, R
Esta constante viene de la ecuacin, pV=nRT, la cual realciona la presin, el
volumen y la temperatura de una cierta cantidad de moles de un gas.
es la constante de los gases perfectos y en el sistema ingles es:
Y en el sistema internacional es:
Energia de activacion, E
A
Es la energa minima que se requiere para que ocurra la reaccin. Sus
unidades son: joules per mole no se debe colocar en kJ mol
-1
.
Muestra cmo es que la tasa de reaccin depende de la temperatura, es
decir, que cuando la temperatura aumenta mientras ms grande sea E,
mas rpido ser el incremento de . Las unidades en el sistema ingles
de la energa de activacin E son:
*
+ o *
+
e constante numero neperiano
su valor es 2.71828 . . .
La expresion, e
-(E
A
/ RT)
Esta expresin cuenta la fraccin de las molculas (presentes en un gas)
que tienen energias iguales o mayores que la energa de activacin a una
temperatura particular.
El factor de frecuencia, A
Tambien se le llama el factor pre-exponencial o el factor estreo.
A es el termino que incluye factores como la frecuencia de colision y su
orientacin. Vara ligeramente con la temperatura. Para rangos de
temperatura pequeos se considera constante.
Tomando logaritmos en ambos lados y reordenando obtenemos:
Usando la ecuacin de Arrhenius
El efecto de la temperatura
Que ocurre si incrementamos la temperatura en 10C, por ejemplo de 20C a
30C (293 K a 303 K)?
Como el factor de frecuencia, A, es constante para este cambio pequeo de
temperatura, examinemos como cambia e
-(E
A
/ RT)
- la fraccin de molculas
con energias iguales o mayores a la energa de activacin
Asumamos que la energa de acticvacion es 50 kJ mol
-1
.En la ecuacin
debemos colocar 50000 J mol
-1
. El valor de R, es 8.31 J K
-1
mol
-1
.
A 20C (293 K) el valor de la fraccin es:
Si aumentamos la temperatura a los 303 K, esto aumenta a:
Podemos ver que la fraccin de las molculas que pueden reaccionar casi se
ha doblado aumentando la temperatura en 10C. Esto causa que la tasa de
reaccin especifica casi se doble.
Nota: Esta aproximacion (de que la tasa de reaccin especifica k se dobla por cada
10 grados de aumento de la temperataura solo tiene validez para reacciones cuya
energa de activacin E es aproximadamente 50 kJ mol
-1
muy cercana a la de la
temperatura ambiente.
La tasa de reaccin especifica k se incrementa cuando la temperatura se
incrementa, pero la tasa de incremento decae muy rpidamente a temperaturas mas
altas.
El efecto del catalizador
Un catalizador proporciona una ruta para la reaccin bajando la energa de
activacin. Supongamos que con la presencia del catalizador la energa de
activacin cae a 25 kJ mol
-1
. Haciendo nuevamente el calculo anterior a 293
K:
Si comparamos este resultado con el obtenido cuando la energa de
activacin era 50 kJ mol
-1
, veremos que ha ocurrido un incremento masivo
en la fraccin de las molculas que son capaces de reaccionar. Hay casi
30000 veces ms molculas que pueden reaccionar cuando se ha colocado
el catalizador, comparadas cuando no se usa el catalizador. (usando nuestra
asuncin sobre las energias de activacion).
Los catalizadores aceleran las reacciones!
Esta dependencia exponencial de la temperatura representa una de las no
linealidades ms severas que se encuentran en los sistemas de control de
procesos industriales. Recuerde que esta dependencia aparente de la
temperatura de una reaccin, es exponencial cuando la reaccin est
limitada por la velocidad qumica, pero si la reaccin la reaccin no est
limitada por la velocidad qumica, y ms bien est limitada por la
transferencia de masa, quizs esta dependencia no sea exponencial.
Evidentemente que si en la operacin de un reactor se encuentran ambas
zonas, el modelo matemtico del reactor debe incluir los dos efectos: el de
la transferencia de masa y el de la velocidad de la reaccin.
B. LEY DE LA ACCION DE MASAS.
Usando la notacin convencional, definiremos una tasa global de reaccin
, como el cambio de moles (que se producen debido a una reaccin
qumica) de cualquier componente por volumen, dividido por el
coeficiente estequiometrico del componente. (El coeficiente
estequiometrico describe la reaccin qumica de los reactivos, en el que
los reactivos se combinan en cocientes que son nmeros enteros).
)
(2.70)
Por convencin, los coeficientes estequiometricos
son positivos para
productos de una reaccin y son negativos si son reactivos. Observe que
es una propiedad intensiva y por tanto se puede aplicar a sistemas de
cualquier tamao.
(Las propiedades intensivas son aquellas que no dependen de la cantidad o tamao del
material. Por ejemplo el punto de ebullicin es una propiedad intensiva: el agua siempre hierve
a la misma temperatura y no depende si tenemos 1 gramo, 10 gramos o 100,000 kilogramos de
agua. Otros ejemplos de propiedades intensivas incluyen la densidad, el color etc)
Por ejemplo, asumamos que tenemos una reaccin irreversible en la cual
los componentes A y B reaccionan para formar los componentes C y D, tal
como se muestra a continuacin:
Luego, segn la definicin:
La ley de accin de masas establece que la velocidad global de reaccin
variara con la temperatura (ya que depende de la temperatura) y con las
concentraciones de los reactivos, elevadas a ciertas potencias.
donde:
concentracin del componente A
concentracin del componente B
En general, las constantes y no son iguales a los coeficientes
estequiometricos
.
Si se dice que la reaccin es de primer orden en A Si se dice
que la reaccin es de segundo orden en A.
Las constantes y pueden ser nmeros fraccionarios.
Tal como lo indicamos anteriormente, las unidades de la velocidad de la
reaccin especfica , dependen del orden de la reaccin. Esto es as,
porque la tasa global de reaccin siempre tiene las mismas unidades
(moles por unidad de tiempo y por unidad de volumen).
Para una reaccin de primer orden en A que reacciona para formar B, la
velocidad global de reaccin , escrito para el componente A, tendra las
unidades de moles de A/min ft
3
.
Por tanto, si
tiene unidades de
, entonces debe tener las
unidades de min
-1
Si la tasa global de reaccin para el sistema descrito arriba es uno de
segundo orden en A, es decir:
todava seguir manteniendo las unidades de
. Por lo tanto
debe tener unidades de
Considere ahora la siguiente reaccin:
Si la tasa global de reaccin es de primer orden en A y en B,
todava seguir manteniendo las unidades de
. Por lo tanto
ahora debe tener las unidades de
Que es la accin de masas?
http://www.chem1.com/acad/webtext/chemeq/Eq-01.html#SEC2
Las ideas de Berthollet sobre las reacciones reversibles fueron finalmente probadas por
experimentos llevados a cabo por el qumico noruego Cato Guldberg y su cuado Peter
Waage. Durante el periodo entre 1864-1879 ellos mostraron que el equilibrio se puede
alcanzar desde cualquier direccin (vea la ilustracin anterior de la reaccin del
hydrogen iodide), implicando que cualquier reaccin de la forma aA + bB cC + dD
es en realidad una competencia entre una reaccin directa y una reaccin inversa.
Cuando una reaccin esta en equilibrio, las tasas de estas dos reacciones son idnticas,
de tal manera que no se observa ningn cambio neto a nivel macroscpico, aunque los
componentes individuales estn siendo transformados activamente a nivel
microscpico.
El equilibrio es dinamico !
Las masas activas son esencialmente las concentraciones de los reactivos y
productos que se combinan directamente en la manera representada por la
ecuacin de la reaccin.
El significado de los trminos en el lado derecho de las ecuaciones es simplemente
que la tasa es proporcional a las concentraciones de los componentes.
Guldberg y Waage mostraron que para una reaccin de la forma aA + bB cC + dD,
la tasa (velocidad) de la reaccin en cualquier direccin es proporcional a lo que ellos
llamaron las masas activas de los diversos componentes:
Tasa de la reaccin directa = k
f
[A]
a
[B]
b
Tasa de la reaccin inversa = k
r
[C]
c
[D]
d
en la cual las constantes de proporcionsalidad k son llamadas constantes de velocidad y
las cantidades en parntesis cuadrados representan las concentraciones
Si combinamos los dos reactivos A y B, la reaccin directa empieza inmediatamente;
luego cuando los productos C y D empiezan a producirse el proceso inverso empieza a
producirse. A medida que la reaccin continua, la tasa de la reaccin directa disminuye
mientras que la de la reaccin inversa aumenta. Al final los dos procesos estn
producindose la la misma tasa y la reaccioin esta en equi.ibrio:
Tasa de la reaccin directa = Tasa de la reaccin inversa
k
f
[A]
a
[B]
b
= k
r
[C]
c
[D]
d
Es muy importante que entienda el significado de esata relacin. El estado de
equilibrio es aquel en el que no hay un cambio neto en las cantidades de los
reactivos y de los productos. Pero no confunda esto con un estado en el que no
hay cambios; en el equilibrio, las reacciones directa e inversa ontinuan, pero a las
mismas tasas, esencialmente cancelndose ambas.
El equilibrio ess macroscopicamente estatico, pero es dinamico
microscopicamente!
Pa ilustra aun mas el carcter dinamico del equilibrio qumico, supongamos que ahora
cambiamos la concentracin del sistema que previamente estuvo en equilibrio
agregndole cierta cantidad de C o quitandlole cierta cantidad de A (de esta manera
estamos cambiando sus "masas activas"). La tasa inversa temporalmente exceder a la
tasa directa y ocurrir un cambio en la concentracin ("un desplazamiento del
equilibrio") hasta que se logre una nueva concentracin de equilibrio.
Las concentraciones en el estado de equilibrio dependen del cociente de las constantes
de tasa directa e inversa
Debe estar claro que entiende la diferencia entre la tasa de una reaccin y la contante de
tasa. Esta ultima generalmente es designada con la letra k, nos relaciona la tasa de reaccin
a la concentracin de una o mas de los componentes de la reaccion por ejemplo,
tasa = k [A].
En el equilibrio las tasas de los procesos directo e invesro son iguales, pero las
constantes de velocidad generalmente son diferentes. Para ver como es esto, considere
la reaccin simplificada A B en los siguientes tres escenarios.
k
f
>> k
r
Si las constantes de velocidad son
muy diferentes (por muchos
ordenes de magnitud), entonces
esto hace necesario que las
concentraciones de equilibrio de
los productos excedan a las de los
reactivos por el mismo cociente. Por tanto, la concentracin de equilibrio
permanecer fuertemente en la derecha; se puede decir que la reaccin esta
completa o que es cuantitativa.
k
f
<< k
r
Las tasas solo pueden ser idnticas (se ha logrado el equilibrio) si las concentraciones
de los productos son muy pequeas. Describimos el equilibrio resultante como que
favorece fuertemente el lado izquierdo; se forma muy poco producto. En los casos
mas extremos podramos inclusive decir que no se ha producido la reaccin
k
f
k
r
Si k
f
y k
r
tienen valores cercanos (por ejemplo, dentro de varios ordenes de magnitud),
entonces estn presentes concentraciones significativas en el equilibrio; decimos que
la reaccin esta incompleta y que es reversible.
Las imgenes que se muestran abajo muestran otra forma de mirar estos tres casos. Los
graficos muestran como las concentraciones relativas del reactivo y dl producto
cambian durante el curso de la reaccin.
Los graficos difieren en cuanto a las asunciones que hicimos sobre los cocientes de k
f
a
k
r
. La concentracin de equilibrio del sistema es ilustrada por las proporciones de A y B
en las partes horizontales de cada grafico donde la concentracin permanece igual. En
cada caso, las dos constantes de velocidad estn lo sufientemente cercanas en magnitud
que cada reaccin se puede considerar "incompleta".
En el grafico (i)la constante de tasa directa es el doble de la constante de tasa inversa,
asi que el producto (B)es favorecido, pero hay sufiente reaccin inversa para
mantener una cantidad significativa de A.
En (ii), las constantes de tasa directa e inversa tienen magnitudes idnticas. Por tanto
no nos sorprende que tambin sean iguales los valores de equilibrio de [A] y [B].
En (iii), la constante de tasa inversa excede la la constante de tasa directa, por tanto la
concentracin de equilibrio esta definitivamente en el lado izquierd.
La ley de accin de masa es por tanto esencialmente la afirmacin de que la
concentracin de equilibrio de una mezcla que esta reaccionando puede cambiar segn
las cantidades de los componentes que estn presentes. Naturalmente que esto es
justamente lo que Berthollet observo en sus soluciones de sal egipcias, pero que ahora
entendemos es una consecuencia de la naturaleza dinmica del equilibrio qumico.
5 Como podemos saber cuando una reaccin ha alcanzado el equilibrio?
Evidentemente si observamnos que ocurre algn cambio un cambio de color, la
liberacin de burbujas de gas, la presencia de un precipitado, o la liberacin de calor,
sabemos que la reaccin no esta aun en equilibrio.
Pero la ausencia de cualquier cambio aparente por si mismo no establece que la reaccin
este en equilibrio. El estado de ewquilibrio es quel en el no solamente no ocurre un
cambio de concentracin sino tambin el ual en el que no esta presente la tendencia
energtica de producir mas cambios. Desaforyunadamente la "tendencia" no es una
propiedad que se pueda medir directamente! Por ejemplo considere la reaccin que
representa la sintesis del agua a partir de sus elementos:
2 H
2
(g) + O
2
(g) 2 H
2
O(g)
Ud.puede almacenar los dos reactivos gaseosos en el mismo recipiente indefinidamente
sin que ocurra nigun cambio observable. Pero si Ud. Crea un arco elctrico en el
recipiente o introduce una llama, bang! Despues usted quedara pedazos. Y sabra muy
bien que el sistema no estaba inicialmente en equilibrio! Ocurre que esta reaccin
particular tiene una tendencia muy grande de ocurrir pero nada ocurre hasta que la
activemos de alguna forma en este caso se hizo exponiendo la mezcla a una llama o
arco o (de una manera mas delicada) introduciendo un alambre de platino el cual actua
como un catalizador.
Una reaccin de este tipo se dice que esta muy favorecida termodinmicamente,
pero inhibida cinticamente. La reaccin sililar del hidrogeno y la iodine
H
2
(g) + I
2
(g) 2 HI(g)
en contraste es solo moderadamente favorecido termodinamicamente (y por lo tanto es
incompleto), pro su cinetica es razonablemente fcil y no es espectacular.
Algunas pruebas simples para ver si hemos llegado al equilibrio
Como lo explicamos anteriormente en el contexto de la ley de accin de masas,
el agregar o quitar un componente de la reaccin afectara las cantidades de todas
las otras. Por ejemplo, si agregamos mas de un reactivo lo que esperaramos
seria ver es que la concentracin de un producto cambie. Si esto no ocurriera,
entonces es probable que la reaccin este inhibida cinticamente y que el sistema
no pueda obtener el equilibrio.
Sin embargo, casi siempre se da, que una vez que una reaccin arranca, esta
continue por si misma hasta que alcance el equilibrio, por tanto si pudiramos
observar el cambio cuando ocurr y lo viramos que va disminuyendo hasta que
para, con mucha razn podramos tenrer la certeza que el sistema esta en
equilibrio. Este es d lejos el criterio mas comn que emplean los qumicos.
Existe otra prueba experimental para ver si se ha obtenido el equilibrio quimico
de una reaccin, aunque esta prueba solamente es aplicable al tipo de reacciones
que hemos descrito como reaccines reversibles.Como veremos posteriormente,
el estado de equilibrio de un sistema, es siempre afectado por la temperatura y
con mucha frecuencia tambin es afectado por la presin, de tal manera que
cualquier cambio que ocurriera en estas variables aun cuando sea pequeo,
temporalmente perturbaran (lo sacaran) el equilibrio, resultando en un cambio
(que se puede observar) de la concentracin del sistema cuando se esta
dirigiendo a us nuevo estado de equilibrio.
Resumen sobre equilibrio
Asegurese que cmprende totalmente las siguientes ideas esenciales que hemos presntado
lneas arriba. En es pecial es importante que Ud. Conozca los significados precisos de
todos los trminos resaltados en el contexto de este tpico.
Al menos en teora, puede ocurrir cualquier reaccin que se pueda representar por una
ecuacion quimica balanceada. Sin embargo existen dos condiciones importantes:
1. La tendencia para que ocurra el cambio podra ser tan pequea que la
cantidad de productos formados podsria ser muy bajo y quizs
despreciable.Se dice que una reaccin de este tipo esta inhibida
termodinmicamente. La tendencia para el cambio qumico solo es
gobernada por las propiedades de los reactivos y los productos, y puede
ser predicha aplicando las leyes de la termodinmica.
2. La tasa a la cual continua la reaccin puede ser muy pequea, o inclusive
cero, en cuyo caso decimos que la reaccin esta inhibida cineticamente.
Las tasas de reaccin dependen de los mecanismos de la reaccion es
decir, que es lo que realmente ocurre a los atomos cuando los reactivos
son transformadfos en productos. Por lo general, no se puede predecir los
mecanismos de una reaccin y se deben obtener experimentalmente.
Tambien la misma reaccin puede tener diferentes mecanismos bajo
diferentes condiciones.
A medida que transcurre un cambio qumico, las cantidades de los componentes en un
lado de la ecuacin de la reaccin disminuir, y las otras en el otro lado aumentaran. Al
final la reaccin se desacelera y dejan de cambiar las concentraciones del sistema. En
este punto la reaccin esta en su estado de equilibrio, y no ocurrir ningn cambio mas
en la concentracin siempre que el sistema continue sin ser pertubado.
En muchas reacciones, el estado de equilibrio es aquel en el que los componentes en
ambos lados de la ecuacin (es decir reactivos y productos) edstan presnetes en
cantidades importantes. Se dice que esta reaccin es incompleta o reversible.
La concentracin en el equilibrio es independiente de la direccin desde la cual se
ha llegado; el etiquetado de las sustancias como reactivos o productos, es
totalmente un asunto de conveniencia (vea los graficos de la reaccion hydrogeno
iodide.)
La ley de accin de masas establece que cualquier cambio qumico es una competicin
entre una reaccion directa (izquierda-a-derecha en la ecuacin qumica) y una reaccion
reversa. La tasa de cada uno de estos procesos es gobernada por las concentraciones de
las sustancias que estn reaccionando; a medida que la reaccin transcurre, estas tasas se
aproximan una a la otra, y en el equilibrio ser hacen idnticas.
De lo anterior se concluye que, el equilibrio es un proceso dinamico en el cual
continua ocurriendo un cambio microscopico (las reacciones directa e inversa) , pero no
hay un cambio macroscopico (cambios en las cantidades de las sustancias).
Cuando una reaccin esta en equilibrio, cualquier cambio o perturbacin en el sistema,
tal como por ejemplo, un cambio en la temperatura, o el agregado o retiro de uno dre los
componentes de la reaccin, desplazara la concentracion hacia un nuevo estado de
equilibrio. Esta es la nica manera no ambigua de verificar que una reaccin ha
alcanzado el estado de equilibrio. El hecho de que la concentracion permanezca estatica
(sib cambios) no garantiza que una reaccin esta en equilibrio, debido a que el cambio
podra estar siendo inhibido cinticamente.
Que es lo que Ud. Debera poder hacer
Definir "el estado de equilibro de un sistema con una reaccin quimica ". Cual es su
significado practico?
Establecer el significado de los siguientes terminos:
o reaction reversible
o reaction quantitativa
o reaccin inhibida cineticamente
Explicar el significado de la siguiente sentencia el equilibrio es
macroscopicamente estatico, pero microscopicamente dinamico". Muy
importante!
Explicar como las magnituds relativas de las constantes de la tasa de reaccion
directa e inversa en la expresion de la accin de masas afectan la concentracin
de equilibrio de una reaccin en un sistema.
Describa varias cosas que usted buscara encontrar durante un experimento que
le ayudaran a determinar si una reaccin esta en su estado de equilibrio.
APNDICE
Entalpia y energa interna.
Todo cuerpo tiene una temperatura y por lo tanto tiene lo que se llama
una energa interna y una entalpia que depende de la temperatura y del
material del cuerpo. Entalpia y energa interna casi son sinnimos.
Por lo tanto la cantidad de calor que un cuerpo posee es :
Q = masa x entalpia
o
Q = masa x energa interna.
Pero en Ingeniera el calor no lo expresan as, sino lo expresan como masa
por calor especfico y por temperatura:
Q = m C T
Donde el calor especifico es una propiedad del material, al igual que la
densidad que es una propiedad de cada material.
Entonces que ocurre, la entalpia si se toma como referencia el
componente puro a 0 , entonces podemos hacer que la entalpia sea
calor especifico por temperatura.
Lo que ms usaremos nosotros en nuestros clculos ser masa por calor
especfico y por temperatura.
Hay dos tipos de capacidad calorfica:
- Uno cuando el material esta a presin constante Cp.
- Otra cuando el material esta a volumen constante Cv.
Casi siempre son iguales, pero a veces son diferentes y por eso hay que
diferenciarlas con los subndices p y v.
Cuando el volumen no cambia significa que el volumen es constante, y por
lo tanto tenemos que tomar la capacidad calorfica a volumen constante.
En cambio en una tubera, generalmente lo que es constante no es el
volumen sino la presin, por eso es que se toma a presin constante.
Las leyes de Fick de la difusin, fueron derivadas por Adolf Fick en el ao
1855. La primera ley de Fick relaciona el flujo por difusin al campo de
concentracin, postulando que el flujo va desde las regiones de alta
concentracin hasta las regiones de baja concentracin con una magnitud
que es proporcional al gradiente de concentracin
Perdidas de friccin en una tubera por la que pasa agua
La friccin en el tubo, se expresa como una cada de presin o como una
cabeza de friccin,
, y esta incluye las prdidas de friccin por
viscosidad, las prdidas por contraccin del tubo y las perdidas por
expansin del tubo, y se expresa mediante la siguiente frmula:
es el dimetro de la tubera
Como una cada de presin es P=F/A, entonces la fuerza de friccin es
F=PA, en nuestro caso sera:
Fuerza de friccin=
(B)
(C )
Suponiendo que la tubera no se expande ni se contrae porque esta es
muy chica, (
), reemplazando (C ) y (A) en (B), resulta:
(
)(
)(
)
(
)
Concept Map for chemical equilibrium
También podría gustarte
- Ejemplo 6.3 TreybalDocumento7 páginasEjemplo 6.3 TreybalJuan Carlos Montes CalaAún no hay calificaciones
- QES QSS Prob 20-IIDocumento9 páginasQES QSS Prob 20-IICursos Capacitaciones IngenieriaAún no hay calificaciones
- Ejercicio de Diseño de EvaporadoresDocumento22 páginasEjercicio de Diseño de EvaporadoresRocio Morales Rivera0% (1)
- Fenómenos Del Transporte, Ejercicio ResueltoDocumento11 páginasFenómenos Del Transporte, Ejercicio ResueltoMontse CerFerAún no hay calificaciones
- Ejemplo 10.6-2. Absorción de Acetona en Torre EmpacadaDocumento5 páginasEjemplo 10.6-2. Absorción de Acetona en Torre EmpacadaEsly Flores BarreraAún no hay calificaciones
- PROBLEMA 5.3 Del TreybalDocumento8 páginasPROBLEMA 5.3 Del Treyballurk 64Aún no hay calificaciones
- Ejercicio 1.2danDocumento4 páginasEjercicio 1.2danDayana AguilarAún no hay calificaciones
- Práctica 3 - Tiempos de ResidenciaDocumento19 páginasPráctica 3 - Tiempos de ResidenciaUriel Pamplona VidrioAún no hay calificaciones
- Marco TeóricoDocumento2 páginasMarco TeóricoANYELI LUCIANO FLORESAún no hay calificaciones
- Proyecto Física 2Documento9 páginasProyecto Física 2Esteban GarcesAún no hay calificaciones
- Preguntas para Examen Biorreactores MayoloDocumento11 páginasPreguntas para Examen Biorreactores MayoloReddy Righel Rodriguez MoralesAún no hay calificaciones
- Taller de EjerciciosDocumento11 páginasTaller de EjerciciosKatherine Muñoz GalazAún no hay calificaciones
- Informe Torre Empaque Azar Lem5Documento35 páginasInforme Torre Empaque Azar Lem5anaivonne1912agAún no hay calificaciones
- Examen 1a-Sep-2016 PDFDocumento3 páginasExamen 1a-Sep-2016 PDFFrank CanalesAún no hay calificaciones
- BencenoDocumento34 páginasBencenoCluisantony Jayco DizeAún no hay calificaciones
- Ejercicio 8 1 TreybalDocumento5 páginasEjercicio 8 1 TreybalDiego LeivaAún no hay calificaciones
- EJERCICIOS1Documento10 páginasEJERCICIOS1Cristian Singh100% (1)
- Ejemplo Destilacion MulticomponenteDocumento5 páginasEjemplo Destilacion MulticomponenteYulieth BravoAún no hay calificaciones
- Problemas 26 y 27Documento6 páginasProblemas 26 y 27Adrian VergaraAún no hay calificaciones
- Proyecto Lem 4Documento6 páginasProyecto Lem 4Martin LimaAún no hay calificaciones
- Reporte. Distribución de Tiempos de ResidenciaDocumento7 páginasReporte. Distribución de Tiempos de ResidenciaOscar GarziaAún no hay calificaciones
- Actividad 2. Del Angel Montes Rudy JovannyDocumento5 páginasActividad 2. Del Angel Montes Rudy Jovannyjavi RodriguezAún no hay calificaciones
- Difusividad Del Etanol en El AireDocumento12 páginasDifusividad Del Etanol en El AireIlcias Richard Calderon PoloAún no hay calificaciones
- Problemas LuybenDocumento5 páginasProblemas LuybenMIGUEL ANGEL GARCIA BONAún no hay calificaciones
- Coagulante DesbloqueadoDocumento145 páginasCoagulante DesbloqueadoChanez BacilioAún no hay calificaciones
- Problema 8-6Documento4 páginasProblema 8-6EduardodelAngelAún no hay calificaciones
- Saponificacion de Acetato de Etilo Grupo 5Documento15 páginasSaponificacion de Acetato de Etilo Grupo 5Vladimir Alex Caspa CopaAún no hay calificaciones
- Catalizadores SolidosDocumento33 páginasCatalizadores SolidosMayumi ApazaAún no hay calificaciones
- Ej 13-3Documento5 páginasEj 13-3Fernanda SalazarAún no hay calificaciones
- 1er Examen Parcial de Ingeniería de Reactores Químicos II 26Documento2 páginas1er Examen Parcial de Ingeniería de Reactores Químicos II 26TobiI SempaiAún no hay calificaciones
- Práctica No. 4 Reactor RPFDocumento10 páginasPráctica No. 4 Reactor RPFDiana ReyesAún no hay calificaciones
- Reporte 4 de Laboratorio de Ingeniería Química 4Documento7 páginasReporte 4 de Laboratorio de Ingeniería Química 4Lenin Abraxas RAún no hay calificaciones
- Mecanismo de ReacciónDocumento30 páginasMecanismo de ReacciónOliver Henry CamonesAún no hay calificaciones
- Tarea No.5 Isotermas de Langmuir y BETDocumento6 páginasTarea No.5 Isotermas de Langmuir y BETJulia Muñoz100% (1)
- X C C C ε C r C X F r C X F C C C C X ε P−R R r C X F X mol min mol∗ minDocumento4 páginasX C C C ε C r C X F r C X F C C C C X ε P−R R r C X F X mol min mol∗ minijptheanswerAún no hay calificaciones
- Reporte Torre EmpacadaDocumento17 páginasReporte Torre Empacada___ASCEAún no hay calificaciones
- Metodo de MickleyDocumento78 páginasMetodo de MickleyAndres EspinosaAún no hay calificaciones
- Examen Final Transferencia de MasaDocumento17 páginasExamen Final Transferencia de MasaSasha EspinosaAún no hay calificaciones
- Laboratorio Integral 2. - Práctica 12. - Determinación de La Energía de Activación.Documento8 páginasLaboratorio Integral 2. - Práctica 12. - Determinación de La Energía de Activación.DavidHerreraAún no hay calificaciones
- Apuntes 2 05 MarzoDocumento14 páginasApuntes 2 05 MarzoFernanda Nieto UriosteguiAún no hay calificaciones
- Módulo 13 Reactor BatchDocumento11 páginasMódulo 13 Reactor BatchMartínMaldonadoAún no hay calificaciones
- Practica Calificada EstadisticaDocumento8 páginasPractica Calificada Estadisticasandra quispeAún no hay calificaciones
- Metodo Grafico de WinkelmannDocumento4 páginasMetodo Grafico de WinkelmannCarmen HernandezAún no hay calificaciones
- Previo 4 PFRDocumento5 páginasPrevio 4 PFRNataliSotoRojasAún no hay calificaciones
- R2 Reactor Por LotesDocumento20 páginasR2 Reactor Por LotesJose Antonio VazquezAún no hay calificaciones
- Clase Practica de Balance de Energía en Calentadores (Enfriadores) y EvaporadoresDocumento5 páginasClase Practica de Balance de Energía en Calentadores (Enfriadores) y EvaporadoresVictor GarciaAún no hay calificaciones
- Reporte Torre de PlatosDocumento14 páginasReporte Torre de PlatosLuis RamírezAún no hay calificaciones
- Práctica 2. Torre de Pared MojadaDocumento10 páginasPráctica 2. Torre de Pared MojadaEduard UchihaAún no hay calificaciones
- Ejercicios de Transferencia de MasasDocumento7 páginasEjercicios de Transferencia de MasasFreddy Diaz GarciaAún no hay calificaciones
- Absorción AlumnoDocumento16 páginasAbsorción AlumnoLuis Antonio Sánchez SánchezAún no hay calificaciones
- Reporte. LEM VI Analisis de Platos de Una Torre de DestilacionDocumento21 páginasReporte. LEM VI Analisis de Platos de Una Torre de DestilacionOscar GarziaAún no hay calificaciones
- Eteres y EpóxidosDocumento27 páginasEteres y EpóxidosKelvin JimenezAún no hay calificaciones
- TM I Corte 1Documento18 páginasTM I Corte 1Laura Camargo Vega100% (1)
- Capítulo 4 & 5 DISEÑO DE REACTORES.Documento12 páginasCapítulo 4 & 5 DISEÑO DE REACTORES.Ambar FajardoAún no hay calificaciones
- 1 Serie de ProblemasDocumento2 páginas1 Serie de Problemaspollo_10Aún no hay calificaciones
- Practica 4Documento8 páginasPractica 4Christian Serna TerronesAún no hay calificaciones
- Problemas de Destilacion FlashDocumento4 páginasProblemas de Destilacion FlashDivita ArandaAún no hay calificaciones
- Empaque Estructurado RMPDocumento6 páginasEmpaque Estructurado RMPUlises Ramírez MatheyAún no hay calificaciones
- Tubos y Coraza VidrioDocumento23 páginasTubos y Coraza VidrioDavid Ramirez TorresAún no hay calificaciones
- Metodo Unifac. Etanol-AguaDocumento9 páginasMetodo Unifac. Etanol-AguataniaAún no hay calificaciones
- Apuntes OP3-Esxtracción y HumidificaciónDocumento32 páginasApuntes OP3-Esxtracción y HumidificaciónbeatrizAún no hay calificaciones
- Capitulo 9Documento63 páginasCapitulo 9alvaroCT100% (1)
- Universidad VeracruzanaDocumento18 páginasUniversidad VeracruzanaEnrique Hernandez LiraAún no hay calificaciones
- Problemas1,6 Equipo1 PS3.Documento36 páginasProblemas1,6 Equipo1 PS3.Karel GerardoAún no hay calificaciones
- Quimica 2Documento4 páginasQuimica 2Yakeisy ReyesAún no hay calificaciones
- Soluciones Químicas - 1B TN - 2022Documento8 páginasSoluciones Químicas - 1B TN - 2022Estela MirandaAún no hay calificaciones
- QSARDocumento30 páginasQSARChasconaAún no hay calificaciones
- Tensión Practica (Polipropileno - PolitetraFluorEtileno - Cabezal)Documento2416 páginasTensión Practica (Polipropileno - PolitetraFluorEtileno - Cabezal)Jimmy JuncoAún no hay calificaciones
- EstequiometríaDocumento43 páginasEstequiometríaVictor ReyesAún no hay calificaciones
- Ciclo de Refrigeración Por CompresiónDocumento41 páginasCiclo de Refrigeración Por CompresiónJean CharlesAún no hay calificaciones
- EvaluacionesDocumento2 páginasEvaluacionesDanny Rodriguez0% (1)
- Sustancia PuraDocumento26 páginasSustancia PuraDavid QuevedoAún no hay calificaciones
- Diseño de Un Vehículo Formula 1 Con Motor No-Convencional. Entrega 3Documento37 páginasDiseño de Un Vehículo Formula 1 Con Motor No-Convencional. Entrega 3Denisse Moya PachecoAún no hay calificaciones
- SpectrosDocumento24 páginasSpectrosDaniel Menéndez CrespoAún no hay calificaciones
- Solución QuimicaDocumento51 páginasSolución QuimicaJuan Daniel Montes SoteloAún no hay calificaciones
- Calor 1Documento25 páginasCalor 1karla padepAún no hay calificaciones
- Avance 2 - TF - Grupo 6Documento54 páginasAvance 2 - TF - Grupo 6Fiorella Quispe VenturaAún no hay calificaciones
- Resumen Final Ciencia de Los MaterialesDocumento93 páginasResumen Final Ciencia de Los Materialesignacio100% (1)
- CONTAMINACIONDocumento1 páginaCONTAMINACIONJAIME USECHAún no hay calificaciones
- Guia 3 - 5to Parcial - QMC-206Documento5 páginasGuia 3 - 5to Parcial - QMC-206Catrina AlencastreAún no hay calificaciones
- Capitulo 20 Costas PDFDocumento30 páginasCapitulo 20 Costas PDFClara Yulisa LópezAún no hay calificaciones
- Cromatografia de GasesDocumento5 páginasCromatografia de GasesDarvvin Tapia MirandaAún no hay calificaciones
- Guia 1 Estructura de La Materia 2019Documento22 páginasGuia 1 Estructura de La Materia 2019sandra patricia nupan castroAún no hay calificaciones
- (Exámenes Parciales) (2018 02 - 2020 00) PDFDocumento12 páginas(Exámenes Parciales) (2018 02 - 2020 00) PDFPercy Jhair VILLA FERNANDEZAún no hay calificaciones
- Metodos NumericosDocumento4 páginasMetodos NumericosDaniel Alejandro Quispe CaballeroAún no hay calificaciones
- Currículo - William YundaDocumento7 páginasCurrículo - William YundaWilliam Yunda T.Aún no hay calificaciones
- Mapa Conceptual Yeison EspejoDocumento3 páginasMapa Conceptual Yeison Espejoyeison de jesus EspejoAún no hay calificaciones
- Aminoacidos y Proteinas P-1Documento6 páginasAminoacidos y Proteinas P-1fortil666Aún no hay calificaciones
- Programa de L y D. Actualizado.Documento35 páginasPrograma de L y D. Actualizado.Edwin garcesAún no hay calificaciones