Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe de Laboratorio Hierro
Informe de Laboratorio Hierro
Cargado por
Cata GalindoCopyright:
Formatos disponibles
También podría gustarte
- Calidad del agua para estudiantes de ciencias ambientalesDe EverandCalidad del agua para estudiantes de ciencias ambientalesAún no hay calificaciones
- Practica 3 - Determinación de Carbono Orgánico Total Por Walkley BlackDocumento5 páginasPractica 3 - Determinación de Carbono Orgánico Total Por Walkley BlackZaira Camila CriolloAún no hay calificaciones
- Química Ejemplo de Informe de Laboratorio.Documento2 páginasQuímica Ejemplo de Informe de Laboratorio.washington romeroAún no hay calificaciones
- Sección 4.3Documento6 páginasSección 4.3Daemian Villarello50% (2)
- Protocolo Fe en Tabletas 2023 PDFDocumento3 páginasProtocolo Fe en Tabletas 2023 PDFRolando CuaAún no hay calificaciones
- Práctica No.9 Equipo 4Documento7 páginasPráctica No.9 Equipo 4Juan FranciscoAún no hay calificaciones
- Determinación de FOSFORO Por EAADocumento4 páginasDeterminación de FOSFORO Por EAAiris caicedoAún no hay calificaciones
- PRACTICA No5Documento8 páginasPRACTICA No5Carlos CastilloAún no hay calificaciones
- Fosfatos en Suelo-Método AnalíticoDocumento4 páginasFosfatos en Suelo-Método Analíticomajito15Aún no hay calificaciones
- Analitica ( (R10) )Documento5 páginasAnalitica ( (R10) )Abigail OrozcoAún no hay calificaciones
- Determinacion Colorimétrica de HierroDocumento3 páginasDeterminacion Colorimétrica de Hierrocamilo_mesa4010Aún no hay calificaciones
- Practica VinosDocumento47 páginasPractica VinosElaine LuuAún no hay calificaciones
- Espectrofotometro UvDocumento14 páginasEspectrofotometro UvAndersson MontañaAún no hay calificaciones
- Práct# 8 Soluciones Buffer y Capacidad AmortiguadoraDocumento4 páginasPráct# 8 Soluciones Buffer y Capacidad Amortiguadoralauracorralesaguirre02Aún no hay calificaciones
- Laboratorio de CianuroDocumento4 páginasLaboratorio de CianuroStfany Diazgranados RomeroAún no hay calificaciones
- Norma Inen Calidad Sulfato de Aluminio Feb - 010Documento14 páginasNorma Inen Calidad Sulfato de Aluminio Feb - 010Liliana ChalcoAún no hay calificaciones
- Determinación Del PH y Soluciones AmortiguadorasDocumento13 páginasDeterminación Del PH y Soluciones Amortiguadoraslz mbAún no hay calificaciones
- GUIA Est Ácido Base-1Documento11 páginasGUIA Est Ácido Base-1JulianaAún no hay calificaciones
- Determinación de Fe Por Colorimetría VisualDocumento4 páginasDeterminación de Fe Por Colorimetría VisualIgnacioAún no hay calificaciones
- 5 FitorremediacionDocumento5 páginas5 Fitorremediacionjuan esteban perezAún no hay calificaciones
- Practica 2 - Análisis Turbidimetrico PDFDocumento6 páginasPractica 2 - Análisis Turbidimetrico PDFLuisa CastañedaAún no hay calificaciones
- Practicas 4 AzufreDocumento6 páginasPracticas 4 AzufreHamiltonAún no hay calificaciones
- P1. Reacciones Electroquímicas Permanganato2Documento6 páginasP1. Reacciones Electroquímicas Permanganato2Moy Ortega MuliaAún no hay calificaciones
- Villarino Viloria Sara Sesión7Documento7 páginasVillarino Viloria Sara Sesión7sara villarinoAún no hay calificaciones
- Fosfatasa Residual +Documento3 páginasFosfatasa Residual +Luis Arturo Ruiz GalindoAún no hay calificaciones
- TurbidimetriaDocumento4 páginasTurbidimetriaYuli SanchezAún no hay calificaciones
- Determinación de Fósforo en Bebidas de ColaDocumento11 páginasDeterminación de Fósforo en Bebidas de Colagrecia2002mariaAún no hay calificaciones
- P8 Estandarizacion Del Permanganato de PotasioDocumento9 páginasP8 Estandarizacion Del Permanganato de PotasioDiana Ramirez GamboaAún no hay calificaciones
- Guia No 7 Fósforo Bray IIDocumento4 páginasGuia No 7 Fósforo Bray IIPaola Andrea GutierrezAún no hay calificaciones
- Guias de Quimica Analitica II USC 2012BDocumento55 páginasGuias de Quimica Analitica II USC 2012BNatalia ValenciaAún no hay calificaciones
- Une 83954 Durabilidad Hormigon - H2o Contenido Ion AmonioDocumento8 páginasUne 83954 Durabilidad Hormigon - H2o Contenido Ion Amoniowalking deadAún no hay calificaciones
- PRACTICA 7 Jarras OrignialDocumento8 páginasPRACTICA 7 Jarras OrignialLuis RamirezAún no hay calificaciones
- LAB 4 Det NitritosDocumento2 páginasLAB 4 Det Nitritosjuana vargas aguilarAún no hay calificaciones
- Fosfato en CocacolaDocumento9 páginasFosfato en CocacolaFernanda RodriguezAún no hay calificaciones
- Determinación Del Amoniaco P5Documento8 páginasDeterminación Del Amoniaco P5Rosendo CerónAún no hay calificaciones
- Espectrofotometria Uv VisibleDocumento4 páginasEspectrofotometria Uv VisibleSean OCAún no hay calificaciones
- Practica 3 - Remoción de Cromo Hexavalente - para Llenado de Los Equipos 2021Documento14 páginasPractica 3 - Remoción de Cromo Hexavalente - para Llenado de Los Equipos 2021Andrea Rodriguez GallegosAún no hay calificaciones
- Lab 2Documento3 páginasLab 2Jesus RedondoAún no hay calificaciones
- NMX-F-320-S-1978 Determinacion de Fosfatos en Embutidos PDFDocumento4 páginasNMX-F-320-S-1978 Determinacion de Fosfatos en Embutidos PDFAcqua LabAún no hay calificaciones
- Práctica N°4 Química AmbientalDocumento2 páginasPráctica N°4 Química AmbientalNathaliia KstroAún no hay calificaciones
- Acido FolicoDocumento7 páginasAcido FolicoAlberto Alvarado PonceAún no hay calificaciones
- Determinación de HCL y FosfóricoDocumento5 páginasDeterminación de HCL y FosfóricoIgnacioAún no hay calificaciones
- Lab Absorción FósforoDocumento3 páginasLab Absorción FósforoLizeth PabonAún no hay calificaciones
- (INFORME) Análisis de Hierro Con Ortofenantrolina en Un MedicamentoDocumento4 páginas(INFORME) Análisis de Hierro Con Ortofenantrolina en Un MedicamentoJULIANA CANO MADRIDAún no hay calificaciones
- Informe N°2 Quimica MineraDocumento5 páginasInforme N°2 Quimica MineraIvan Salinas SandovalAún no hay calificaciones
- Práctica 2Documento3 páginasPráctica 2Paola MartinezAún no hay calificaciones
- Práctica 6 Determinación de Fierro Total en Rocas ÍgneasDocumento4 páginasPráctica 6 Determinación de Fierro Total en Rocas ÍgneasEzequiel Ocañas100% (1)
- Guia 7 Potenciometria Coca Cola PDFDocumento4 páginasGuia 7 Potenciometria Coca Cola PDFwilmerpumaAún no hay calificaciones
- CobreDocumento4 páginasCobreyury luzmeri vargas mamaniAún no hay calificaciones
- Instructivo de Laboratorio de Toxicologia Forense 2014Documento35 páginasInstructivo de Laboratorio de Toxicologia Forense 2014Pascual LucasAún no hay calificaciones
- Determinación de Hierro U Tadeo.Documento4 páginasDeterminación de Hierro U Tadeo.nelsonmauri1Aún no hay calificaciones
- Determinacion de Yodo en NaClDocumento3 páginasDeterminacion de Yodo en NaCllbtorioAún no hay calificaciones
- El Análisis de Fósforo en El SueloDocumento5 páginasEl Análisis de Fósforo en El SueloAnthony Cango MirandaAún no hay calificaciones
- Pract 12 Determinacion de Fosforo en Bebidas de Cola1Documento5 páginasPract 12 Determinacion de Fosforo en Bebidas de Cola1RobertIgnacioEscalona100% (1)
- Pract 12 Determinacion de Fosforo en Bebidas de Cola1Documento5 páginasPract 12 Determinacion de Fosforo en Bebidas de Cola1Cristian Alan Ayala RodriguezAún no hay calificaciones
- Informe Jar TestDocumento5 páginasInforme Jar TestEvelyn QuizhpeAún no hay calificaciones
- Tubos Pasivos NO2Documento4 páginasTubos Pasivos NO2mauricioAún no hay calificaciones
- Análisis de Alimentos. Fundamentos y TécnicasDe EverandAnálisis de Alimentos. Fundamentos y TécnicasAún no hay calificaciones
- UF1668 - Análisis de agua potable y residualDe EverandUF1668 - Análisis de agua potable y residualAún no hay calificaciones
- Métodos quelométricos y otros métodos volumétricos de análisis clínicosDe EverandMétodos quelométricos y otros métodos volumétricos de análisis clínicosAún no hay calificaciones
- Presaberes Dinamica SistemasDocumento12 páginasPresaberes Dinamica SistemasAlvaro Ferley GutierrezAún no hay calificaciones
- Diesel Techo Alto Sin ACDocumento2 páginasDiesel Techo Alto Sin ACJesusAún no hay calificaciones
- Informe Prueba de LeveneDocumento12 páginasInforme Prueba de LeveneYulis Yulieth Llanes HernandezAún no hay calificaciones
- Tema 25 - Sistema de Ecuaciones I y II PDFDocumento4 páginasTema 25 - Sistema de Ecuaciones I y II PDFHoleguer CastilloAún no hay calificaciones
- Manual Perforación y TronaduraDocumento43 páginasManual Perforación y TronaduraCarlos Andrés Castro BustamanteAún no hay calificaciones
- Presentacion Digital LucasDocumento25 páginasPresentacion Digital LucascarolinaAún no hay calificaciones
- Taller UNIDAD 3. Metabolismo MicrobianoDocumento9 páginasTaller UNIDAD 3. Metabolismo MicrobianoAndres NietoAún no hay calificaciones
- Manual Mp3 Acuatico NGSDocumento34 páginasManual Mp3 Acuatico NGScarlogardesAún no hay calificaciones
- Barotrauma - Christiam Lozada VDocumento31 páginasBarotrauma - Christiam Lozada VChristiam Lozada100% (1)
- MATEMÁTICA 3ERO MEDIOguia 3 Probabilidad y EstadisticaDocumento8 páginasMATEMÁTICA 3ERO MEDIOguia 3 Probabilidad y EstadisticaLuis MorenoAún no hay calificaciones
- Trabajo Investigacion Curado de Concreto y VibradorDocumento6 páginasTrabajo Investigacion Curado de Concreto y VibradorTresaymAún no hay calificaciones
- U2-PP5 - BM Aire HúmedoDocumento27 páginasU2-PP5 - BM Aire HúmedoCristian Salas CapizoAún no hay calificaciones
- Estimación de Tiempos, Costos y RecursosDocumento5 páginasEstimación de Tiempos, Costos y Recursosxhuna100% (1)
- Termodinamica TestDocumento8 páginasTermodinamica TestSebastian Ruiz0% (1)
- Especs RHH 00 AWGDocumento1 páginaEspecs RHH 00 AWGLuis GalánAún no hay calificaciones
- Laboratorio 1 Termodinamica - Temperatura - Medicion de Temperatura - UBBDocumento15 páginasLaboratorio 1 Termodinamica - Temperatura - Medicion de Temperatura - UBBClaudio Alejandro Marín SalasAún no hay calificaciones
- Semana g05 ProporcionalidadDocumento6 páginasSemana g05 ProporcionalidadFelipe GallegosAún no hay calificaciones
- Evaluacion de Diagnostico Marcos David Gomez RochaDocumento23 páginasEvaluacion de Diagnostico Marcos David Gomez Rochamarcos rochaAún no hay calificaciones
- Redacción de TextoDocumento11 páginasRedacción de TextoAngélica RojasAún no hay calificaciones
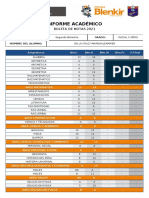
- Colegios Blenkir - 60319270 - 2021-08-25Documento2 páginasColegios Blenkir - 60319270 - 2021-08-25Naidelyn De La Cruz YarangaAún no hay calificaciones
- Tema 2.2. Biofísica Del Sistema Circulatorio PDFDocumento24 páginasTema 2.2. Biofísica Del Sistema Circulatorio PDFAna Belén ÁrbolAún no hay calificaciones
- Los Sentidos EsteticosDocumento3 páginasLos Sentidos EsteticosMax RAAún no hay calificaciones
- Tesis Felipe CuevasDocumento62 páginasTesis Felipe CuevasFelipe Alberto Cuevas PachecoAún no hay calificaciones
- Catalogo Manual DuralonDocumento194 páginasCatalogo Manual DuralonEduardo Cotejo71% (7)
- Karl PearsonDocumento5 páginasKarl PearsonMARLON RICARDO RUIZ FERNANDEZAún no hay calificaciones
- Taller 5 Radiación de Cuerpo Negro OndasDocumento12 páginasTaller 5 Radiación de Cuerpo Negro OndasMARIO JOSE TOLOZA RINCONAún no hay calificaciones
- S6 HT Sistemas de Ecuaciones Lineales SOLUCIONARIODocumento14 páginasS6 HT Sistemas de Ecuaciones Lineales SOLUCIONARIOAnonymous W1mMU5ZAún no hay calificaciones
- Ejercicios de NominaDocumento13 páginasEjercicios de NominaMarialejandra Alvarez SaldarriagaAún no hay calificaciones
- Pecosa VestuarioDocumento8 páginasPecosa VestuarioMIHAI J. RAMIREZ RUELASAún no hay calificaciones
Informe de Laboratorio Hierro
Informe de Laboratorio Hierro
Cargado por
Cata GalindoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe de Laboratorio Hierro
Informe de Laboratorio Hierro
Cargado por
Cata GalindoCopyright:
Formatos disponibles
INFORME DE LABORATORIO DETERMINACION DE HIERRO EN UNA CAPSULA DE SULFATO FERROSO
1. OBJETIVO GENERAL: 1.1 Determinar la cantidad de hierro presente en una capsula de sulfato ferroso por colorimetra. 2. OBJETIVOS ESPECIFICOS: 2.1 Conocer en que se fundamenta el anlisis Colorimtrico. 2.2 Comparar la cantidad de hierro obtenido con lo que dice la etiqueta. 2.3 Definir e interpretar el protocolo del ensayo a realizar, equipos y materiales e instrumentos. 2.4 Realizar los ensayos siguiendo estrictamente el protocolo. 2.5 Utilizar los equipos de la forma adecuada leyendo las fichas tcnicas de estos. 2.6 Reportar los datos de manera adecuada y reportarlos en los formatos preestablecidos. 3. INTRODUCCION: El sulfato ferroso proporciona el hierro que el organismo necesita para producir glbulos rojos, por ello se hace necesario verificar que el hierro contenido en las capsulas sea el mismo que se obtiene experimentalmente. Para observar que el medicamento verdaderamente cumple con la dosis de hierro que requieren las personas y verificar la calidad del producto. 4. PROCEDIMIENTO (ANEXO A): 4.1 Preparar la solucin madre de 1L de sulfato amoniacal de hierro (ANEXO B). 4.2 Preparar las soluciones patrn de la solucin madre de 5, 10, 20, 25, 30 ppm, en un baln aforado de 25 ml.(ANEXO C). 4.3 Tomar 5 tubos de ensayo y agregue 1 ml de cada solucin patrn de hierro (con los tubos de ensayo previamente marcados). 4.4 Agregue a cada tubo 1 ml de solucin patrn con la respectiva concentracin. 4.5 Agregue 1 ml de solucin buffer pH 3.6 a cada tubo de ensayo (ANEXO D). 4.6 Agregue 1 ml de solucin orto- fenantrolina (ANEXO E). 4.7 Agregue 7 ml de agua destilada.
4.8 Lea en el colormetro a una longitud de onda 510 nm (ANEXO F). 4.9 Haga la curva de calibracin con las soluciones patrn de sulfato amoniacal de hierro (ANEXO G). 4.10 Prepare la tableta de sulfato ferroso. (ANEXO H). 4.11 Lea en el colormetro a 510 nm (ANEXO I). 5. RESULTADOS. 5.1 ENSAYO 1 CONCENTRACION 5 ppm 10 ppm 20 ppm 30 ppm 40 ppm 50 ppm 5.2 ENSAYO 2 CONCENTRACION 5 ppm 10 ppm 20 ppm 30 ppm ABSORBANCIA 0.04 0.18 0.25 0.40 % TRANSMITANCIA 92% 67% 57% 40% ABSORBANCIA 0.04 0.18 0.25 0.40 0.30 0.36 % TRANSMITANCIA 92% 67% 57% 40% 50% 44%
40 ppm 50 ppm 5.3 ENSAYO 3
0.30 0.36
50% 44%
CONCENTRACION 5 ppm 25 ppm 30 ppm 35 ppm 40 ppm
ABSORBANCIA 0.04 0.12 0.13 0.22 0.20
% TRANSMITANCIA 92% 79% 75% 60% 59%
5.4 MUESTRAS DE SULFATO FERROSO MUESTRA 1 2 ABSORBANCIA 0.11 0.15 % TRANSMITANCIA 73% 77%
LAS GRAFICAS SE ENCUENTRAN EN MEDIO FISICO.
6. ANALISIS DE RESULTADOS: 6.1 El ensayo numero 1 se observa una variacin importante en la absorbancia del patrn de 30 ppm esto pudo haber sucedido por: 6.1.1 No se preparo correctamente el patrn. 6.1.2 Ocurri contaminacin. 6.1.3 En el equipo ocurri alguna interferencia de algn tipo que altero la absorbancia del patrn. 6.1.4 Es la primera vez en la que se preparan patrones y se manipula el equipo.
6.2
En el ensayo numero 2 se genero el mismo problema del primer ensayo y la concentracin de 30 ppm tambin se observo una variacin
Las razones pueden ser: 6.2.1 El patrn al estar guardado se desnaturalizo y perdi su concentracin inicial. 6.2.2 Error en la medicin con las pipetas. 6.2.3 No utilizar los instrumentos adecuados.
6.3 Se tomo la decisin de hacer patrones de concentracin muy prxima para 25, 30, 35, 40 ppm para determinar as con esos patrones la concentracin de nuestro analito. 6.4.1 Se observ como en los anteriores que al aumentar la concentracin aumentaba la absorbancia y disminua la transmitancia. 6.4 Se hizo el anlisis a una grajea de Sulfato Ferroso (FeSO 4) en la cual el resultado fueron 30 ppm lo que coincide con lo que est en la etiqueta de 30 mg de Fe. Lo que quiere decir que la prueba es confiable y que ya los patrones y la calibracin del equipo estaban bien hechas.
7 ANEXOS. 7.1 ANEXO A (PROCEDIMIENTO PARA EL ANLISIS).
INICIO. 7.1.1 Preparar la solucin madre de 1L de sulfato amoniacal de hierro.
7.1.2 Preparar las soluciones patrn de la solucin madre de 5, 10, 20, 25, 30 ppm, en un baln aforado de 25 ml. 7.1.3 Tomar 5 tubos de ensayo y agregue 1 ml de cada solucin patrn de hierro.
Agregue a cada tubo 1 ml de solucin patrn con la respectiva concentracin.
7.1.5 Agregue 1 ml de solucin buffer pH 3.6 a cada tubo de ensayo.
7.1.6 Agregue 1 ml de solucin buffer pH 3.6 a cada tubo de ensayo.
7.1.7 Agregue 1 ml de solucin orto- fenantrolina. Agregue 7 ml de agua destilada. Agregue 7 ml de agua destilada. A
7.1.10 Lea en el colormetro a una longitud de onda 510 nm.
7.1.11 Haga la curva de calibracin con las soluciones patrn de sulfato amoniacal de hierro.
7.1.12 Prepare la tableta de sulfato ferroso.
7.1.13 Lea en el colormetro a 510 nm.
FIN.
8. CONCLUSIONES. 8.1 Se conoci y se aprendi el manejo del equipo de colorimetra. 8.2 Se logro determinar la concentracin exacta de hierro en una gragea. 8.3 Se identificaron los errores que se pueden presentar en un anlisis cuantitativo.
También podría gustarte
- Calidad del agua para estudiantes de ciencias ambientalesDe EverandCalidad del agua para estudiantes de ciencias ambientalesAún no hay calificaciones
- Practica 3 - Determinación de Carbono Orgánico Total Por Walkley BlackDocumento5 páginasPractica 3 - Determinación de Carbono Orgánico Total Por Walkley BlackZaira Camila CriolloAún no hay calificaciones
- Química Ejemplo de Informe de Laboratorio.Documento2 páginasQuímica Ejemplo de Informe de Laboratorio.washington romeroAún no hay calificaciones
- Sección 4.3Documento6 páginasSección 4.3Daemian Villarello50% (2)
- Protocolo Fe en Tabletas 2023 PDFDocumento3 páginasProtocolo Fe en Tabletas 2023 PDFRolando CuaAún no hay calificaciones
- Práctica No.9 Equipo 4Documento7 páginasPráctica No.9 Equipo 4Juan FranciscoAún no hay calificaciones
- Determinación de FOSFORO Por EAADocumento4 páginasDeterminación de FOSFORO Por EAAiris caicedoAún no hay calificaciones
- PRACTICA No5Documento8 páginasPRACTICA No5Carlos CastilloAún no hay calificaciones
- Fosfatos en Suelo-Método AnalíticoDocumento4 páginasFosfatos en Suelo-Método Analíticomajito15Aún no hay calificaciones
- Analitica ( (R10) )Documento5 páginasAnalitica ( (R10) )Abigail OrozcoAún no hay calificaciones
- Determinacion Colorimétrica de HierroDocumento3 páginasDeterminacion Colorimétrica de Hierrocamilo_mesa4010Aún no hay calificaciones
- Practica VinosDocumento47 páginasPractica VinosElaine LuuAún no hay calificaciones
- Espectrofotometro UvDocumento14 páginasEspectrofotometro UvAndersson MontañaAún no hay calificaciones
- Práct# 8 Soluciones Buffer y Capacidad AmortiguadoraDocumento4 páginasPráct# 8 Soluciones Buffer y Capacidad Amortiguadoralauracorralesaguirre02Aún no hay calificaciones
- Laboratorio de CianuroDocumento4 páginasLaboratorio de CianuroStfany Diazgranados RomeroAún no hay calificaciones
- Norma Inen Calidad Sulfato de Aluminio Feb - 010Documento14 páginasNorma Inen Calidad Sulfato de Aluminio Feb - 010Liliana ChalcoAún no hay calificaciones
- Determinación Del PH y Soluciones AmortiguadorasDocumento13 páginasDeterminación Del PH y Soluciones Amortiguadoraslz mbAún no hay calificaciones
- GUIA Est Ácido Base-1Documento11 páginasGUIA Est Ácido Base-1JulianaAún no hay calificaciones
- Determinación de Fe Por Colorimetría VisualDocumento4 páginasDeterminación de Fe Por Colorimetría VisualIgnacioAún no hay calificaciones
- 5 FitorremediacionDocumento5 páginas5 Fitorremediacionjuan esteban perezAún no hay calificaciones
- Practica 2 - Análisis Turbidimetrico PDFDocumento6 páginasPractica 2 - Análisis Turbidimetrico PDFLuisa CastañedaAún no hay calificaciones
- Practicas 4 AzufreDocumento6 páginasPracticas 4 AzufreHamiltonAún no hay calificaciones
- P1. Reacciones Electroquímicas Permanganato2Documento6 páginasP1. Reacciones Electroquímicas Permanganato2Moy Ortega MuliaAún no hay calificaciones
- Villarino Viloria Sara Sesión7Documento7 páginasVillarino Viloria Sara Sesión7sara villarinoAún no hay calificaciones
- Fosfatasa Residual +Documento3 páginasFosfatasa Residual +Luis Arturo Ruiz GalindoAún no hay calificaciones
- TurbidimetriaDocumento4 páginasTurbidimetriaYuli SanchezAún no hay calificaciones
- Determinación de Fósforo en Bebidas de ColaDocumento11 páginasDeterminación de Fósforo en Bebidas de Colagrecia2002mariaAún no hay calificaciones
- P8 Estandarizacion Del Permanganato de PotasioDocumento9 páginasP8 Estandarizacion Del Permanganato de PotasioDiana Ramirez GamboaAún no hay calificaciones
- Guia No 7 Fósforo Bray IIDocumento4 páginasGuia No 7 Fósforo Bray IIPaola Andrea GutierrezAún no hay calificaciones
- Guias de Quimica Analitica II USC 2012BDocumento55 páginasGuias de Quimica Analitica II USC 2012BNatalia ValenciaAún no hay calificaciones
- Une 83954 Durabilidad Hormigon - H2o Contenido Ion AmonioDocumento8 páginasUne 83954 Durabilidad Hormigon - H2o Contenido Ion Amoniowalking deadAún no hay calificaciones
- PRACTICA 7 Jarras OrignialDocumento8 páginasPRACTICA 7 Jarras OrignialLuis RamirezAún no hay calificaciones
- LAB 4 Det NitritosDocumento2 páginasLAB 4 Det Nitritosjuana vargas aguilarAún no hay calificaciones
- Fosfato en CocacolaDocumento9 páginasFosfato en CocacolaFernanda RodriguezAún no hay calificaciones
- Determinación Del Amoniaco P5Documento8 páginasDeterminación Del Amoniaco P5Rosendo CerónAún no hay calificaciones
- Espectrofotometria Uv VisibleDocumento4 páginasEspectrofotometria Uv VisibleSean OCAún no hay calificaciones
- Practica 3 - Remoción de Cromo Hexavalente - para Llenado de Los Equipos 2021Documento14 páginasPractica 3 - Remoción de Cromo Hexavalente - para Llenado de Los Equipos 2021Andrea Rodriguez GallegosAún no hay calificaciones
- Lab 2Documento3 páginasLab 2Jesus RedondoAún no hay calificaciones
- NMX-F-320-S-1978 Determinacion de Fosfatos en Embutidos PDFDocumento4 páginasNMX-F-320-S-1978 Determinacion de Fosfatos en Embutidos PDFAcqua LabAún no hay calificaciones
- Práctica N°4 Química AmbientalDocumento2 páginasPráctica N°4 Química AmbientalNathaliia KstroAún no hay calificaciones
- Acido FolicoDocumento7 páginasAcido FolicoAlberto Alvarado PonceAún no hay calificaciones
- Determinación de HCL y FosfóricoDocumento5 páginasDeterminación de HCL y FosfóricoIgnacioAún no hay calificaciones
- Lab Absorción FósforoDocumento3 páginasLab Absorción FósforoLizeth PabonAún no hay calificaciones
- (INFORME) Análisis de Hierro Con Ortofenantrolina en Un MedicamentoDocumento4 páginas(INFORME) Análisis de Hierro Con Ortofenantrolina en Un MedicamentoJULIANA CANO MADRIDAún no hay calificaciones
- Informe N°2 Quimica MineraDocumento5 páginasInforme N°2 Quimica MineraIvan Salinas SandovalAún no hay calificaciones
- Práctica 2Documento3 páginasPráctica 2Paola MartinezAún no hay calificaciones
- Práctica 6 Determinación de Fierro Total en Rocas ÍgneasDocumento4 páginasPráctica 6 Determinación de Fierro Total en Rocas ÍgneasEzequiel Ocañas100% (1)
- Guia 7 Potenciometria Coca Cola PDFDocumento4 páginasGuia 7 Potenciometria Coca Cola PDFwilmerpumaAún no hay calificaciones
- CobreDocumento4 páginasCobreyury luzmeri vargas mamaniAún no hay calificaciones
- Instructivo de Laboratorio de Toxicologia Forense 2014Documento35 páginasInstructivo de Laboratorio de Toxicologia Forense 2014Pascual LucasAún no hay calificaciones
- Determinación de Hierro U Tadeo.Documento4 páginasDeterminación de Hierro U Tadeo.nelsonmauri1Aún no hay calificaciones
- Determinacion de Yodo en NaClDocumento3 páginasDeterminacion de Yodo en NaCllbtorioAún no hay calificaciones
- El Análisis de Fósforo en El SueloDocumento5 páginasEl Análisis de Fósforo en El SueloAnthony Cango MirandaAún no hay calificaciones
- Pract 12 Determinacion de Fosforo en Bebidas de Cola1Documento5 páginasPract 12 Determinacion de Fosforo en Bebidas de Cola1RobertIgnacioEscalona100% (1)
- Pract 12 Determinacion de Fosforo en Bebidas de Cola1Documento5 páginasPract 12 Determinacion de Fosforo en Bebidas de Cola1Cristian Alan Ayala RodriguezAún no hay calificaciones
- Informe Jar TestDocumento5 páginasInforme Jar TestEvelyn QuizhpeAún no hay calificaciones
- Tubos Pasivos NO2Documento4 páginasTubos Pasivos NO2mauricioAún no hay calificaciones
- Análisis de Alimentos. Fundamentos y TécnicasDe EverandAnálisis de Alimentos. Fundamentos y TécnicasAún no hay calificaciones
- UF1668 - Análisis de agua potable y residualDe EverandUF1668 - Análisis de agua potable y residualAún no hay calificaciones
- Métodos quelométricos y otros métodos volumétricos de análisis clínicosDe EverandMétodos quelométricos y otros métodos volumétricos de análisis clínicosAún no hay calificaciones
- Presaberes Dinamica SistemasDocumento12 páginasPresaberes Dinamica SistemasAlvaro Ferley GutierrezAún no hay calificaciones
- Diesel Techo Alto Sin ACDocumento2 páginasDiesel Techo Alto Sin ACJesusAún no hay calificaciones
- Informe Prueba de LeveneDocumento12 páginasInforme Prueba de LeveneYulis Yulieth Llanes HernandezAún no hay calificaciones
- Tema 25 - Sistema de Ecuaciones I y II PDFDocumento4 páginasTema 25 - Sistema de Ecuaciones I y II PDFHoleguer CastilloAún no hay calificaciones
- Manual Perforación y TronaduraDocumento43 páginasManual Perforación y TronaduraCarlos Andrés Castro BustamanteAún no hay calificaciones
- Presentacion Digital LucasDocumento25 páginasPresentacion Digital LucascarolinaAún no hay calificaciones
- Taller UNIDAD 3. Metabolismo MicrobianoDocumento9 páginasTaller UNIDAD 3. Metabolismo MicrobianoAndres NietoAún no hay calificaciones
- Manual Mp3 Acuatico NGSDocumento34 páginasManual Mp3 Acuatico NGScarlogardesAún no hay calificaciones
- Barotrauma - Christiam Lozada VDocumento31 páginasBarotrauma - Christiam Lozada VChristiam Lozada100% (1)
- MATEMÁTICA 3ERO MEDIOguia 3 Probabilidad y EstadisticaDocumento8 páginasMATEMÁTICA 3ERO MEDIOguia 3 Probabilidad y EstadisticaLuis MorenoAún no hay calificaciones
- Trabajo Investigacion Curado de Concreto y VibradorDocumento6 páginasTrabajo Investigacion Curado de Concreto y VibradorTresaymAún no hay calificaciones
- U2-PP5 - BM Aire HúmedoDocumento27 páginasU2-PP5 - BM Aire HúmedoCristian Salas CapizoAún no hay calificaciones
- Estimación de Tiempos, Costos y RecursosDocumento5 páginasEstimación de Tiempos, Costos y Recursosxhuna100% (1)
- Termodinamica TestDocumento8 páginasTermodinamica TestSebastian Ruiz0% (1)
- Especs RHH 00 AWGDocumento1 páginaEspecs RHH 00 AWGLuis GalánAún no hay calificaciones
- Laboratorio 1 Termodinamica - Temperatura - Medicion de Temperatura - UBBDocumento15 páginasLaboratorio 1 Termodinamica - Temperatura - Medicion de Temperatura - UBBClaudio Alejandro Marín SalasAún no hay calificaciones
- Semana g05 ProporcionalidadDocumento6 páginasSemana g05 ProporcionalidadFelipe GallegosAún no hay calificaciones
- Evaluacion de Diagnostico Marcos David Gomez RochaDocumento23 páginasEvaluacion de Diagnostico Marcos David Gomez Rochamarcos rochaAún no hay calificaciones
- Redacción de TextoDocumento11 páginasRedacción de TextoAngélica RojasAún no hay calificaciones
- Colegios Blenkir - 60319270 - 2021-08-25Documento2 páginasColegios Blenkir - 60319270 - 2021-08-25Naidelyn De La Cruz YarangaAún no hay calificaciones
- Tema 2.2. Biofísica Del Sistema Circulatorio PDFDocumento24 páginasTema 2.2. Biofísica Del Sistema Circulatorio PDFAna Belén ÁrbolAún no hay calificaciones
- Los Sentidos EsteticosDocumento3 páginasLos Sentidos EsteticosMax RAAún no hay calificaciones
- Tesis Felipe CuevasDocumento62 páginasTesis Felipe CuevasFelipe Alberto Cuevas PachecoAún no hay calificaciones
- Catalogo Manual DuralonDocumento194 páginasCatalogo Manual DuralonEduardo Cotejo71% (7)
- Karl PearsonDocumento5 páginasKarl PearsonMARLON RICARDO RUIZ FERNANDEZAún no hay calificaciones
- Taller 5 Radiación de Cuerpo Negro OndasDocumento12 páginasTaller 5 Radiación de Cuerpo Negro OndasMARIO JOSE TOLOZA RINCONAún no hay calificaciones
- S6 HT Sistemas de Ecuaciones Lineales SOLUCIONARIODocumento14 páginasS6 HT Sistemas de Ecuaciones Lineales SOLUCIONARIOAnonymous W1mMU5ZAún no hay calificaciones
- Ejercicios de NominaDocumento13 páginasEjercicios de NominaMarialejandra Alvarez SaldarriagaAún no hay calificaciones
- Pecosa VestuarioDocumento8 páginasPecosa VestuarioMIHAI J. RAMIREZ RUELASAún no hay calificaciones