Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Limites de Solubilidad
Cargado por
WilliamsGerardoRondon100%(1)100% encontró este documento útil (1 voto)
3K vistas14 páginasSolubilidad.
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPT, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoSolubilidad.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPT, PDF, TXT o lea en línea desde Scribd
100%(1)100% encontró este documento útil (1 voto)
3K vistas14 páginasLimites de Solubilidad
Cargado por
WilliamsGerardoRondonSolubilidad.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPT, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 14
Solubilidad
La solubilidad es la medida o magnitud que
indica la cantidad mxima de soluto que
puede disolverse en una cantidad
determinada de solvente y a una
temperatura dada.
La Solubilidad de una sustancia es una
medida de cuanto soluto se disuelve en una
cantidad determinada de disolvente a una
temperatura especifica.
El mtodo preferido para hacer que el
soluto se disuelva en esta clase de
soluciones es calentar la muestra. La
sustancia que se disuelve se denomina
soluto y la sustancia donde se disuelve el
soluto se llama disolvente . No todas las
sustancias se disuelvan en un mismo
solvente.
El termino solubilidad se utiliza para
designar al fenmeno cualitativo del
proceso de disolucin como para expresar
cuantitativamente la concentracin de las
soluciones
La solubilidad de una sustancia depende de la
naturaleza del disolvente y del soluto, as como de la
temperatura y la presin del sistema, es decir, de la
tendencia del sistema a alcanzar el valor mximo de
entropa.
Cuando una sustancia parece no disolverse, se dice que
es insoluble.
El proceso de interaccin entre las molculas del
disolvente y las partculas del soluto para formar
agregados se le llama solvatacin y si el solvente es
agua hidratacin.
Terminologa de las concentraciones
Las concentraciones de las soluciones en el punto
de saturacin se llaman
solubilidades; se expresa como masa de soluto por
masa de disolvente. Para las soluciones en las
que el disolvente es el agua, la solubilidad se
expresa como masa en gramos de soluto por 100
gramos de agua, a una temperatura dada.
Para trabajos de laboratorio, es mas conveniente
expresar la solubilidad en cantidad de moles de
cada reactivo. Por esta razn, una concentracin
comnmente empleada es la molaridad.
La molaridad (M) se define como el numero de moles
de soluto disuelto en cada litro de disolucin. La
ventaja de la solucin molar es que puede
emplearse como una especie de forma liquida del
soluto.
Segn la definicin de molaridad, sabemos q 1 litro de
una solucin molar de NaOH contiene 40 graos de
NaOH. Un mililitro de esta solucin contiene, por lo
tanto 10-3 moles, sea 0.040 gramos de NaOH.
1.0=1 mol de NaOH por
litro de solucin
=40 g NaOH/1000 ml de solucin
=0.040 g/ml de solucin
Dos sustancias, como el oxgenos y el dixido de
carbono, que se mezclan fcilmente en todas las
proporciones, se llaman miscibles. Dos lquidos, agua
y mercurio, se llamaran no miscibles. Si tratamos de
formar soluciones de gases en gases encontramos
que se forman en todas proporciones, como lo
demuestra el aire; sin embargo al mezclar agua y
mercurio observaremos que la solucin no se
consigue.
Entre estos dos limites de solubilidad hay muchos
ejemplos de sustancias que se mezclan, pero solo
hasta ciertas proporciones mximas de soluto y
disolvente
Como el mecanismo de disolucin supone
movimiento de molculas, la temperatura y la
presin tienen efecto en la solubilidad.
Los slidos se disuelven en agua en cantidades
que dependen de la temperatura; la mayora es
mas soluble cerca del punto de ebullicin del agua
que del de congelacin; la presin ejerce una ligera
influencia en la solubilidad del slido por que pocos
tienen una presin de vapor mensurable
Muchos lquidos son completamente miscibles
con el agua. Los lquidos ligeramente solubles; o
parcialmente ni miscibles tienen una solubilidad
similar a la de los slidos. Sus solubilidades
tienden a crecer con el aumento de la temperatura
Los gases son generalmente mas
solubles en agua fra y tienden a
abandonar las soluciones en forma de
burbujas, cuando se calienta si el
proceso es rpido se le llama
efervescencia.
La mxima solubilidad para los gases
se encuentra cerca del punto de
congelacin del agua; la presin tiene
un efecto mensurable en la solubilidad
de los gases. La solubilidad de los gases
en el agua es directamente proporcional
a la presin del gas sobre el agua, a una
temperatura dada
Tipos de soluciones con respecto a la
solubilidad.
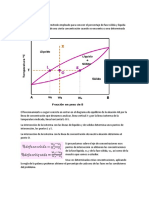
Cuando el limite de solubilidad se ha alcanzado
para una temperatura determinada y algo del
soluto permanece sin disolver, se ha formado una
solucin saturada. En este estado hemos
establecido un equilibrio dinmico entre
molculas del soluto disuelto y las del no disuelto.
El proceso de disolucin nunca se detiene. La
velocidad a la que las partculas del soluto entran
en disolucin es igual a la velocidad en que
cristalizan.
Es posible calentar esta solucin y lograr que se
disuelva mas soluto. Si todo el soluto se disuelve
y se deja enfriar la solucin, puede suceder que
no se produzca la re cristalizacin. El exceso de
soluto queda en solucin. Cuando esto ocurre,
hemos obtenido una solucin sobresaturada; esto
es, hemos logrado que entre mas soluto del que
se disolvera en condiciones normales a esa
temperatura. Las soluciones sobresaturadas no
estn en equilibrio.
BIBLIOGRAFIA
Burns. Fundamentos de qumica.
J. B. Umland. Qumica general.
G. R. Choppin. Qumica.
También podría gustarte
- Resumen Principio de Le-ChatelierDocumento1 páginaResumen Principio de Le-ChatelierRoberto Badillo Tivo100% (1)
- Propiedades Mecánicas de Los TermoplásticosDocumento12 páginasPropiedades Mecánicas de Los TermoplásticosvanessariverarAún no hay calificaciones
- Polimeros LiquidosDocumento3 páginasPolimeros LiquidosElias Vidal MedinaAún no hay calificaciones
- Cuál Es El Efecto de Agitar El Solvente PuroDocumento4 páginasCuál Es El Efecto de Agitar El Solvente PuroMarina Rojas TorresAún no hay calificaciones
- Propiedades ColigativasDocumento43 páginasPropiedades Coligativaschifu6Aún no hay calificaciones
- Informe 10 Equilibrio - QuimicoDocumento17 páginasInforme 10 Equilibrio - QuimicoRonald Gomez OrellanaAún no hay calificaciones
- Calor de Disolucion de Ac. BenzoicoDocumento6 páginasCalor de Disolucion de Ac. BenzoicoJuan Pablo DelgadoAún no hay calificaciones
- Manual Tema 8 Diagramas de Fase FORMATO2Documento43 páginasManual Tema 8 Diagramas de Fase FORMATO2henry erikAún no hay calificaciones
- Unidad II Selección de Solventes para Absorción FísicaDocumento14 páginasUnidad II Selección de Solventes para Absorción FísicaNERIO ANTONIO STRUVE ROMEROAún no hay calificaciones
- Problemas Termodinámica Sistemas AbiertosDocumento3 páginasProblemas Termodinámica Sistemas Abiertose3m882Aún no hay calificaciones
- Corrosión ElectroquímicaDocumento8 páginasCorrosión Electroquímicadaniel chirinosAún no hay calificaciones
- Significado de SólidoDocumento2 páginasSignificado de SólidojosetecoAún no hay calificaciones
- Fluidizacion Concepto GeneralDocumento15 páginasFluidizacion Concepto Generaljlls21Aún no hay calificaciones
- Equilibrio de Fases Condesadas - Diaz RoigDocumento22 páginasEquilibrio de Fases Condesadas - Diaz RoigGauss RiverosAún no hay calificaciones
- Diagramas de FaseDocumento41 páginasDiagramas de FaseHugo'SAún no hay calificaciones
- Manula Termodinamica - Cristal Lopez Hernandez U2Documento10 páginasManula Termodinamica - Cristal Lopez Hernandez U2Paola MontufarAún no hay calificaciones
- Informe Practica 4Documento51 páginasInforme Practica 4angieAún no hay calificaciones
- Crioscopia ConclusionesDocumento1 páginaCrioscopia ConclusionesAda Jany RojasAún no hay calificaciones
- Modelo de HelmholtzDocumento10 páginasModelo de HelmholtzRicardo Marquez GarciaAún no hay calificaciones
- PROBLEMA 2 Sistema Cerrado Con Interpolación Realizado en ClaseDocumento2 páginasPROBLEMA 2 Sistema Cerrado Con Interpolación Realizado en ClaseVXXIVAún no hay calificaciones
- Mediciones CalorimétricasDocumento3 páginasMediciones CalorimétricasT L Jho Jans WellAún no hay calificaciones
- Clase 8 Diagramas de FasesDocumento37 páginasClase 8 Diagramas de FasesJose BallesteroAún no hay calificaciones
- Viscosidad Practica #3Documento9 páginasViscosidad Practica #3Vivian HenriquezAún no hay calificaciones
- Tubos ConcentricosDocumento10 páginasTubos ConcentricosKarla MerloAún no hay calificaciones
- 9,10,11,12 de OpuDocumento3 páginas9,10,11,12 de OpuTiofilo Aguilar MendozaAún no hay calificaciones
- Termodinamica Soluciones Presentacion PowerpointDocumento21 páginasTermodinamica Soluciones Presentacion Powerpointrichard suri conza0% (1)
- Mezclas BinariasDocumento2 páginasMezclas BinariasOscar OsorioAún no hay calificaciones
- Propiedades Coligativas de Las Soluciones. Lab 4Documento6 páginasPropiedades Coligativas de Las Soluciones. Lab 4ronaldoAún no hay calificaciones
- Diagrama de FasesDocumento28 páginasDiagrama de FasesabrahamAún no hay calificaciones
- Reacciones CatalizadasDocumento9 páginasReacciones CatalizadasWalther JesusAún no hay calificaciones
- Drenado de TanquesDocumento5 páginasDrenado de TanquesAngel Ardila ArdilaAún no hay calificaciones
- Informe IIIDocumento27 páginasInforme IIIPaulina PavicichAún no hay calificaciones
- Resumen Del Capitulo 3 Termodinámica Grupo N°4Documento7 páginasResumen Del Capitulo 3 Termodinámica Grupo N°4RolexAún no hay calificaciones
- Sistemas Multicomponentes 2Ay2BDocumento37 páginasSistemas Multicomponentes 2Ay2BTania FloresAún no hay calificaciones
- Introduccion y Objetivos CristalizacionDocumento1 páginaIntroduccion y Objetivos CristalizacionlaurasmaresAún no hay calificaciones
- Equilibrio Líquido LíquidoDocumento14 páginasEquilibrio Líquido LíquidoISABELLAAún no hay calificaciones
- Ejemplos Nano ReglasDocumento1 páginaEjemplos Nano ReglasLinda GeraldineAún no hay calificaciones
- Ecuacion de BernoulliDocumento10 páginasEcuacion de Bernoullibelinda blancoAún no hay calificaciones
- Partes de La Bomba de EngranajesDocumento4 páginasPartes de La Bomba de EngranajesJosé Ignacio Bermúdez Aros100% (1)
- CristalizacionDocumento8 páginasCristalizacionMonse Gomez RAún no hay calificaciones
- Adiós A Los CastillosDocumento1 páginaAdiós A Los CastillosAndy GuzmanAún no hay calificaciones
- 4.1.-Aumento en La T EbullicionDocumento7 páginas4.1.-Aumento en La T EbullicionMorux RanflaAún no hay calificaciones
- Destilacion Fraccionada y SencillaDocumento6 páginasDestilacion Fraccionada y SencillaJuanka GonzalezAún no hay calificaciones
- Práctica 5 "DETERMINACIÓN DEL PUNTO EUTÉCTICO SIMPLE."Documento14 páginasPráctica 5 "DETERMINACIÓN DEL PUNTO EUTÉCTICO SIMPLE."David RamírezAún no hay calificaciones
- Ejercicios Tema7Documento9 páginasEjercicios Tema7Ximena AcAún no hay calificaciones
- La Regla de La PalancaDocumento2 páginasLa Regla de La PalancaSebasAún no hay calificaciones
- CapilaridadDocumento4 páginasCapilaridadJhonatanLopezAún no hay calificaciones
- 4.8 Gibbs Duhem AplicacionDocumento18 páginas4.8 Gibbs Duhem AplicacionJose Demons Peña CarvajalAún no hay calificaciones
- Adsorción ResumenDocumento4 páginasAdsorción ResumenSantiagoAlcantaraAún no hay calificaciones
- Reporte de Laboratorio Practica 1Documento4 páginasReporte de Laboratorio Practica 1Luís LópezAún no hay calificaciones
- Practica 9 Diagrama de Fases 1Documento5 páginasPractica 9 Diagrama de Fases 1grecia martinez ortizAún no hay calificaciones
- 1 - Sustancias PurasDocumento26 páginas1 - Sustancias PurasAdrianaCastilloAún no hay calificaciones
- Edoc - Pub - Combustion Ucsm 2010 CFB PDFDocumento110 páginasEdoc - Pub - Combustion Ucsm 2010 CFB PDFANTHONY PERCY INGA HUANCAAún no hay calificaciones
- Movimiento AmortiguadoDocumento8 páginasMovimiento AmortiguadoGuillermo CanataAún no hay calificaciones
- Reducción de Ácidos CarboxílicosDocumento17 páginasReducción de Ácidos CarboxílicosJorge Mario Fernandez PeñaAún no hay calificaciones
- Cap IiDocumento30 páginasCap Iicarlos100% (1)
- Corrosión en Tope de Columna de Destilación III PDFDocumento8 páginasCorrosión en Tope de Columna de Destilación III PDFEdgar HuancaAún no hay calificaciones
- Limites de Solubilidad FinalDocumento14 páginasLimites de Solubilidad FinalYahir AraizaAún no hay calificaciones
- Limites de Solubilidad FinalDocumento14 páginasLimites de Solubilidad FinalJohn BCAún no hay calificaciones
- La SolubilidadDocumento8 páginasLa SolubilidadBELGICA CHIRINOSAún no hay calificaciones
- 1.8. Medios de Información de SiahoDocumento5 páginas1.8. Medios de Información de SiahoWilliamsGerardoRondonAún no hay calificaciones
- Formato de Divulgación de La Política SIAHODocumento2 páginasFormato de Divulgación de La Política SIAHOWilliamsGerardoRondonAún no hay calificaciones
- 1.4 Objetivos, Metas e Indicadores de DesempeñoDocumento2 páginas1.4 Objetivos, Metas e Indicadores de DesempeñoWilliamsGerardoRondonAún no hay calificaciones
- Política de Seguridad IndustrialDocumento4 páginasPolítica de Seguridad IndustrialWilliamsGerardoRondonAún no hay calificaciones
- Un Espejo Esférico Es Aquel Cuya Superficie Tiene Un Radio de CurvaturaDocumento4 páginasUn Espejo Esférico Es Aquel Cuya Superficie Tiene Un Radio de CurvaturaWilliamsGerardoRondonAún no hay calificaciones
- Rutina Masa Muscular 5 DiasDocumento1 páginaRutina Masa Muscular 5 Diasbetukon23100% (2)
- Practica 5 Manejo de CompasDocumento1 páginaPractica 5 Manejo de CompasWilliamsGerardoRondonAún no hay calificaciones
- Microbiología de Los AlimentosDocumento27 páginasMicrobiología de Los Alimentosfedegarcia19Aún no hay calificaciones
- Ambi Aromas 65811 R 696 PDocumento119 páginasAmbi Aromas 65811 R 696 PdrmiglasAún no hay calificaciones
- Macroestructuras de AtomosDocumento3 páginasMacroestructuras de Atomosjorge nogalesAún no hay calificaciones
- MSDS - 049 Barniz Aislante SprayDocumento5 páginasMSDS - 049 Barniz Aislante SprayRaúl AvilaAún no hay calificaciones
- E18 4861-EspDocumento38 páginasE18 4861-EspMariela Belén100% (2)
- Tension en Una CuerdaDocumento14 páginasTension en Una CuerdajorgeAún no hay calificaciones
- Calculo EstacionamientoDocumento60 páginasCalculo EstacionamientomartinbagoAún no hay calificaciones
- QUI - 113 (Completa)Documento204 páginasQUI - 113 (Completa)Soy Guaricanero50% (2)
- Cuestionario Unidad 5-Ciclo RankineDocumento6 páginasCuestionario Unidad 5-Ciclo RankineOscar Andrade100% (2)
- Ablandamiento Por Zeolita de SodioDocumento12 páginasAblandamiento Por Zeolita de SodioSony GomezAún no hay calificaciones
- Química Orgánica (II)Documento81 páginasQuímica Orgánica (II)Gaby YepezAún no hay calificaciones
- Zocalo y ContrazocaloDocumento25 páginasZocalo y Contrazocaloleonardo100% (1)
- Practica AsfaltosDocumento16 páginasPractica AsfaltosCC FernandaAún no hay calificaciones
- Albiol Impactos SojizacionDocumento30 páginasAlbiol Impactos SojizacionMamunia MorrocoAún no hay calificaciones
- ETANODocumento5 páginasETANOAlejandra PerezAún no hay calificaciones
- Chancado y TamizadoDocumento20 páginasChancado y TamizadoChristopher JacksonAún no hay calificaciones
- Proyecto - Casetas ComunalesDocumento21 páginasProyecto - Casetas Comunalesmarlon acostaAún no hay calificaciones
- Mapa Conceptual - Oparin - FNLSNTDocumento1 páginaMapa Conceptual - Oparin - FNLSNTOkuverAún no hay calificaciones
- Reporte Fisicoquímica 3 1Documento10 páginasReporte Fisicoquímica 3 1tenoch lopezAún no hay calificaciones
- Informe Final Patologia EstructuralDocumento37 páginasInforme Final Patologia EstructuralDanilo Portilla91% (11)
- Practica-Instrumental 1-1Documento12 páginasPractica-Instrumental 1-1Cristian PintaAún no hay calificaciones
- Proyecto Tabla PeriodicaDocumento256 páginasProyecto Tabla PeriodicaPadilla MostAún no hay calificaciones
- A 211 PDFDocumento17 páginasA 211 PDFErica HenryAún no hay calificaciones
- Lab Fisico Quimica 1Documento8 páginasLab Fisico Quimica 1Rex 14Aún no hay calificaciones
- Contaminación Ambiental (Tipos)Documento3 páginasContaminación Ambiental (Tipos)Karla Calderon Ascencio100% (2)
- Costos de SoldaduraDocumento17 páginasCostos de SoldaduraRicardo VladimirAún no hay calificaciones
- Azucar 2019Documento25 páginasAzucar 2019Reynaldo Carlos MendozaAún no hay calificaciones
- OTM II Planta Etanol RMGDocumento14 páginasOTM II Planta Etanol RMGHuguiito RcAún no hay calificaciones
- Qué Es La Química OrgánicaDocumento5 páginasQué Es La Química Orgánicaana mejiaAún no hay calificaciones
- INTRODUCCION LentesDocumento2 páginasINTRODUCCION LentesJiannmarcos Córdova PérezAún no hay calificaciones