Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Química - Reg 9 - Soluciones
Cargado por
rachel.azul12pDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Química - Reg 9 - Soluciones
Cargado por
rachel.azul12pCopyright:
Formatos disponibles
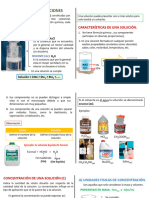
REGULAR 6
Soluciones
I. DEFINICIÓN 2. Solución concentrada
• Son mezclas homogéneas formadas Es aquella donde falta poco soluto
por uno o más solutos y un solvente. para alcanzar la saturación.
• El solvente es el que se encuentra Ejemplo:
en mayor proporción y es el que Masa
determina el estado de agregación Sto = NaHCO3 6,5 g
física de la solución.
Ste = H2O 100 g
• El soluto es la sustancia que está en
T = 20 °C Sol
menor proporción y es de quién de-
pende el nombre y la concentración
3. Solución saturada
de la solución.
Es aquella que contiene la máxima
cantidad de soluto disuelto a una
Ejemplo:
determinada temperatura.
Solución de "salmuera", será:
Ejemplo:
Masa
Soluto = Sto ⇒ NaC Sto = NaHCO3 9,5 g
Solvente = Ste ⇒ H2O Ste = H2O 100 g
T = 20 °C Sol
Luego:
4. Solución sobresaturada
Solución = Soluto + Solvente Es aquella que admite un exce-
dente de la máxima cantidad de
soluto disuelto en el solvente. El
Salmuera NaC H2O excedente puede ser disuelto en
"baño maría".
II. CLASIFICACIÓN DE SOLUCIONES Ejemplo:
Masa
A. POR LA CONCENTRACIÓN DE Sto = NaHCO3 11 g
SOLUTO
Ste = H2O 100 g
1. Solución diluida T = 20 °C Sol
El soluto se encuentra en una
pequeña cantidad. B. POR LA DISGREGACIÓN DEL SO-
LUTO
Ejemplo:
1. Solución iónica
Masa El soluto de esta solución se di-
Sto = NaHCO3 0,2 g
socia o se ioniza por lo cual estas
Ste = H2O 1,00 g soluciones son "conductoras" de la
T = 20 °C Sol electricidad.
QUÍMICA SAN MARCOS INTENSIVO 2023 - III 1
Soluciones
Ejemplo:
REGULAR 6
Salmuera (Cloruro de sodio, NaC, disuelto en agua).
2. Solución molecular
El soluto de esta solución se disgrega a nivel molecular; por lo cual estas soluciones son
"no conductoras" de la electricidad, no forma iones.
Ejemplo:
Azúcar común (Sacarosa, C12H22O11) disuelta en agua.
C. POR ESTADO DE AGREGACIÓN FÍSICA DEL SOLVENTE
Selección Solvente Soluto Ejemplo
Acero (C + Fe)
Sólido Latón (Zn + Cu)
Bronce (Sn + Cu)
Sólido Sólido
Amalgama de oro
Líquido
(Hg + Au)
Gaseoso Oclusión de H2 en Pt
Salmuera (NaC + H2O)
Sólido Alcohol iodado
(I2 + C2H5OH)
Vinagre (CH3COOH + H2O)
Aguardiente
(CH3CH2OH + H2O)
Líquido Líquido
Líquido etanol
Agua oxigenada
(H2O2 + H2O)
Agua regla (HC + HNO3)
Agua carbonatada
Gaseoso
(CO2 + H2O)
Gaseoso Gaseoso Gaseoso Aire seco (N2, O2, Ar, ...)
III. UNIDADES FÍSICAS DE CON- msto = masa del sto
mste = masa del ste
CENTRACIÓN
msol = masa de la solución
A. PORCENTAJE EN MASA(% MSTO)
B. PORCENTAJE EN VOLUMEN (% VSTO)
Indica la masa del soluto disuelto en Indica el volumen de soluto disuelto
100 g de solución: en un litro de solución.
msto vsto
% msto = × 100% % msto = × 100%
msol vsol
donde: msol = msol + mste donde: vsol = vsol + vste
2 SAN MARCOS INTENSIVO 2023 - III QUÍMICA
Soluciones
vsto = masa del soluto Donde:
REGULAR 6
vste = masa del solvente msto = masa en "mg" del soluto
vsol = masa de la solución vsol = volumen en "L" de la solución
Además: 1 g = 103 mg
C. PARTES POR MILLÓN (PPM)
Ejemplo:
Indica el número de miligramos (mg)
Si 0,50 L de una disolución acuosa con-
de soluto por litro (L) de solución.
tiene 4,4 mg de ión cloruro. ¿Cuántos
Un ppm es lo mismo que 1 gramo de
ppm de iones cloruro contienen?
soluto en un millón de centímetros
cúbicos de disolución.
Solución:
msto m 4,4 mg mg
ppm = ppm = ⇒ ppm = = 8,8
vsol v 0,50 L L
8,8 partes por millón de ión cloruro.
IV. DETERMINACIÓN DEL PARÁMETRO "q"
Sustancia q Ejemplo
HC → q = 1
# de "H" susti-
Ácido H2SO4 → q = 2
tuibles
H3PO4 → q = 3
K(OH) → q = 1
# de "(OH)"
Base o hidróxido Ba(OH)2 → q = 2
sustituibles
A(OH)3 → q = 3
+1 –1
Carga neta del Na1 C → q = (1)(+1) = 1
Sal
catión +1 –1
(NH4)1 C → q = 1(+1) = 1
7+ 2+
Agente oxidante # e– ganados Mn → Mn ⇒ q = 5
1– 0
Agente oxidante # e– perdidos 2C → C2 ⇒ q = 2
V. UNIDADES QUÍMICAS DE Como:
CONCENTRACIÓN m msto
n= ⇒ M=
A. MOLARIDAD (M) M Msol · vsol
Es el número de moles de soluto di-
suelto en un litro de solución. en función de Msto y msto.
nsto Además:
M=
vsol Dsol = densidad de la solución en g/mL
%m = porcentaje de masa.
mol
Unidades: < > molar Msto = masa molar del soluto (g/mol)
L
QUÍMICA SAN MARCOS INTENSIVO 2023 - III 3
Soluciones
(10)(%m)(Dsol) Xsto + Xste = 1
REGULAR 6
⇒ M=
Msol
nsol = nsto = nste
B. NORMALIDAD (N)
Es el número de equivalentes gramos
(Eq-g) de soluto disuelto en un litro
VI. APLICACIONES DE LAS UNI-
de solución.
DADES DE CONCENTRACIÓN
#Eq – gsto
N= A. DILUCIÓN DE UNA SOLUCIÓN
vsol
Es el procedimiento que se usa para
preparar soluciones de baja concen-
eq – g tración a partir de soluciones muy
Unidades < > normal
L concentradas.
También se cumple: El proceso consiste en añadir agua
a una solución de alta concentración
⇒ N=M×q (relación entre nor-
hasta alcanzar la concentración de-
malidad y molaridad) seada.
Donde "q" es el parámetro mide la
capacidad de reacción y depende del
soluto.
H2O
C. MOLALIDAD (M)
Es el número de moles de soluto
disuelto en 1 kilogramo de solvente. V1 VH O =x
2
nsto
msto = C1
wste
mol
Unidades < > molal
kg
donde: Wste: peso o masa del solvente
en kg.
También se cumple: V2 = V1 + x
1000(%msto)
m=
(100 – %msto) · Msto C2
nsto1 = nsto2
D. FRACCIÓN MOLAR (X)
n n
Xsto = sto ; Xste = ste Se cumple que: C1 · V1 = C2 · V2
nsol nsol
Para soluciones gaseosas o líquidas Donde: C = concentración molar o
volátiles donde: normal.
4 SAN MARCOS INTENSIVO 2023 - III QUÍMICA
Soluciones
B. MEZCLA DE SOLUCIONES Se cumple que:
REGULAR 6
nsto1 + nsto2 = nsto3
Se obtienen al unir dos o más solu-
ciones de un mismo soluto, pero de C1 · V1 + C2 · V2 = C3 · V3
concentraciones diferentes.
C. NEUTRALIZACIÓN
Es una reacción entre un ácido y una
base, formándose como producto sal
+
V1 V2 y agua.
C2 C2
Ácido, HC(ac)
Base, NaOH(ac)
V3 = V1 + V2 Cumpliéndose:
# Eq – g (Ácido) = # Eq – g (Base)
C3 NÁcido · VÁcido = NBase · VBase
PROBLEMAS PROPUESTOS
1. Respecto a las soluciones indicar verdadero 2. ¿Qué masa de agua será necesario para
(V) o falso (F), según sea conveniente: preparar una solución al 5% en masa, a
I. Se denominan también mezclas homo- partir de 12 g de cloruro de sodio?
A) 128 g B) 228 g
géneas, presentan además sólo una
C) 328 g D) 428 g
fase.
E) 543 g
II. Necesariamente el soluto debe disolver-
se en el solvente, habiendo entre ellos 3. En 500 g de agua caliente está disuelto
gran afinidad. 1,4 kg de azúcar, luego enfriamos hasta
III. El soluto da las propiedades químicas 50 °C. Determine la masa de azúcar que
a la solución. precipita.
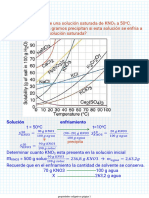
IV. Los componentes de una solución se Dato: Solubilidad del azúcar a 50 °C es 260.
A) 100 g B) 200 g
pueden separar por métodos físicos.
C) 300 g D) 400 g
V. La solubilidad de sólidos en líquidos,
E) 500 g
generalmente aumenta a medida que
aumenta la temperatura. 4. Se prepara una disolución añadiendo 184 g
A) VVVVF B) FVVFV de etanol (C2H5OH) cuya densidad es 0,8 g/mL
C) VVVVV D) FVFVF a 144 g de agua. Determine el porcentaje
E) VFVFV volumétrico de alcohol en la solución.
QUÍMICA SAN MARCOS INTENSIVO 2023 - III 5
Soluciones
A) 28,3% B) 31,7% 8. Se considera que las personas sufren de
REGULAR 6
C) 48,6% D) 61,5% envenenamiento por plomo si tienen una
E) 30,3% concentración mayor de 10 microgramos de
plomo por decilitro de sangre. Al respecto,
5. Calcular la cantidad en gramos de NaOH determine la concentración dada en ppm.
que se necesita para preparar 5 L de una UNMSM-CENTRO PREUNIVERSITARIO
solución 0,1 M. Ciclo 2020-I
A) 40 B) 20 A) 1,0 × 101
B) 1,0 × 100
C) 30 D) 36
C) 1,0 × 10–1
E) 50
D) 1,0 × 10–2
E) 1,0 × 10–3
6. Un sistema disperso se define como cual-
quier medio homogéneo que contiene
9. El peso equivalente de una sustancia
diseminadas en su interior partículas de
es aquel que participa en una reacción
cualquier tamaño y estado. Al respecto,
química, y se utiliza como base para una
seleccione el valor de verdad (V o F) de las
titulación. Aunque su definición depende
siguientes proposiciones. del tipo de reacción que se lleve a cabo. Al
I. En las suspensiones, la fase dispersa respecto, determine la sustancia que tiene
se puede separar por filtración. menor peso equivalente. Datos: (g/mol)
II. Los coloides son considerados disper- Na2SO4 = 142; NaC = 58,5; H2SO4 = 98;
siones homogéneas. NaOH = 40; HNO3 = 63
III. El tamaño de partículas de la fase dis- UNMSM-CENTRO PREUNIVERSITARIO
persa de un coloide es mayor a la de Ciclo 2020-I
una solución. A) Na2SO4 B) NaC
UNMSM-CENTRO PREUNIVERSITARIO C) H2SO4 D) NaOH
Ciclo 2020-I E) HNO3
A) VVV B) VVF
C) FFF D) VFV 10. El fosfato de sodio (Na3PO4) se utiliza como
E) FVF aditivo alimentario, principalmente como
estabilizante. Si se prepara una solución
7. El ácido sulfúrico (H2SO4) se utiliza en la disolviendo 32,8 g de fosfato de sodio, en
fabricación de fertilizantes, pigmentos, agua hasta obtener 400 mL de solución.
Determine la molaridad y normalidad res-
explosivos, entre otros. Si se tiene 500 mL
pectivamente para dicha solución.
de una solución de ácido al 10 % en masa,
Datos: masa molar (g/mol) Na3PO4 = 164
determine la concentración de la solución
UNMSM-CENTRO PREUNIVERSITARIO
en %m/v. d(solución) = 1,07 g/mL
Ciclo 2020-I
UNMSM-CENTRO PREUNIVERSITARIO
A) 0,25 – 0,75
Ciclo 2020-I
B) 1,50 – 4,50
A) 11,0 B) 10,7
C) 0,50 – 1,50
C) 10,2 D) 10,0
D) 1,00 – 3,00
E) 1,07 E) 2,00 – 2,50
6 SAN MARCOS INTENSIVO 2023 - III QUÍMICA
Soluciones
11. El ácido clorhídrico se utiliza para procesar Al respecto, seleccione la alternativa correcta.
REGULAR 6
una variedad de productos alimenticios, UNMSM-CENTRO PREUNIVERSITARIO
como jarabes de maíz, galletas, kétchup, Ciclo 2020-I
cereales, entre otros. Si este ácido, en su A) El número de equivalentes del ácido es
forma comercial, tiene una concentración 5,0 × 10–2.
de 12 M. Determine, respectivamente, el B) El número de equivalentes de la base
volumen, en L, de solución concentrada es 7,5 × 10–3.
y de agua que se necesita para preparar
C) La cantidad de sal que se forma es de
200 mL de solución de HC 1,5 M.
7,5 × 10–2.
UNMSM-CENTRO PREUNIVERSITARIO
D) La solución resultante tiene un pH
Ciclo 2020-I
mayor a 7.
A) 0,150 – 0,050
E) La solución tiene un POH mayor a 7.
B) 0,050 – 0,150
C) 0,075 – 0,125
14. El metanol se utiliza como disolvente indus-
D) 0,025 – 0,175 trial, anticongelante en vehículos, combus-
E) 0,035 – 0,254 tible, entre otros. Se preparan 1 264 mL de
solución que contiene 64 mL de metanol Al
12. La solución diluida de NaOH se utiliza para respecto, seleccione el valor de verdad (V
producir margarina y también para elaborar o F) de las siguientes proposiciones.
el lutefisk, comida tradicional de los países (Datos: masa molar(g/mol) CH3OH = 32;
nórdicos a base de pescado. Si se mezclan ρ(g/mL) CH3OH = 0,79)
500 mL de solución que contiene 1 g de UNMSM-CENTRO PREUNIVERSITARIO
Ciclo 2020-I
NaOH con 500 mL de otra solución de 0,04 M.
I. El porcentaje en volumen de la solución
Al respecto, determine la molaridad de la
es 4,00 %.
solución resultante.
II. El porcentaje masa en volumen de la
(Datos: (g/mol) NaOH = 40)
solución es 5,00 %.
Datos: masa molar (g/mol) Na3PO4 = 164 III. La molaridad de la solución es 1,25 M.
UNMSM-CENTRO PREUNIVERSITARIO A) VFF B) VFV
Ciclo 2020-I C) VVV D) FFV
A) 5,0 × 10–2 E) FVF
B) 2,5 × 10–2
C) 4,5 × 10–2 15. El cloruro de calcio (CaC2) es una sal que se
D) 3,5 × 10–2 utiliza en el agua de piscinas como tampón
E) 5,5 × 10–2 del pH y para ajustar la dureza del agua. Si
se prepara una solución mezclando 333 g
de esta sal con 2027 g de agua. Determine,
13. Las sales se obtienen de diversas formas,
respectivamente, la molaridad y normalidad
una de ellas es por la reacción de un ácido
de la solución.
con una base. Si reacciona 50 mL HC
(Datos: masa molar(g/mol) sal = 111;
0,1 M con 75 mL de NaOH 1,0 N según la ρsolución = 1,18 g/mL)
reacción: UNMSM-CENTRO PREUNIVERSITARIO
NaOH(ac) + HC(ac) → NaC(ac) + H2O() Ciclo 2020-I
QUÍMICA SAN MARCOS INTENSIVO 2023 - III 7
Soluciones
A) 1,0 – 2,0 B) 1,5 – 3,0 18. El ácido acético (CH3COOH) se suele em-
REGULAR 6
C) 0,5 – 1,0 D) 2,0 – 4,0 plear en apicultura para el control de larvas
E) 1,5 – 2,5 y huevos de polillas de la cera. Calcule el
volumen, en mL, de solución de hidróxido
16. El ácido sulfúrico (H2SO4) se utiliza en de potasio (KOH) 0,15 M necesario para
la refinación del petróleo, producción de reaccionar con 3,6 g de ácido acético,
pigmentos, tratamiento del acero, entre (CH3COOH), según la reacción:
otros. Si se dispone de ácido comercial que KOH + CH3COOH → CH3COOK + H2O
tiene una concentración de 18 M. Calcule el Datos: (g/mol) CH3COOH = 60
volumen de ácido concentrado, en mL que UNMSM-CENTRO PREUNIVERSITARIO
se necesita para preparar 2 L de solución Ciclo 2020-I
de H2SO4 0,45 M. A) 400 B) 300
UNMSM-CENTRO PREUNIVERSITARIO
C) 200 D) 500
Ciclo 2020-I
E) 450
A) 60 B) 45
C) 50 D) 25
19. Los sistemas dispersos son cuerpos ma-
E) 30
teriales donde una o más sustancias (fase
dispersa) se encuentran disgregadas o
17. El nitrato de bario (Ba(NO3)2) se utiliza para
dispersadas en el interior de otra (fase
controlar las emisiones de contaminantes
dispersante).
generados por la combustión de motores
Según el tamaño de las partículas de la
diesel, así como de turbinas de gas. Este
fase dispersa, estos sistemas pueden ser:
compuesto se puede obtener por la reacción
suspensiones, coloides o soluciones. Al res-
de hidróxido de bario y ácido nítrico según
pecto, indique la alternativa que contenga
la reacción:
el enunciado correcto.
2HNO3(ac) + Ba(OH)2(ac) → Ba(NO3)2(ac) +
UNMSM-CENTRO PREUNIVERSITARIO
2H2O()
Ciclo 2019-II
Si se agrega 50 mL de solución de
A) Si las partículas de un sistema disperso
H N O 3 1,5 M a 50 mL de solución de
Ba(OH)2 3,0 M. Seleccione el valor de ver- sedimentan, entonces el sistema dis-
dad (V o F) de los siguientes enunciados. perso es un coloide.
I. El número de eq – g del ácido es B) El soluto determina el estado físico de
7,5 × 10–2. una solución.
II. El número de eq – g de la base es C) Son ejemplos de dispersiones coloida-
3,0 × 10–1. les: leche, gelatina, espuma de rasurar
III. El pH de la solución resultante es menor y acero.
a 7. D) Las partículas de la fase dispersa de la
UNMSM-CENTRO PREUNIVERSITARIO niebla poseen mayor tamaño que las
Ciclo 2020-I partículas de la salmuera.
A) VVF B) FFF E) En un sistema disperso la fase dispersa
C) VVV D) FFV es la parte que contiene a la fase dis-
E) VFV persante.
8 SAN MARCOS INTENSIVO 2023 - III QUÍMICA
Soluciones
20. El acetonitrilo, CH3CN, es un disolvente II. El porcentaje en peso / volumen de la
REGULAR 6
orgánico polar que disuelve un gran número solución es 1,56 %.
de solutos, incluyendo muchas sales como III. Al extraer 0,25 L de solución, la concen-
por ejemplo el bromuro de litio, LiBr. Se tración %W de la solución remanente
disuelven 78 g de esta sal en suficiente se reduce a la mitad.
cantidad de acetonitrilo hasta obtener UNMSM-CENTRO PREUNIVERSITARIO
0,5 L de solución. Determine el valor de Ciclo 2019-II
verdad (V o F) de los siguientes enunciados A) VFV
si se sabe que la densidad de la solución B) FVF
formada es 0,826 g /mL. C) VFF
I. El porcentaje en peso de la solución es D) FFF
18,88 %. E) FFV
QUÍMICA SAN MARCOS INTENSIVO 2023 - III 9
También podría gustarte
- Informe de Laboratorio Semana 5Documento9 páginasInforme de Laboratorio Semana 5Brandon EspinozaAún no hay calificaciones
- La Soluciones y Su Clasificación para Cuarto Grado de SecundariaDocumento4 páginasLa Soluciones y Su Clasificación para Cuarto Grado de SecundariaAnthony Zamora100% (2)
- Floculacion y Dispersion de Los Suelos AgricolasDocumento15 páginasFloculacion y Dispersion de Los Suelos AgricolasLISSET REGINA RODRIGUEZ POLANCO100% (2)
- Teoría de Las SolucionesDocumento4 páginasTeoría de Las SolucionesPau ParedesAún no hay calificaciones
- Taller en Casa Grado Noveno SolucionesDocumento6 páginasTaller en Casa Grado Noveno SolucionesLeonardo AtayaAún no hay calificaciones
- Química - SolucionesDocumento6 páginasQuímica - SolucionesKevin Espinoza GuzmanAún no hay calificaciones
- Soluciones Primero SecundariaDocumento4 páginasSoluciones Primero SecundariaGina CubillasAún no hay calificaciones
- Soluciones Quimicas 4toDocumento3 páginasSoluciones Quimicas 4toromina villadaAún no hay calificaciones
- Teoria de Soluciones para Quinto Grado de SecundariaDocumento5 páginasTeoria de Soluciones para Quinto Grado de SecundariaCynthia Chinga OlayaAún no hay calificaciones
- Teoría de Las Soluciones para Quinto Grado de SecundariaDocumento4 páginasTeoría de Las Soluciones para Quinto Grado de SecundariaAdrián Carlos Tomairo RojasAún no hay calificaciones
- Teoría de Las SolucionesDocumento4 páginasTeoría de Las SolucionesGrace VaronaAún no hay calificaciones
- Tema 01 SolucionesDocumento6 páginasTema 01 SolucionesEdwis Castañeda Velásquez100% (1)
- Soluciones UNMSM. 1 PDFDocumento56 páginasSoluciones UNMSM. 1 PDFRosmeri delgado guerreroAún no hay calificaciones
- Soluciones IDocumento5 páginasSoluciones IOlenkaAún no hay calificaciones
- Pract - Quimica Sem 8 - Intensivo 2022Documento5 páginasPract - Quimica Sem 8 - Intensivo 2022Yazmin ChavezAún no hay calificaciones
- Semana 9 QuimicaDocumento4 páginasSemana 9 QuimicaMichael Owen Claros SalambayAún no hay calificaciones
- Soluciones Química - QuímicaDocumento5 páginasSoluciones Química - QuímicaDorisNoeliaNúñezBeniqueAún no hay calificaciones
- 8004d61663468445la Soluciones y Su Clasificación para Cuarto Grado 220917 212527Documento4 páginas8004d61663468445la Soluciones y Su Clasificación para Cuarto Grado 220917 212527Lucero Cabrera AguinagaAún no hay calificaciones
- La Soluciones y Su Clasificación para Cuarto Grado de SecundariaDocumento4 páginasLa Soluciones y Su Clasificación para Cuarto Grado de Secundariavali100% (1)
- S13 SolucionesDocumento19 páginasS13 SolucionesLuis FernandoAún no hay calificaciones
- SESION 8-Propiedades de Los Líquidos.Documento25 páginasSESION 8-Propiedades de Los Líquidos.Gabriel Armando Orellana NolascoAún no hay calificaciones
- Disoluciones Ejercicios de La GuiaDocumento7 páginasDisoluciones Ejercicios de La GuiaLia CastilloAún no hay calificaciones
- Soluciones para Cuarto de SecundariaDocumento10 páginasSoluciones para Cuarto de SecundariaEduardopitecus Boeykensis0% (1)
- ACFrOgAjAmmYsoZf8k8J7lEs - w9FxVHTeGB2X-s71O-PBtbi7bNL4Wy3aRjPwKwooZMvbyZz21t SgLS3 O8BwxC1O9KnMZqQ0efLvBupH1NJJKc6EAZmvytGsl4wJy0qIJxP5gna27XgQVQjN4Documento39 páginasACFrOgAjAmmYsoZf8k8J7lEs - w9FxVHTeGB2X-s71O-PBtbi7bNL4Wy3aRjPwKwooZMvbyZz21t SgLS3 O8BwxC1O9KnMZqQ0efLvBupH1NJJKc6EAZmvytGsl4wJy0qIJxP5gna27XgQVQjN4Alfaro Barrientos Diego MaximilianoAún no hay calificaciones
- C.mayor 2023 - Tema 17 - SolucionesDocumento23 páginasC.mayor 2023 - Tema 17 - SolucionesValentina CastilloAún no hay calificaciones
- Copia de SOLUCIONES LO MAXIMODocumento5 páginasCopia de SOLUCIONES LO MAXIMOCondor Anaya EzequiasAún no hay calificaciones
- Clase 11 TeoríaDocumento8 páginasClase 11 TeoríaarianalimasAún no hay calificaciones
- S13.1 - SolucionesDocumento35 páginasS13.1 - SolucionesLuis Nicolas Jimenez ChungaAún no hay calificaciones
- 7 - Quim - 5° PRE - Cap14 - 2021Documento9 páginas7 - Quim - 5° PRE - Cap14 - 2021Abel CarpioAún no hay calificaciones
- PDF Capitulo Preparacion de Disoluciones Acuosas - CompressDocumento11 páginasPDF Capitulo Preparacion de Disoluciones Acuosas - CompressJRAún no hay calificaciones
- Soluciones - QuímicaDocumento6 páginasSoluciones - QuímicaLorena PerezAún no hay calificaciones
- PREPARACIÓN DE SOLUCIONES QcaGeneralDocumento12 páginasPREPARACIÓN DE SOLUCIONES QcaGeneralCandyRojasAún no hay calificaciones
- Clase 3.1Documento30 páginasClase 3.1Nicole BarrionuevoAún no hay calificaciones
- Laboratorio Principios TeoricosDocumento6 páginasLaboratorio Principios Teoricosabcdefghijklmnp100% (1)
- Unidad 5 - SOLUCIONESDocumento16 páginasUnidad 5 - SOLUCIONESMiguel Gomez MacielAún no hay calificaciones
- Clase 5 - SolucionesDocumento21 páginasClase 5 - Solucioneslazaroleonjesus7777Aún no hay calificaciones
- CLASE 9 - DisolucionesDocumento43 páginasCLASE 9 - DisolucionesMarcelo VissaniAún no hay calificaciones
- Teoria Soluciones Quimicas Area Ab Cepunt 2021-IIDocumento5 páginasTeoria Soluciones Quimicas Area Ab Cepunt 2021-IIJose Paredes FloreanoAún no hay calificaciones
- Química EscolarDocumento5 páginasQuímica EscolarRafael Matencio GerónimoAún no hay calificaciones
- Propiedades Coligativas 1Documento20 páginasPropiedades Coligativas 1Gatita Cristhel CAún no hay calificaciones
- Para Que Dos Sustancias Puedan Formar Una Solución MiscibleDocumento10 páginasPara Que Dos Sustancias Puedan Formar Una Solución Miscibleedgar lazo oblitasAún no hay calificaciones
- SOLUCIONES 2022 - Profesor GAVANCHODocumento30 páginasSOLUCIONES 2022 - Profesor GAVANCHODiego Sebastian Pumayalli CaceresAún no hay calificaciones
- Sem1 Soluciones QuimDocumento7 páginasSem1 Soluciones QuimRenzo DanielAún no hay calificaciones
- Poe N°6 - Soluciones QuimicasDocumento6 páginasPoe N°6 - Soluciones QuimicasJackAún no hay calificaciones
- Teoría SolucionesDocumento3 páginasTeoría SolucionesFabián Andrés QuinteroAún no hay calificaciones
- SolucionesDocumento3 páginasSolucionesCamilo Ramírez LópezAún no hay calificaciones
- m.1. DisolucionesDocumento45 páginasm.1. DisolucionesPedro ArroyoAún no hay calificaciones
- Semana 8 SolucionesDocumento20 páginasSemana 8 SolucionesJhon Espinoza100% (1)
- Propiedades ColigativasDocumento15 páginasPropiedades ColigativasmarialuisallamocaAún no hay calificaciones
- Repaso San Marcos - Química - Semana 5Documento7 páginasRepaso San Marcos - Química - Semana 5Alejandro Bonifacio SánchezAún no hay calificaciones
- DisolucionesDocumento39 páginasDisolucionesRoger Fernández50% (2)
- Soluciones - 5to de SecundariaDocumento8 páginasSoluciones - 5to de SecundariaWilder EfrainAún no hay calificaciones
- EJERCIOS Quimica IIDocumento6 páginasEJERCIOS Quimica IIMiguel PerezAún no hay calificaciones
- Práctica 1 de Fisicoquímica IIDocumento11 páginasPráctica 1 de Fisicoquímica IIRAUL ROJAS RAMOSAún no hay calificaciones
- QUI2MUNI2N1MAC Propiedades - ColigativasDocumento20 páginasQUI2MUNI2N1MAC Propiedades - ColigativasALEXANDER PAUL LIQUINCHANA MARTINEZAún no hay calificaciones
- Di Luci OnesDocumento12 páginasDi Luci OnesLuisSarmientoAún no hay calificaciones
- Apuntes de SolucionesDocumento11 páginasApuntes de SolucionesRoberto SantiagoAún no hay calificaciones
- Tema 2 SOLUCIONES IDocumento9 páginasTema 2 SOLUCIONES IPROFESOR ADOLFO RAMÓNAún no hay calificaciones
- Química: Soluciones IiDocumento28 páginasQuímica: Soluciones IiAngiely BuitrónAún no hay calificaciones
- 10 SolucionesDocumento17 páginas10 SolucionesRonaldo0% (1)
- Informe 1 Lab 1. Med. TemperaturaDocumento19 páginasInforme 1 Lab 1. Med. TemperaturaLeandro David Paravia PomontiAún no hay calificaciones
- Sesion 7 Recursos Naturales IvDocumento6 páginasSesion 7 Recursos Naturales IvGlisseth LizanoAún no hay calificaciones
- IR PROYECTO 100622 AvendañoHernándezJeshuaJosephDocumento32 páginasIR PROYECTO 100622 AvendañoHernándezJeshuaJosephJeshua HernándezAún no hay calificaciones
- SECCION B - Silabo Qumica Inorganica 2020 - II (11 NOV-2021)Documento19 páginasSECCION B - Silabo Qumica Inorganica 2020 - II (11 NOV-2021)Juan David Benites GarciaAún no hay calificaciones
- Electrocoagulacion TeoriaDocumento6 páginasElectrocoagulacion TeoriagabrielaAún no hay calificaciones
- U1-E 1-Vazquez Cuchillo OdilonDocumento4 páginasU1-E 1-Vazquez Cuchillo OdilonvicenteAún no hay calificaciones
- Las AletasDocumento6 páginasLas AletasRoberto García LópezAún no hay calificaciones
- PR 1ciclos RefrigeracionDocumento2 páginasPR 1ciclos RefrigeracionLuis Quesada PalaciosAún no hay calificaciones
- 4 Ejercicio Unidad IV2Documento10 páginas4 Ejercicio Unidad IV2Henrry SenaAún no hay calificaciones
- Tarea Semana 5 Felipe AguilarDocumento8 páginasTarea Semana 5 Felipe Aguilarfelipe palaciosAún no hay calificaciones
- Cuaderno de Texto QuimicaDocumento96 páginasCuaderno de Texto QuimicaSaara Aguilar VillavicencioAún no hay calificaciones
- 7 Adsorcion OKDocumento123 páginas7 Adsorcion OKRuberth Rivera PérezAún no hay calificaciones
- Gas NaturalDocumento25 páginasGas Naturalfrancocastillo51Aún no hay calificaciones
- Los Estados de Agregación y El Modelo de PartículasDocumento6 páginasLos Estados de Agregación y El Modelo de PartículasNestor Rodrigo GarciaAún no hay calificaciones
- Proyecto Socio Formativo Operaciones Unitarias 2Documento18 páginasProyecto Socio Formativo Operaciones Unitarias 2Marco Schwenk AlarconAún no hay calificaciones
- Redox - Equilibrio QuimicoDocumento21 páginasRedox - Equilibrio QuimicoMarco Antonio Ardila B0% (1)
- M1 - CombustiónDocumento24 páginasM1 - CombustiónAgustin RomanoAún no hay calificaciones
- Practica Calificada de Dureza 18-07-2021 - Revisión Del IntentoDocumento5 páginasPractica Calificada de Dureza 18-07-2021 - Revisión Del IntentoMartin S. Lopez MogrovejoAún no hay calificaciones
- Tarea No 2 Cinetica QuimicaumichDocumento34 páginasTarea No 2 Cinetica QuimicaumichJuan TorresAún no hay calificaciones
- ProgramaciónDocumento2 páginasProgramaciónBryan Steven González ArévaloAún no hay calificaciones
- Practica 7 - Determinacion de La Dureza Del AguaDocumento5 páginasPractica 7 - Determinacion de La Dureza Del AguaAnika Godoy KennedyAún no hay calificaciones
- Procedimiento de Preparación de AcroleínaDocumento8 páginasProcedimiento de Preparación de AcroleínaJuan Carlos CamaleAún no hay calificaciones
- Potenciometrias Directas 2020Documento21 páginasPotenciometrias Directas 2020el_nakuAún no hay calificaciones
- Tarea EspacialDocumento17 páginasTarea EspacialDiego OrbegosoAún no hay calificaciones
- Actividad 2 QUIMICADocumento3 páginasActividad 2 QUIMICAalexAún no hay calificaciones
- Disolvente ProtónicoDocumento20 páginasDisolvente ProtónicoNathaly OrantesAún no hay calificaciones
- TP Psicrometria 2-Jose BrusquettiDocumento2 páginasTP Psicrometria 2-Jose BrusquettiJosé Brusquetti100% (1)
- Modulo 1Documento27 páginasModulo 1claucresAún no hay calificaciones
- Alpha y BetaDocumento13 páginasAlpha y BetaLucho BetoAún no hay calificaciones