Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Hormonas Corticosuprarrenales
Cargado por
jyanes0 calificaciones0% encontró este documento útil (0 votos)
0 vistas7 páginasEste documento describe la fisiología de las hormonas corticosuprarrenales. La corteza suprarrenal secreta tres tipos de hormonas: mineralocorticoides como la aldosterona, glucocorticoides como el cortisol, y pequeñas cantidades de hormonas sexuales. La aldosterona regula el balance de sodio y potasio a través de la reabsorción de sodio y secreción de potasio en los riñones. El cortisol regula el metabolismo de carbohidratos, grasas y proteínas. La secreción de estas hormonas
Descripción original:
Título original
Hormonas corticosuprarrenales
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento describe la fisiología de las hormonas corticosuprarrenales. La corteza suprarrenal secreta tres tipos de hormonas: mineralocorticoides como la aldosterona, glucocorticoides como el cortisol, y pequeñas cantidades de hormonas sexuales. La aldosterona regula el balance de sodio y potasio a través de la reabsorción de sodio y secreción de potasio en los riñones. El cortisol regula el metabolismo de carbohidratos, grasas y proteínas. La secreción de estas hormonas
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
0 vistas7 páginasHormonas Corticosuprarrenales
Cargado por
jyanesEste documento describe la fisiología de las hormonas corticosuprarrenales. La corteza suprarrenal secreta tres tipos de hormonas: mineralocorticoides como la aldosterona, glucocorticoides como el cortisol, y pequeñas cantidades de hormonas sexuales. La aldosterona regula el balance de sodio y potasio a través de la reabsorción de sodio y secreción de potasio en los riñones. El cortisol regula el metabolismo de carbohidratos, grasas y proteínas. La secreción de estas hormonas
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 7
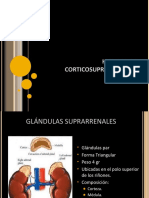
Hormonas corticosuprarrenales: La glándula suprarrenal tiene dos porciones, la médula y
la corteza, esta última secreta corticoesteroides, los cuales son:
● Mineralocorticoides: Relacionados al balance sodio-potasio
● Glucocorticoides: Modifican el metabolismo de CHOs, grasas y proteínas
● Hormonas sexuales: en su mayoría andrógenos débiles, relacionados a
características sexuales secundarias
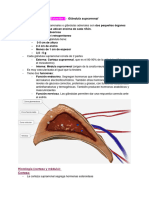
Química de la secreción corticosuprarrenal:
La corteza suprarrenal consta de 3 capas:
● Zona Glomerular (Externa): Lugar exclusivo de síntesis de la enzima aldosterona sintasa
→ El producto final de secreción principal de esta zona es la aldosterona, el
mineralocorticoide más importante.
La angiotensina II y el potasio son los principales reguladores de secreción de
aldosterona.
Las elevaciones crónicas de angiotensina II produce hipertrofia e hiperplasia de las
células de la zona glomerular
● Zona Fascicular (Intermedia): Secreta glucocorticoides
El cortisol es el principal glucocorticoide producido → Regulado principalmente por la
corticotropina (ACTH)
Por carencia de la 17-hidroxilasa (enzima) esta zona no produce cortisol ni
hormonas sexuales
También secretan pequeñas cantidades de hormonas sexuales
● Zona Reticular (Interna): Secreta hormonas sexuales y algunos glucocorticoides,
también es estimulada por la corticotropina (ACTH), el exceso de esta última da
hiperplasia e hipertrofia de las dos zonas internas de la corteza suprarrenal
Los andrógenos suprarrenales más prevalentes son la deshidroepiandrosterona y la
androstenodiona
Las hormonas corticosuprarrenales se sintetizan a partir del colesterol:
Casi todo el colesterol de las células corticosuprarrenales es captado de la circulación,
esterificado y almacenado en gotitas lipídicas.
Una vez el colesterol entra a la célula, se transporta a las mitocondrias, donde se rompe por la
colesterol desmolasa → Formando pregnenolona
Los reguladores de los principales productos hormonales (aldosterona y cortisol) estimulan
el paso inicial en la biosíntesis esteroidea en las tres zonas de la corteza.
La conversión del colesterol en pregnenolona y todas las etapas sucesivas de la síntesis de
hormonas corticosuprarrenales tienen lugar en el RE o en las mitocondrias.
Las hormonas corticosuprarrenales se transportan mediante proteínas plasmáticas:
90-95% del cortisol se une a las proteínas transportadoras del plasma, principalmente la
transcortina o globulina fijadora de los corticoesteroides.
El cortisol posee una semivida prolongada de 60-90 mins por su elevada unión a proteínas
plasmáticas.
La corticosterona se une en menor medida a estas proteínas que el cortisol, y su semivida
es 50 min aprox.
La aldosterona se liga todavía menos a proteínas plasmáticas y solo tiene 20 minutos de
semivida.
Las hormonas corticosuprarrenales se metabolizan en el hígado. El cortisol y la
aldosterona se metabolizan principalmente en el hígado y luego son conjugadas con
el ácido glucurónico: Estos conjugados inactivos se solubilizan fácil en el plasma y no se
unen a proteínas.
Una vez liberados a la circulación, se excretan fácilmente por la orina.
Funciones de los mineralocorticoides: Aldosterona
La aldosterona es el principal mineralocorticoide secretado por la corteza
suprarrenal: La aldosterona es el 90% de actividad mineralocorticoide de las hormonas
corticosuprarrenales.
Casi todo el resto de actividad se liga a:
● Desoxicorticosterona (3%)
● Cortisol: Tiene una gran afinidad por receptores mineralocorticoides, pese a ser un
glucocorticoide. No obstante, las células epiteliales renales expresan la enzima 11-
beta-hidroxiesteroide deshidrogenasa de tipo 2, que convierte el cortisol en
cortisona, la cual no puede unirse a los receptores mineralocorticoides.
La Aldosterona aumenta la reabsorción renal de sodio y la secreción de potasio: La
aldosterona y otros mineralocorticoides actúan sobre la porción distal de la nefrona, en
particular las células principales de los túbulos y conductos colectores, aumentando la
reabsorción de sodio y la secreción de potasio.
Estos efectos ocurren después de que la aldosterona se una a los receptores intracelulares
y se sinteticen las proteínas, incluida la adenosina trifosfatasa sodio-potasio de la
membrana basolateral y las proteínas de los canales de sodio y potasio en la membrana
apical.
Con el incremento de la ATPasa sodio-potasio, el sodio de las células tubulares es
bombeado a la sangre y se intercambia por potasio (Bomba sodio potasio ATPasa moment:)
Posteriormente, el potasio se difunde a la orina tubular.
El sodio se reabsorbe por efecto de la aldosterona, mientras que aumenta la secreción
tubular de iones potasio.
La aldosterona también estimula la secreción de iones hidrógeno (H+), que se intercambian
por sodio, en las células intercaladas de los túbulos colectores corticales.
Para que ocurran las acciones tubulares de la aldosterona se requiere la síntesis de
proteínas
Cuando se expone a la aldosterona, demora 1h en hacer efecto
La Aldosterona modifica el transporte de electrolitos en órganos distintos de los
riñones: La aldosterona se une a receptores mineralocorticoides de las células epiteliales
diferentes a los renales.
La aldosterona aumenta la reabsorción de sodio en el colon y fomenta la excreción de
potasio con las heces.
También reduce el cociente sodio/potasio en las secreciones de las glándulas sudoríparas y
salivales.
Reguladores de la secreción de aldosterona: angiotensina II y potasio:
La angiotensina II estimula la secreción de aldosterona: Estimula directamente las
células de la zona glomerular con el fin de secretar aldosterona.
El sistema renina-angiotensina se activa en presencia de hipovolemia e hipotensión, los
valores plasmáticos elevados de angiotensina II estimula la secreción de aldosterona.
A su vez, la aldosterona aumenta la reabsorción de sodio en la porción distal de la nefrona,
en cuanto la retención de líquidos restaura el volumen de líquidos corporales y la presión
arterial a la normalidad, desaparece el estímulo para la activación del sistema renina-
angiotensina y la secreción de aldosterona desciende.
En consecuencia, el sistema renina-angiotensina se relaciona de manera inversa con el
aporte dietético de sodio.
El potasio estimula la secreción de aldosterona: Las células de la zona glomerular son
sensibles a las pequeñas variaciones en la concentración plasmática de potasio (K+) y la
aldosterona elimina el potasio ingerido y regula (mediante retroalimentación) la
concentración plasmática de potasio.
Los aumentos en concentración plasmática de potasio (K+) elevan la secreción de
aldosterona, que a su vez, estimula la secreción tubular de potasio (K+).
Conforme la concentración plasmática de potasio disminuye hasta cifras normales, se
secreta menos aldosterona
La corticotropina ejerce una función permisiva en la regulación de la secreción de
aldosterona: Cuando disminuye la ACTH, disminuye la respuesta de la aldosterona a la
angiotensina II y al potasio.
Los niveles elevados de ACTH estimula secreción de aldosterona, no obstante, en estados
de exceso crónico (Enfermedad de Cushing) no hay hiperaldosteronismo
El aumento de la concentración de iones de sodio en el líquido extracelular reduce
ligeramente la secreción de aldosterona.
El aumento de péptido natriurético auricular (hormona secretada por el corazón) reduce la
secreción de aldosterona.
Funciones de los glucocorticoides:
El cortisol es el glucocorticoide principal secretado por la corteza suprarrenal: Sus
efectos están mediados por unión a receptores intracelulares de los tejidos diana y la
inducción o represión de la transcripción genética, alterando la síntesis de enzimas
reguladoras de la función celular.
Cortisol posee efectos sobre el metabolismo:
● Disminución de los depósitos de proteína de los tejidos extrahepáticos: El
cortisol reduce la captación de aminoácidos e impide la síntesis de proteínas en el músculo y
otros tejidos extrahepáticos, al mismo tiempo, aumenta la descomposición proteica →
Aumentando los aminoácidos en sangre, que van a ser captados por el hígado y transformados
en glucosa y proteínas, incluidas enzimas gluconeogénicas
● Tendencia al aumento de la glucosa en concentración sanguínea: El cortisol
aumenta la producción de glucosa, aumentando la gluconeogénesis.
Las proteínas, movilizadas desde los tejidos periféricos, se transforman dentro del
hígado en glucosa y glucógeno.
Al mantener las reservas de glucógeno, el cortisol hace que otras hormonas
glucolíticas, como la adrenalina y el glucagón, movilicen la glucosa en momentos
demandantes (entre comidas p.ej).
Otra vía por la que el cortisol aumenta la glucemia consiste en alterar la utilización
de la glucosa por tejidos periféricos, el cortisol es antiinsulinico en tejido muscular y
adiposo, alterando la capacidad y utilización energética de la glucosa.
Como sucede con la hormona del crecimiento, el cortisol puede ser diabetógena
porque incrementa la glucemia. (Glucosa en sangre)
● Movilización de ácidos grasos a partir del tejido adiposo: Valores normales de
cortisol ejercen un efecto permisivo de la movilización de ácidos grasos durante el
ayuno.
En estas condiciones, el cortisol permite a otras hormonas lipolíticas, como
adrenalina y hormona del crecimiento, movilizar ácidos grasos de los depósitos
lipídicos.
El aumento de la secreción de cortisol resulta importante para la resistencia al estrés:
El estrés físico o mental aumenta la secreción de ACTH que a su vez estimula la secreción
de cortisol por la corteza suprarrenal.
Regulación de la secreción de cortisol por la corticotropina:
La corticotropina estimula la secreción de cortisol: La secreción de cortisol esta sujeta
al eje hipotálamo-hipófisis: Hormona liberadora de corticotropina (CRH)-ACTH.
La liberación de corticotropina (ACTH) por la hipófisis depende de la CRH.
En cuanto se secreta ACTH a la sangre, actúa rápidamente sobre la zona fascicular principalmente,
pero también la reticular → Produciéndose un incremento en secreción de cortisol.
Este efecto de la ACTH se obtiene aumentando la conversión del colesterol hacia
pregnenolona y está mediado por el AMPc (Segundo mensajero).
La estimulación crónica de la corteza suprarrenal produce hipertrofia e hiperplasia de las
zonas fascicular y reticular, aumentando la síntesis de diversas enzimas que transforman el
colesterol en cortisol.
En estados de exceso crónico (síndrome de Cushing) se produce un incremento sostenido
en secreción de cortisol y andrógenos suprarrenales.
Las concentraciones sanguíneas de cortisol libre son controladas por feedback negativo con
la ACTH.
La secreción de cortisol alcanza el punto máximo en las primeras horas de la mañana y su punto
mínimo en las últimas de la tarde → Dado a que la ACTH posee un ritmo circadiano o diurno.
Estrés aumenta la secreción de corticotropina: Diversos factores físicos/mentales de
estrés estimulan las células neuroendocrinas del hipotálamo para que secreten CRH,
resultando en un aumento en la secreción de la ACTH, que estimula la liberación del
cortisol.
En los estados de estrés, el efecto inhibidor del cortisol sobre la secreción de ACTH no
basta para contrarrestar las células que fomentan la secreción de CRH.
Andrógenos suprarrenales: Deshidroepiandosterona y androstenodiona se secretan en
importantes cantidades, pero su acción es muy débil. Casi toda la actividad androgénica de
las hormonas suprarrenales se debe a la transformación de andrógenos suprarrenales en
testosterona en los tejidos diana.
Cuando se secretan cantidades excesivas de andrógenos, como sucede en el síndrome de
Cushing, puede producirse una virilización manifiesta del hombre y de la mujer.
La ACTH estimula la secreción de andrógenos suprarrenales.
Anomalías de la secreción corticosuprarrenal:
El aumento en las niveles plasmáticos de los glucocorticoides (cortisol) producen
síndrome de Cushing: La secreción excesiva de cortisol (p. ej por un tumor suprarrenal, un
tumor hipofisario que secrete gran ACTH y produzca una hiperplasia suprarrenal bilateral o
un tumor de los pulmones u otros tejidos que secretan grandes cantidades de ACTH y
produzcan hiperplasia bilateral).
Cuando el síndrome es secundario al exceso en la secreción de ACTH por la
adenohipófisis, es enfermedad de Cushing. El síndrome de Cushing también puede darse
por grandes cantidades de glucocorticoides exógenos. Síntomas:
● Movilización de la grasa desde las extremidades hasta el abdomen, cara y región
supraclavicular
● Hipertensión e hipopotasemia producidas por los valores plasmáticos elevados de
cortisol y 11-desoxicorticosterona (secretados en exceso)
● Disminución de las proteínas, con debilidad muscular, pérdida de tejido conjuntivo y
adelgazamiento de la piel (causante de estrías purpúreas) y alteración de
crecimiento infantil.
● Osteoporosis y fracturas vertebrales secundarias a los efectos directos sobre
huesos, disminución de absorción intestinal de calcio y aumento de la tasa de
filtración glomerular y excreción renal de calcio.
● Alteración de respuesta a infecciones por la supresión del sistema inmune
● Alteración del metabolismo de CHOs, hiperglucemia e incluso diabetes mellitus
resistente a la insulina
● Efectos masculinizantes si se secreta exceso de andrógenos suprarrenales
Sindrome de Conn (aldosteronismo primario) causado por un tumor de la zona
glomerular: Si hay un tumor en esta zona, que produce grandes cantidades de aldosterona,
las manifestaciones características son la hipertensión leve y la hipopotasemia.
El descenso de potasio reduce la capacidad de concentración de los riñones, produce
poliuria, y ocasiona debilidad muscular y alcalosis metabólica.
Enfermedad de Addison causada por una secreción disminuida de hormonas
corticosuprarrenales: La destrucción de la corteza puede obedecer a enfermedades
autoinmunes, tuberculosis o cáncer. Estos procesos suelen ocurrir de forma gradual y
determinan una reducción progresiva de la función glucocorticoide y mineralocorticoide.
Menor secreción de cortisol → Incremento de ACTH → Hiperpigmentación
Deficiencia de mineralocorticoides:
● Pérdidas excesivas de sodio, hipovolemia, hipotensión y aumento de la actividad
plasmática de la renina.
● Retención excesiva de potasio e hiperpotasemia
● Leve acidosis
Deficiencia de glucocorticoides:
● Alteraciones en metabolismo de CHOs, grasas y proteínas que producen debilidad
muscular, hipoglucemia del ayuno y utilización anómala de las grasas como sustrato
energético
● Pérdida del apetito y adelgazamiento
● Escasa tolerancia al estrés → La imposibilidad para secretar addisonianas, de no
administrarse de forma exógena, puede haber muerte.
Aquí termina el capitulo 78 -Hormonas corticosuprarrenales- de Guyton
También podría gustarte
- La Ciencia Del Metabolismo: Metabolismo sin rodeosDe EverandLa Ciencia Del Metabolismo: Metabolismo sin rodeosCalificación: 5 de 5 estrellas5/5 (1)
- Glándula Suprarrenal y Páncreas (Monografia)Documento11 páginasGlándula Suprarrenal y Páncreas (Monografia)Cdcgs PWinAún no hay calificaciones
- Clase 3 Glandulas SuprarrenalesDocumento5 páginasClase 3 Glandulas SuprarrenalesVa LeAún no hay calificaciones
- Hormonas CorticosuprarrenalesDocumento4 páginasHormonas CorticosuprarrenalesLucas BernalAún no hay calificaciones
- Tema 4 Hormonas CorticosuprarrenalesDocumento5 páginasTema 4 Hormonas Corticosuprarrenalesrachel leonAún no hay calificaciones
- Glándula SuprarrenalDocumento2 páginasGlándula SuprarrenalAlejandra Calderón GarcíaAún no hay calificaciones
- Tema 4. Hormonas de La Corteza SuprarrenalDocumento9 páginasTema 4. Hormonas de La Corteza SuprarrenalNatalia BecerraAún no hay calificaciones
- 18 de Octubre Segundo BloqueDocumento23 páginas18 de Octubre Segundo BloqueMonserrat Soria ZamoraAún no hay calificaciones
- Hormonas UABP 2Documento3 páginasHormonas UABP 2lua robertiAún no hay calificaciones
- Glandula SuprarenalDocumento57 páginasGlandula Suprarenalgaby100% (1)
- Endocrino Resumen 2Documento9 páginasEndocrino Resumen 2Wraysthell CordovaAún no hay calificaciones
- Hormonas CorticosuprarrenalesDocumento43 páginasHormonas CorticosuprarrenalesTere Talamantes100% (1)
- Capitulo 78. Hormonas CorticosuprarrenalesDocumento11 páginasCapitulo 78. Hormonas CorticosuprarrenalesMaria Amelia Gaton BaezAún no hay calificaciones
- Glándulas SuprarrenalesDocumento3 páginasGlándulas SuprarrenalesPineda HernándezAún no hay calificaciones
- Hormonas CorticosuprarrenalesDocumento36 páginasHormonas CorticosuprarrenalesNini Evangelis100% (1)
- Hormonas de La CORTEZA SuprarrenalDocumento10 páginasHormonas de La CORTEZA Suprarrenalpitu anatoAún no hay calificaciones
- Documento Sin TítuloDocumento3 páginasDocumento Sin TítuloJoselyn Meriño SuarezAún no hay calificaciones
- Hormonas CorticosuprarrenalesDocumento30 páginasHormonas CorticosuprarrenalesFlorencia Lozano AndradeAún no hay calificaciones
- Cap 77 Hormonas CorticosuprarrenalesDocumento10 páginasCap 77 Hormonas CorticosuprarrenalesFernando Vazquez100% (1)
- GlucocorticoidesDocumento18 páginasGlucocorticoidesByron VinicioAún no hay calificaciones
- Sistema Endocrino GLÁNDULAS SUPRARRENALESDocumento11 páginasSistema Endocrino GLÁNDULAS SUPRARRENALESPatricia DiazAún no hay calificaciones
- Endocrinologia LLLDocumento16 páginasEndocrinologia LLLTenshi KyuuketsukiAún no hay calificaciones
- Seminario 08 - Metabolismo Del CortisolDocumento29 páginasSeminario 08 - Metabolismo Del CortisolLuisAlfredoAlvaradoZavaletaAún no hay calificaciones
- 3er Cuestionario - Glucocorticoides y Mineralocorticoides - Farmacologa 2 - Mauro J GatiDocumento9 páginas3er Cuestionario - Glucocorticoides y Mineralocorticoides - Farmacologa 2 - Mauro J GatiJuan Pablo IngrassiaAún no hay calificaciones
- Hormonas y Progestanos ActualizadoDocumento32 páginasHormonas y Progestanos ActualizadoBernabé LabonteAún no hay calificaciones
- Hormonas y ProgestanosDocumento29 páginasHormonas y ProgestanosBernabé LabonteAún no hay calificaciones
- Hormonas CorticosuprarreanalesDocumento18 páginasHormonas CorticosuprarreanalesMax Edwin Gorena EspinozaAún no hay calificaciones
- Clase 19 - Endocrino Parte 3Documento19 páginasClase 19 - Endocrino Parte 3moleli560Aún no hay calificaciones
- Endocrinologia Glandulas SurparrenalesDocumento99 páginasEndocrinologia Glandulas SurparrenalesAlma Rosa NervoAún no hay calificaciones
- Glándulas SuprarrenalesDocumento4 páginasGlándulas SuprarrenalesEmanuel SanchezAún no hay calificaciones
- Informe Cap 78 407293 Downloable 765568Documento7 páginasInforme Cap 78 407293 Downloable 765568BRITHANY MAYERLI CONZA ROMEROAún no hay calificaciones
- Seminario Fisiologia Endocrina IIDocumento9 páginasSeminario Fisiologia Endocrina IIValentinaAún no hay calificaciones
- Fisiología de Las Hormonas Corti SuprarrenalesDocumento5 páginasFisiología de Las Hormonas Corti SuprarrenalesCarmem AlbuquerqueAún no hay calificaciones
- GLUCOCORTICOIDEDocumento13 páginasGLUCOCORTICOIDEClaudia Ana Sotomayor MolinaAún no hay calificaciones
- Hormonas CorticosuprarrenalesDocumento9 páginasHormonas CorticosuprarrenalesElda Araceli Hernández DíazAún no hay calificaciones
- 10 - (Metabolismo y Control Del Crecimiento) Parte IIDocumento17 páginas10 - (Metabolismo y Control Del Crecimiento) Parte IIluciaslabochAún no hay calificaciones
- Monografia ActDocumento6 páginasMonografia ActTAMIAún no hay calificaciones
- Antiinflamatorios EsteroidalesDocumento8 páginasAntiinflamatorios Esteroidaleseunicevargas100% (1)
- Hormonas Esteroideas Expo 2016Documento68 páginasHormonas Esteroideas Expo 2016Gil RuanoAún no hay calificaciones
- Funciones de Los MineralocorticoidesDocumento3 páginasFunciones de Los Mineralocorticoidescarlos50% (4)
- Hormonas CorticosuprarrenalesDocumento31 páginasHormonas CorticosuprarrenalesAlfredoDaleneyAún no hay calificaciones
- Bloque 5 Glándula SuprarrenalDocumento47 páginasBloque 5 Glándula SuprarrenalVictor Hugo Gonzalez Jimenez100% (1)
- Hormonas Corticosuprarrenales (Fisiologia)Documento7 páginasHormonas Corticosuprarrenales (Fisiologia)Ivanir Da Silva PereiraAún no hay calificaciones
- Fisiología Glándulas SuprarrenalesDocumento7 páginasFisiología Glándulas SuprarrenalesMaryAún no hay calificaciones
- Corticoesteroides Sinteticos (Farma Endo)Documento19 páginasCorticoesteroides Sinteticos (Farma Endo)Zaira Suaste DuarteAún no hay calificaciones
- Fisiopatología de La Glándula SuprarrenalDocumento17 páginasFisiopatología de La Glándula SuprarrenalTens AiepAún no hay calificaciones
- Glándula SuprarrenalDocumento3 páginasGlándula SuprarrenalGedsa Itzel Gaxiola MorenoAún no hay calificaciones
- Estero I Do GenesisDocumento6 páginasEstero I Do GenesisCanelo vazquez ClaudiaAún no hay calificaciones
- Taller 1 EndocrinoDocumento6 páginasTaller 1 EndocrinoIgnacia GaeteAún no hay calificaciones
- Hormonas CorticosuprarrenalesDocumento8 páginasHormonas CorticosuprarrenalesMariana A. Elizalde SantoscoyAún no hay calificaciones
- Diana Zaruma-Hormonas CorticosuprarrenalesDocumento11 páginasDiana Zaruma-Hormonas CorticosuprarrenalesDiana KristinaAún no hay calificaciones
- Bloque 3 Cap 8 Tema 6. Corteza AdrenalDocumento4 páginasBloque 3 Cap 8 Tema 6. Corteza AdrenalBenjamín VásquezAún no hay calificaciones
- Hormonas Secretadas Por Las Glandulas SuprrarenalesDocumento20 páginasHormonas Secretadas Por Las Glandulas SuprrarenalesAyelen Romina Quinteros SilesAún no hay calificaciones
- Fisiología de Aldosterona y CortisolDocumento4 páginasFisiología de Aldosterona y CortisolOscar Daniel RomeroAún no hay calificaciones
- HormonasDocumento66 páginasHormonasSofía DíazAún no hay calificaciones
- CortisolDocumento10 páginasCortisolJolo EscuderoAún no hay calificaciones
- LMF 5Documento11 páginasLMF 5valentinabartoraucuAún no hay calificaciones
- Glándulas SuprarrenalesDocumento24 páginasGlándulas SuprarrenalesJACKELINE VILLEGAS URQUISOAún no hay calificaciones
- Fisiología - Semana 12 - Todo JuntoDocumento42 páginasFisiología - Semana 12 - Todo JuntoCarolina FernandezAún no hay calificaciones
- Derechos Humanos Tercera GeneracionDocumento6 páginasDerechos Humanos Tercera GeneracionMaría José Elvir QuintanillaAún no hay calificaciones
- Velasquez Red Adm B EnsayoDocumento9 páginasVelasquez Red Adm B EnsayoJacqui Velasquez DiazAún no hay calificaciones
- Salvar Una Vida - Peter Singer - Capítulo 9 - ¿Pedir Demasiado?Documento3 páginasSalvar Una Vida - Peter Singer - Capítulo 9 - ¿Pedir Demasiado?Ana Alvarez GarcíaAún no hay calificaciones
- Iglesia en Camino Ic-1226-221219Documento12 páginasIglesia en Camino Ic-1226-221219Juan JugueraAún no hay calificaciones
- Ciclo Celular e Índice de FasesDocumento23 páginasCiclo Celular e Índice de FasesNatalyPomaPerez0% (1)
- ALDO PELLEGRINI - La Soledad Del ArtistaDocumento4 páginasALDO PELLEGRINI - La Soledad Del ArtistaMinerva Amatista BorgianaAún no hay calificaciones
- Clases de Palabras Ebook PDFDocumento27 páginasClases de Palabras Ebook PDFLuis AlmadaAún no hay calificaciones
- Mailing FinanzasDocumento8 páginasMailing FinanzasCarlosenrique Raynhir Cuenca BejarAún no hay calificaciones
- Biografia de Martin Luther KingDocumento32 páginasBiografia de Martin Luther KingRonny ArizaAún no hay calificaciones
- Conclusiones y RecomendacionesDocumento1 páginaConclusiones y RecomendacionesJuan Carlos Salazar AlvarezAún no hay calificaciones
- Proyecto Biogas 2Documento37 páginasProyecto Biogas 2Jherian Fernandez100% (1)
- Cátedra ECCIDocumento4 páginasCátedra ECCIKarina BernalAún no hay calificaciones
- LAS OBRAS DE MISERICORDIA Doctrina 1Documento2 páginasLAS OBRAS DE MISERICORDIA Doctrina 11xblades0% (2)
- Ejercicio AUDITORIA A EDECRIDocumento7 páginasEjercicio AUDITORIA A EDECRIEDY AROLDO ACABAL DIAZAún no hay calificaciones
- Denuncia Colegio de Abogados A Gony NelidaDocumento9 páginasDenuncia Colegio de Abogados A Gony NelidaCarlos Montana DamianAún no hay calificaciones
- INFORME FINAL - Introducción Al Derecho1Documento11 páginasINFORME FINAL - Introducción Al Derecho1Juan Carlos Garcia ChavezAún no hay calificaciones
- Analizar Textos Literarios (Recuperado Automáticamente)Documento4 páginasAnalizar Textos Literarios (Recuperado Automáticamente)fatimaAún no hay calificaciones
- Secuencia Cuerpo LenguaDocumento8 páginasSecuencia Cuerpo Lengualilyrios.arAún no hay calificaciones
- 6.3.3.7 Lab - Designing and Implementing IPv4 Addressing With VLSMDocumento7 páginas6.3.3.7 Lab - Designing and Implementing IPv4 Addressing With VLSMFëRgïë KïngzAún no hay calificaciones
- Laboratorio Calificado 01 v2-2Documento3 páginasLaboratorio Calificado 01 v2-2Carlos SotoAún no hay calificaciones
- Resumen Historia Segundo ParcialDocumento6 páginasResumen Historia Segundo ParcialVictoriaAún no hay calificaciones
- Personas Juridicas Derecho CivilDocumento11 páginasPersonas Juridicas Derecho CivilCésar XonAún no hay calificaciones
- Postura PedagogicaDocumento11 páginasPostura PedagogicaAngie UcedaAún no hay calificaciones
- Historiografía de La Edad Moderna y Contemporánea de La Iglesia en La Andalucía Occidental (1965-2007)Documento110 páginasHistoriografía de La Edad Moderna y Contemporánea de La Iglesia en La Andalucía Occidental (1965-2007)Diego MorillaAún no hay calificaciones
- SOLUCIONES PREGUNTAS TEMA4 Analisis de DatosDocumento27 páginasSOLUCIONES PREGUNTAS TEMA4 Analisis de DatosPoke GamerAún no hay calificaciones
- Evidencia de Aprendizaje Semana 1 Materia Instituciones de Derecho Romano JuDocumento5 páginasEvidencia de Aprendizaje Semana 1 Materia Instituciones de Derecho Romano JuCarlos el psicoloco y todologo GalvánAún no hay calificaciones
- Aportes de Didactica Paso 1Documento7 páginasAportes de Didactica Paso 1Ricardo Boneth CanavateAún no hay calificaciones
- Recuperacion ParcialDocumento7 páginasRecuperacion ParcialEnso Franchescoly Villanueva CoronelAún no hay calificaciones
- Proyecto de Investigacion..Documento22 páginasProyecto de Investigacion..Fabriccio Jara LeonAún no hay calificaciones
- Guia 1Documento3 páginasGuia 1Yeimmy HuertasAún no hay calificaciones
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Sana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónDe EverandSana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónCalificación: 5 de 5 estrellas5/5 (4)
- Puntos gatillo y cadenas musculares funcionales en osteopatía y terapia manual (Bicolor)De EverandPuntos gatillo y cadenas musculares funcionales en osteopatía y terapia manual (Bicolor)Calificación: 4.5 de 5 estrellas4.5/5 (23)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Manual de ortopedia maxilar: Modelo diagnóstico de maloclusiones para pacientes en crecimientoDe EverandManual de ortopedia maxilar: Modelo diagnóstico de maloclusiones para pacientes en crecimientoCalificación: 4.5 de 5 estrellas4.5/5 (14)
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDe EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónCalificación: 3.5 de 5 estrellas3.5/5 (2)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Las Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónDe EverandLas Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónCalificación: 4 de 5 estrellas4/5 (4)
- Limpiar, Nutrir, Reparar: Adiós a Las Enfermedades, En Tres Pasos NaturalesDe EverandLimpiar, Nutrir, Reparar: Adiós a Las Enfermedades, En Tres Pasos NaturalesCalificación: 4 de 5 estrellas4/5 (6)
- Alimentación prebiótica: Para una microbiota intestinal sanaDe EverandAlimentación prebiótica: Para una microbiota intestinal sanaCalificación: 4 de 5 estrellas4/5 (14)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Química orgánica: ejercicios de aplicaciónDe EverandQuímica orgánica: ejercicios de aplicaciónCalificación: 5 de 5 estrellas5/5 (3)
- Cambiar el pasado: Superar las experiencias traumáticas con la terapia estratégicaDe EverandCambiar el pasado: Superar las experiencias traumáticas con la terapia estratégicaCalificación: 5 de 5 estrellas5/5 (4)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Grasas inteligentes: Come más grasa. Pierde más peso. Mantente más sanoDe EverandGrasas inteligentes: Come más grasa. Pierde más peso. Mantente más sanoCalificación: 4 de 5 estrellas4/5 (10)
- La limpieza de colon: Completo programa de desintoxicación para hacer en casaDe EverandLa limpieza de colon: Completo programa de desintoxicación para hacer en casaCalificación: 3.5 de 5 estrellas3.5/5 (4)
- La rueda medicinal del ayurveda: Máxima salud y energía para tu cuerpo, mente y espírituDe EverandLa rueda medicinal del ayurveda: Máxima salud y energía para tu cuerpo, mente y espírituCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Pare La Diabetes en 14 Dias: No Ataque la Consecuencia de la Diabetes. Ataque la Causa de la DiabetesDe EverandPare La Diabetes en 14 Dias: No Ataque la Consecuencia de la Diabetes. Ataque la Causa de la DiabetesCalificación: 4.5 de 5 estrellas4.5/5 (55)
- Intervención y cuidado de enfermería a personas con lesiones de piel: Úlceras por presión y dermatitis asociada a incontinencia urinaria, fecal o mixtaDe EverandIntervención y cuidado de enfermería a personas con lesiones de piel: Úlceras por presión y dermatitis asociada a incontinencia urinaria, fecal o mixtaCalificación: 4.5 de 5 estrellas4.5/5 (3)
- La comida y el inconsciente: Psicoanálisis y trastornos alimentariosDe EverandLa comida y el inconsciente: Psicoanálisis y trastornos alimentariosAún no hay calificaciones