Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa Conceptual
Mapa Conceptual
Cargado por
ANDRES FELIPE CAMACHO FIRIGUADescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Mapa Conceptual
Mapa Conceptual
Cargado por
ANDRES FELIPE CAMACHO FIRIGUACopyright:
Formatos disponibles
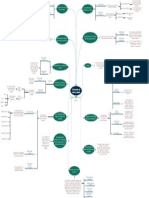
Métodos de muestreo para detectar
contaminación microbiológica o por
endotoxinas
Todos los Muestreo para
El personal Definición de los puntos
equipos involucrados en Es necesario Se deben
que interviene en Los determinación de muestreo
la fabricación de los contar con la seleccionar de fisicoquímica
los procesos de procedimiento de
productos deben estar validación de acuerdo con su MÉTODOS DE
limpieza debe limpieza debe estar
calificados este sistema uso previsto MUESTREO
estar formado estandarizado
la determinación del
porcentaje de recuperación de las
Enlistar todas las rutas, muestras en las distintas
líneas o trenes de Procedimiento Esta guía proporciona los puntos a
Listado de superficies que entran en
fabricación incluyendo los Validación del Selección del operativo considerar en la validación de
equipos vs. Capacitación contacto con el producto A
implementos utilizados sistema de agente de estándar de limpieza y es aplicable a fabricantes
equipos de personal.
agua limpieza limpieza de productos farmacéuticos, Se debe contar con métodos de análisis para
calificado METODOLOGÍA
suplementos dietarios, y productos determinación del principio activo peor caso A, y
ANALÍTICA
fitoterapéuticos interesados en la detergente, así como, métodos de análisis
Líneas de VALIDADA
certificación de BPM otorgada por el microbiológicos debidamente validados
fabricación Invima.
la estabilidad de las muestras en
solución
Definir claramente qué
se pretende en cada
ASS-AYC-GU012-GUIA PARA LA 1. Fabricar el
validación de limpieza, Objetivo y
PRERREQUISITOS
VALIDACIÓN DE LOS PROCESOS DE producto
incluyendo equipos, área alcance LIMPIEZA EN LA FABRICACIÓN DE peor caso A 2. Ejecutar los POE de
y establecimiento limpieza
PRODUCTOS FARMACÉUTICOS
3. Realizar el muestreo para análisis fisicoquímico,
EJECUCION DE LA Verificación del microbiológico y para detergentes
Análisis de Es un documento
riesgo orientador para la industria METODOLOGIA DE cumplimiento
farmacéutica y presenta VALIDACION DE de los
LIMPIEZA 4. Ejecutar los análisis fisicoquímicos y
Analisis de Determinación Límites de una alternativa para prerrequisitos microbiológicos correspondientes, con el fin de
riesgo para: Determinación Plan maestro Procedimiento efectuar validaciones de
del peor caso exposición cuantificar las trazas
1-Selección de peores de criterios de de validación de validación limpieza.
en líneas de basados en la
casos A y B. aceptación de limpieza
fabricación salud (HBEL)
2-Puntos de muestreo 5. Realizar el análisis
6. Elaborar el
y tipos de muestreo de datos
informe de
validación
INFORME DE
VALIDACIÓN
1. Método de la Se deben
Selección del Deben estar Debe existir un
dosis terapéutica efectuar estudios de
producto peor caso mencionadas las procedimiento que
2.Método de la dosis limpieza, teniendo en
AyB directrices para la indique los pasos de la 1. Descripción de 8. Emisión del concepto
toxica cuenta: concentración ejecución de las validación y ser parte la metodología de validación de limpieza
3. Método de las 10 del agente de limpieza, validaciones de del sistema
ppm el tiempo de contacto limpieza documental El informe del estudio de
4. Método visual y la temperatura. 2. Presentación de
validación de limpieza debe 7. Conclusiones.
resultados
contener
3. Resultado de
6. Desviaciones.
datos primarios de
los muestreos
4. Los tres
paquetes 5. Análisis de
técnicos o resultados
batch
También podría gustarte
- Evaluacion de DesempenoDocumento2 páginasEvaluacion de DesempenoSamir Palacio100% (1)
- Instrumento de EvaluacionDocumento8 páginasInstrumento de EvaluacionFREDY PAZ100% (1)
- Marketing una herramienta para el crecimientoDe EverandMarketing una herramienta para el crecimientoAún no hay calificaciones
- Copia de MATRIZ DE CAPACITACION MIPDocumento7 páginasCopia de MATRIZ DE CAPACITACION MIPmario0% (1)
- Taller BPLDocumento4 páginasTaller BPLANDRES FELIPE CAMACHO FIRIGUAAún no hay calificaciones
- Matriz Objetivos de CalidadDocumento3 páginasMatriz Objetivos de CalidadFundación Gestores Comunales Neiva la NuevaAún no hay calificaciones
- Los 12 Tipos de Pares Craneales y Su FunciónDocumento4 páginasLos 12 Tipos de Pares Craneales y Su FunciónRomero EspinozaAún no hay calificaciones
- Principio de Doble EfectoDocumento3 páginasPrincipio de Doble EfectoDarcia Stephanie Didier ApazAún no hay calificaciones
- Anexo Tercer Informe Matriz Diagnostico (Ctividad 6)Documento6 páginasAnexo Tercer Informe Matriz Diagnostico (Ctividad 6)NICOL DAYANA GOMEZ MARTINEZAún no hay calificaciones
- WRAC (Matriz de Identificacion de Peligros y Evaluacion de Riesgos)Documento7 páginasWRAC (Matriz de Identificacion de Peligros y Evaluacion de Riesgos)Evelyn Cortes AguileraAún no hay calificaciones
- Informe de Practicas Pre-Profesionales - UNSMDocumento16 páginasInforme de Practicas Pre-Profesionales - UNSMJesus CoralAún no hay calificaciones
- Mecanografia Computarizada 7,8 y 9 Actualizado - 2Documento6 páginasMecanografia Computarizada 7,8 y 9 Actualizado - 2Charmaine Wright80% (5)
- Modelo para El Control de Costos de Proyectos de ConstrucciónDocumento1 páginaModelo para El Control de Costos de Proyectos de ConstrucciónROSARIO ITZEL RAMIREZ RODRIGUEZ0% (1)
- Mapa Conceptual Costos EstandarDocumento4 páginasMapa Conceptual Costos EstandarDavid CrisantyAún no hay calificaciones
- Protocolo Nacional de Monitoreo de Calidad de SuelosDocumento33 páginasProtocolo Nacional de Monitoreo de Calidad de SuelosYorbi M. ZavaletaAún no hay calificaciones
- Borrador Metodologia de La SimulacioddddddnDocumento1 páginaBorrador Metodologia de La SimulacioddddddnJarochito JoestarAún no hay calificaciones
- CALIDADnDEnSOFTWAREn202250n144833 6862b8b8ee91a2dDocumento2 páginasCALIDADnDEnSOFTWAREn202250n144833 6862b8b8ee91a2dDayanaAún no hay calificaciones
- Lista de CotejoDocumento2 páginasLista de CotejoCAROLA ORTIZ MOGOLLON YTAún no hay calificaciones
- Sistemas de Fabricación Apunte 9Documento1 páginaSistemas de Fabricación Apunte 9Noemi SaavedraAún no hay calificaciones
- Procedimiento de Entrenamiento (Escuela 2016)Documento1 páginaProcedimiento de Entrenamiento (Escuela 2016)Lorena RamírezAún no hay calificaciones
- Central de EsterilizaciónDocumento1 páginaCentral de EsterilizaciónDayan Lizeth Conde GalvisAún no hay calificaciones
- EIA Actividad 3 1 Perales Valle PDFDocumento1 páginaEIA Actividad 3 1 Perales Valle PDFSaúl P. ValleAún no hay calificaciones
- Mapa Conceptual - Decreto 1295 de 1994 PDFDocumento1 páginaMapa Conceptual - Decreto 1295 de 1994 PDFMundo Movil50% (2)
- 178855-Corrección de Errores de La Convocatoria Navegación y Má (Copia)Documento1 página178855-Corrección de Errores de La Convocatoria Navegación y Má (Copia)ChamgnyAún no hay calificaciones
- Mapa Conceptual Sistemas de CosteoDocumento1 páginaMapa Conceptual Sistemas de CosteomiguelAún no hay calificaciones
- Coso 2013 - Cobit 5Documento17 páginasCoso 2013 - Cobit 5Marco Antonio Salcedo HuarcayaAún no hay calificaciones
- NOM 007-Hector-David-Lopez-MaldonadoDocumento1 páginaNOM 007-Hector-David-Lopez-MaldonadoRicardo Hernandez CidesAún no hay calificaciones
- ACTA 03 Del Módulo 03, Cosmetologia Prof. Dila, ACTUALIZADA 01.01.2021Documento2 páginasACTA 03 Del Módulo 03, Cosmetologia Prof. Dila, ACTUALIZADA 01.01.2021Javier PasacheAún no hay calificaciones
- FORMATO - 08 - ICA - 2023-2025 - REVISADO - 2013-AtrasDocumento48 páginasFORMATO - 08 - ICA - 2023-2025 - REVISADO - 2013-AtrasFernandoAún no hay calificaciones
- Mapa Mental y Preguntas PDFDocumento2 páginasMapa Mental y Preguntas PDFMariana, PAún no hay calificaciones
- 182892-Resolucion y Anexos (Copia) PDFDocumento193 páginas182892-Resolucion y Anexos (Copia) PDFJaviAún no hay calificaciones
- Trabajo FinalDocumento6 páginasTrabajo FinalDaniel Rivera SanchezAún no hay calificaciones
- VALIDACIÓN DE INSTRUMENTOS A TRAVÉS DE JUICIO DE EXPERTO Cunaique Guerrero Yuly Felicia.Documento8 páginasVALIDACIÓN DE INSTRUMENTOS A TRAVÉS DE JUICIO DE EXPERTO Cunaique Guerrero Yuly Felicia.Rober Galindo Mayorga AragonAún no hay calificaciones
- Organizador de Manejo de Muestras de AlimentosDocumento2 páginasOrganizador de Manejo de Muestras de AlimentosElva GarayAún no hay calificaciones
- Colon (Jhostin Jhoban Ricardo MoralesDocumento1 páginaColon (Jhostin Jhoban Ricardo MoralesJhostin RicardoAún no hay calificaciones
- Taller #4 Higiene y Seguridad IndustrialDocumento14 páginasTaller #4 Higiene y Seguridad IndustrialAndrea DiazAún no hay calificaciones
- FORM-SSOMA-003 Matriz Riesgos y Oportunidades ATISDocumento7 páginasFORM-SSOMA-003 Matriz Riesgos y Oportunidades ATISmeliyferAún no hay calificaciones
- Contabilidad de Costos 2Documento39 páginasContabilidad de Costos 2BLADIMIR ERNESTO PEREZ MELARAAún no hay calificaciones
- Plegable ContrainsurgenciaDocumento2 páginasPlegable ContrainsurgenciaOscar Zambrano100% (1)
- 184726-Criterios de Actuación Tribunales 222 Pga (Copia)Documento4 páginas184726-Criterios de Actuación Tribunales 222 Pga (Copia)Virginia GómezAún no hay calificaciones
- Reconociendo Mi Ambiente FormativoDocumento1 páginaReconociendo Mi Ambiente FormativoFreddy Zárate CardonaAún no hay calificaciones
- Ejemplo Matriz Estrategica - MATRIZ ESTRATEGICADocumento1 páginaEjemplo Matriz Estrategica - MATRIZ ESTRATEGICAOscar Javier Santos RodriguezAún no hay calificaciones
- Mesa de Trabajo 1Documento1 páginaMesa de Trabajo 1perro locoAún no hay calificaciones
- Malla Competencias - MarzoDocumento1 páginaMalla Competencias - MarzoMateoAún no hay calificaciones
- Mapa Mental Clasificacion de Costos y GastosDocumento1 páginaMapa Mental Clasificacion de Costos y GastosYimer CárdenasAún no hay calificaciones
- mallaCurricularSistemas 0Documento1 páginamallaCurricularSistemas 0Esteban MonteroAún no hay calificaciones
- Biodiversidad 2019 407 FichaDocumento1 páginaBiodiversidad 2019 407 FichaJhonatan Andres Arias ZapataAún no hay calificaciones
- EVALUACIÓN OPERATIVA O DE PROCESO - Mind MapDocumento2 páginasEVALUACIÓN OPERATIVA O DE PROCESO - Mind MapPERCEO100% (1)
- Mapa Conceptual SG-SSTDocumento1 páginaMapa Conceptual SG-SSTemilsengalarcio2Aún no hay calificaciones
- Caracterizacion y Seguimiento A Tareas Criticas - CRUZ ROJA GA GRIRARDOTDocumento6 páginasCaracterizacion y Seguimiento A Tareas Criticas - CRUZ ROJA GA GRIRARDOTjulieth escobarAún no hay calificaciones
- Matriz de Enfrentamiento - Analisis InternoDocumento1 páginaMatriz de Enfrentamiento - Analisis InternoPatrick Mendoza Palma100% (1)
- Programación Cuadrática.: ¿Para Que Se Usa?Documento4 páginasProgramación Cuadrática.: ¿Para Que Se Usa?RAFAEL ANTONIO BORDA JIMENEZ0% (1)
- Estructura TrabajoDocumento21 páginasEstructura TrabajoBryan BalladaresAún no hay calificaciones
- Taller Salud Ocupacional Sena Oct 31 2019Documento4 páginasTaller Salud Ocupacional Sena Oct 31 2019Dayana RodriguezAún no hay calificaciones
- Mapa Conceptual Cadena de Valor y Gestion Integral de Procesos PDFDocumento1 páginaMapa Conceptual Cadena de Valor y Gestion Integral de Procesos PDFdaniela carmona100% (1)
- Gráfico de Mapa Mental o Conceptual Con Bombilla de Luz y Formas Circulares Dibujadas A Mano Fondo NeutroDocumento1 páginaGráfico de Mapa Mental o Conceptual Con Bombilla de Luz y Formas Circulares Dibujadas A Mano Fondo NeutroKaren MaldonadoAún no hay calificaciones
- Plan 2008 2009Documento216 páginasPlan 2008 2009Marcela JuanAún no hay calificaciones
- Blanco Roberto DiagramadeFlujoDocumento2 páginasBlanco Roberto DiagramadeFlujoErikaRodriguezAún no hay calificaciones
- Actividad 7 MetDocumento6 páginasActividad 7 MetLisethbra AgudeloAún no hay calificaciones
- Mapa El Estandar AustralianoDocumento1 páginaMapa El Estandar AustralianoBrayan MurciaAún no hay calificaciones
- Mapa Mental - OsceDocumento1 páginaMapa Mental - OsceVerónica Mamani Paredes100% (1)
- Gestión de Conflictos y Proceso de Mediación MF104... - (TEMA 2. PROCESOS Y TÉCNICAS de MEDIACIÓN)Documento60 páginasGestión de Conflictos y Proceso de Mediación MF104... - (TEMA 2. PROCESOS Y TÉCNICAS de MEDIACIÓN)Diego Betancourt HidalgoAún no hay calificaciones
- AMEFDocumento11 páginasAMEFJhonAún no hay calificaciones
- Planificación de la gestión y organización de los procesos de montaje de sistemas domóticos e inmóticos (UF2132)De EverandPlanificación de la gestión y organización de los procesos de montaje de sistemas domóticos e inmóticos (UF2132)Aún no hay calificaciones
- Guía 1. Extracción de ADNDocumento5 páginasGuía 1. Extracción de ADNANDRES FELIPE CAMACHO FIRIGUAAún no hay calificaciones
- Psiquiatría, Una Industria de La MuerteDocumento3 páginasPsiquiatría, Una Industria de La MuerteANDRES FELIPE CAMACHO FIRIGUAAún no hay calificaciones
- Guía de Laboratorio de PCR y Electroforesis 2023Documento6 páginasGuía de Laboratorio de PCR y Electroforesis 2023ANDRES FELIPE CAMACHO FIRIGUAAún no hay calificaciones
- Farmacia QuimicaDocumento12 páginasFarmacia QuimicaANDRES FELIPE CAMACHO FIRIGUAAún no hay calificaciones
- Articulo Cientifico - Establecimientos FarmacéuticosDocumento5 páginasArticulo Cientifico - Establecimientos FarmacéuticosANDRES FELIPE CAMACHO FIRIGUAAún no hay calificaciones
- Tipos de EstimaciónDocumento9 páginasTipos de EstimaciónCarlos ContrerasAún no hay calificaciones
- Enfermeria InformeTecnicoDocumento78 páginasEnfermeria InformeTecnicolopezbarrientoskatherineAún no hay calificaciones
- Redes Sociales Mejores Horas para Publicar InfografíaDocumento4 páginasRedes Sociales Mejores Horas para Publicar InfografíaElizabeth Vaca SolisAún no hay calificaciones
- FIRMA N6 4ta DecisiónDocumento28 páginasFIRMA N6 4ta DecisiónIsabel Mery SolanoAún no hay calificaciones
- Pedro ParamoDocumento14 páginasPedro ParamoViviana NavarroAún no hay calificaciones
- 636 401S418Documento108 páginas636 401S418Pedro Jose Aguilera MoralesAún no hay calificaciones
- InfoDocumento8 páginasInfoJosu LduAún no hay calificaciones
- Fallo CarranzaDocumento23 páginasFallo CarranzaalexisAún no hay calificaciones
- Desacargable Semana 2Documento37 páginasDesacargable Semana 2Nathacha Silva RiveroAún no hay calificaciones
- AA2. Actividad de Aprendizaje 2Documento8 páginasAA2. Actividad de Aprendizaje 2fabian cano0% (1)
- Actividad de Limpieza de Quebrada El NietoDocumento44 páginasActividad de Limpieza de Quebrada El NietoLhot CalleAún no hay calificaciones
- Reconocimiento y Construcción de Conocimiento de La Historia, Geografía y La Cultura IbaguéDocumento16 páginasReconocimiento y Construcción de Conocimiento de La Historia, Geografía y La Cultura IbaguéFrancelly Barrios SalasAún no hay calificaciones
- Manipulación Segura Cierre y Apertura de Cilindros de GasDocumento1 páginaManipulación Segura Cierre y Apertura de Cilindros de GasCarolina PereiraAún no hay calificaciones
- Silabus - Project Management - 2019-IDocumento9 páginasSilabus - Project Management - 2019-ILuisGrandaAún no hay calificaciones
- Evalaucion Practica de Quimica Con Simuladores Virtuales 2020-2Documento15 páginasEvalaucion Practica de Quimica Con Simuladores Virtuales 2020-2Milton AparicioAún no hay calificaciones
- Tarea Ii de Sist. de La Informacion Gerencial Merari I.M.C.Documento8 páginasTarea Ii de Sist. de La Informacion Gerencial Merari I.M.C.Leonela CapellanAún no hay calificaciones
- Examen Pets Carguio y Traslado de Material C - Veh EspecialDocumento3 páginasExamen Pets Carguio y Traslado de Material C - Veh EspecialManuel CelaAún no hay calificaciones
- Como Instalar y Configurar Kerberos para WindowsDocumento10 páginasComo Instalar y Configurar Kerberos para WindowsJuan Guillermo Herrada0% (1)
- Exposicion Tumores VertebralesDocumento72 páginasExposicion Tumores Vertebralesyoleine GutierrezAún no hay calificaciones
- Sunafil Preguntasseguridadysaludeneltrabajo 150522123858 Lva1 App6892Documento38 páginasSunafil Preguntasseguridadysaludeneltrabajo 150522123858 Lva1 App6892Samuel100% (1)
- PINGUINOSDocumento6 páginasPINGUINOSJeimePeñaCampillayAún no hay calificaciones
- Bando de Policia y Gobierno para El Municipio de Tochimilco Puebla T 3 19082020Documento45 páginasBando de Policia y Gobierno para El Municipio de Tochimilco Puebla T 3 19082020Campo FutAún no hay calificaciones
- Folleto Triptico Educacion para La IgualdadDocumento2 páginasFolleto Triptico Educacion para La IgualdadMarcelo EstherAún no hay calificaciones
- Adoración A ShivaDocumento17 páginasAdoración A ShivaRudraSivaAmitabhaNath100% (1)
- Nueva Norma Tecnica 2023Documento86 páginasNueva Norma Tecnica 2023Alexandra ChiluisaAún no hay calificaciones
- La Psicología y Su PluralidadDocumento27 páginasLa Psicología y Su PluralidadAnaAún no hay calificaciones