Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
SEMINARIO IV: HIDROCARBUROS Y HALUROS DE ALQUILO
TEMARIO: Estructura y reactividad de alcanos, alquenos y alquinos. Halogenación y oxidación. Pirólisis (craking
térmico) de alcanos. Reacciones de adición y de sustitución. Sustitución electrofílica aromática. Sustituyentes
activantes y desactivantes del anillo. Estructura y reactividad de haluros de alquilo. Sustitución nucleofílica y
eliminación.
Hidrocarburos alifáticos
1) a) ¿Cómo clasifica los hidrocarburos alifáticos según el tipo de enlace?
b) Ordene los siguientes compuestos según su punto de ebullición creciente: metano, propano, pentano, octano
y decano. Justifique.
c) Indique en cuál de los siguientes solventes los hidrocarburos alifáticos se solubilizan mejor, justificar:
i- Hexano
ii- Metanol
iii- Agua
2) El gas natural, la gasolina y demás derivados del petróleo tienen entre sus constituyentes a los
hidrocarburos. La oxidación de los mismos se utiliza en la generación de calor (reacción exotérmica). Escriba la
ecuación de combustión de: i) gas propano (constituyente del gas natural), ii) isooctano (2-metilheptano).
3) La halogenación de alcanos es una reacción de sustitución radicalaria.
a) Escriba la reacción de bromación del ciclopentano usando Br2 en Cl4C, analice las distintas etapas (mecanismo) que
conducen a dicha reacción y agregue las condiciones necesarias para que la reacción ocurra.
b) ¿Cuál es el efecto de la luz en la reacción de halogenación?
c) ¿Como puede evidenciar en el laboratorio que la reacción ocurrió?
4) La presencia de insaturaciones hacen que los alquenos y alquinos sean más reactivos que los alcanos. Una de las
principales reacciones que sufren estos compuestos sigue el mecanismo de adición electrofílica.
a) Escriba las reacciones de halogenación con Br2 para el etano, eteno y etino respectivamente.
b) ¿Qué diferencias y similitudes encuentra entre la halogenación de estos tres compuestos? Considere los tipos de
reacción, las condiciones experimentales requeridas para que las mismas ocurran, y como puede visualizarlas en el
laboratorio.
5) La adición electrofílica en alquenos tiene como intermediario un carbocatión. La estabilidad del mismo determina
el curso de la reacción.
a) Enuncie y aplique la Regla de Markovnikov para la reacción del 2-metil-2-buteno con: i) H2O/H+, ii) HBr,
b) Exponga el mecanismo por el cual el 2-metil-1-penteno reacciona con cloruro de hidrógeno. Escriba la estructura
de los dos posibles intermedios de reacción y fundamente por que se forma principalmente un producto en esa
reacción de adición.
6) a) Los alquinos terminales presentan en su estructura un hidrógeno que es débilmente ácido, pero lo suficiente
como para formar sales metálicas insolubles, por ejemplo, sales de Cu (I), Hg (II), o Ag(I). Escriba las ecuaciones
correspondientes a la reacción del 1-butino y el 2-butino con AgNO3 y con Cu2Cl2 ambos en medio amoniacal.
b) Los hidrógenos de alcanos, alquenos y alquinos se diferencian por su acidez. Proponga un orden y justifique dicho orden
teniendo en cuenta las diferencias en hibridación
7) Los alquenos y alquinos son sensibles a la oxidación con reactivos oxidantes moderados tales como una solución
acuosa de permanganato de potasio (KMnO4).
a) Complete las siguientes reacciones:
-1-
�Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
i) 2-penteno + KMnO4 /H+
ii) acetileno + KMnO4 /OH-
b) ¿Cómo puede visualizar estas reacciones en el laboratorio?
c) Esta reacción podría ser utilizada para diferenciar a los alcanos de los hidrocarburos insaturados. ¿Por qué?
Hidrocarburos aromáticos
8) a) Los hidrocarburos aromáticos (como el benceno) a pesar de tener enlaces múltiples no sufren reacciones de
adición electrofílica como alquenos ni alquinos. ¿Por qué? ¿Cuáles son las reacciones características de los
hidrocarburos aromáticos?
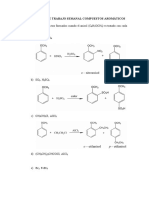
b) Complete las siguientes reacciones. Nombre los reactivos y productos según IUPAC.
FeBr3
i. Benceno + Br2
ii. Benceno + HNO3 H2SO4
iii. Benceno + CH COCl FeCl3
3
c) ¿Cuál es la función del FeBr3, H2SO4, FeCl3 en las reacciones anteriores?
9) Complete el siguiente cuadro considerando que los sustituyentes mencionados están unidos a uno de los
carbonos del benceno. Prediga si ese sustituyente se comportará como un grupo activante o desactivante frente a
una sustitución aromática electrofílica, en qué posición orientará al grupo entrante y si ese comportamiento
responde a efectos de resonancia o inductivos.
Sustituyente ¿Activante (A) o Efecto predominante
Orientación
del anillo aromático desactivante (D)? ¿resonante (R) o inductivo (I)?
–OH
–CO2H
–NO2
–NH2
–COCH3
–CH3
–Cl
10) a) En la reacción de Sustitución Electrofílica Aromática (SEA) de la anilina, el grupo amino “activa” al anillo.
Explique en qué consiste esta activación con estructuras. ¿En qué posiciones ocurrirá preferentemente la
sustitución?
b) Por el contrario, la SEA en el nitrobenceno “desactiva” el anillo. Fundamente con estructuras que además
expliquen las posiciones donde preferentemente ocurrirá la sustitución,
c) Las reacciones SEA se caracterizan porque siempre necesitan de un catalizador para reaccionar. Explique
cómo se genera el electrófilo en las reacciones plateadas en a) y b) usando bromo gaseoso y bromuro férrico.
Haluros de alquilo
11) a) ¿Cuál es la fórmula genérica de un haluro (ó halogenuro) de alquilo y uno de arilo?
b) Para la reacción del ioduro de metilo con el ión metóxido (base fuerte) describa el/los mecanismo/s
intervinientes, y detalle las características de dicho/s mecanismo/s de la forma más completa posible. Grafique
cualitativamente la coordenada de reacción.
c) Haga lo mismo que en b) pero reemplazando el ioduro de metilo por bromuro de ter-butilo. ¿Cuál es la diferencia
con el ejemplo descripto en b) ¿En qué consisten los mecanismos E1 y E2? Descríbalos.
-2-
�Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
d) Teniendo en cuenta las características estructurales de los halogenuros de arilo, ¿cual supone serán las
reacciones más representativas de estos compuestos?
12) a) ¿Qué es un nucléofilo? ¿Es lo mismo que una base? Explique.
b) Diga cuál de los siguientes pares es la especie más nucleofílica. Justifique.
i) CH3-CH2-OH y CH3-CH2-O¯,
ii) (CH3)3P y (CH3)3N;
iii) (CH3)3N y (CH3)2NH,
iv) CH3-CH2-SH y CH3-CH2-OH
13) Complete las siguientes reacciones:
-3-
�Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
EJERCICIOS ADICIONALES
1) Complete en el siguiente cuadro la reactividad esperada (reacciona/no reacciona) de los compuestos dados frente
a los reactivos que se indican en las condiciones planteadas. Escriba las reacciones que tienen lugar y las
observaciones que le permiten confirmar si la reacción ocurrió o no:
Benceno Hexano Propeno Acetileno
Br2/Cl4C, luz
Br2/Cl4C, oscuridad
KMnO4/ OH-
2) a) ¿Qué es un electrófilo? ¿Cuáles de los compuestos que hemos visto reaccionan con ellos? b) ¿Qué es un
nucléofilo? ¿Cuáles de los compuestos que hemos visto reaccionan con ellos? Explique.
3) ¿Qué características comunes tienen los sustituyentes activantes del anillo bencénico? ¿Y los desactivantes?
4) Indique la hibridación y geometría de los carbonos del etano, eteno y etino.
5) En la nitración de compuestos aromáticos interviene el catión NO2+ (nitronio). Plantee la reacción de formación
del mismo a partir del acido sulfúrico y el ácido nítrico. ¿Cuál de ellos es el catalizador? Dentro del esquema de una
reacción SEA ¿Qué función cumple el catión?
-4-
�Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
Trabajo práctico de Laboratorio.
A. HIDROCARBUROS
1. Reacción con el Bromo
Importante: No lleve a cabo las reacciones a la luz solar directa, salvo que explícitamente se indique hacerlo.
En distintos tubos de ensayo coloque 0,5 ml (10 gotas) de los siguientes reactivos:
a) Muestra de alcanos
b) Muestra de alquenos
c) Muestra de compuestos aromáticos
A cada tubo así preparado, agregue 3 gotas de solución de bromo en tetracloruro de carbono (Br 2 en CCl4) en la
oscuridad. Agite, observe.
Exponga los tubos a) y c) a la luz solar directa durante unos minutos. Observe. Interprete los resultados escribiendo
las reacciones químicas correspondientes. Conserve el tubo en que practicó la reacción b), lo usará para estudiar los
halogenuros de alquilo.
2. Reacción con reactivo de Baeyer (solución de permanganato de potasio)
En distintos tubos de ensayo coloque 0,5 ml (10 gotas) de:
a) Muestra de alcanos
b) Muestra de alquenos
c) Muestra de compuestos aromáticos
A cada tubo así preparado, agregue 2 gotas de solución de Baeyer (KMnO4 al 0,5 %). Agite enérgicamente por unos
segundos. Observe cualquier cambio en la coloración.
Observe los cambios e interprete la reacciones producidas escribiendo las ecuaciones químicas correspondientes.
3. Reacción con cloruro cuproso amoniacal (Cu (NH3)6 Cl )
En 4 tubos de ensayo coloque 0,5 ml (10 gotas) de cloruro cuproso amoniacal. A 3 de ellos agregue, respectivamente
4 gotas de:
a) Muestra de alcanos.
b) Muestra de alquenos
c) Muestra de compuestos aromáticos
Agite enérgicamente por unos segundos. Observe cualquier cambio producido.
En todos los casos interprete los cambios observados escribiendo las reacciones químicas producidas.
4. Reacción con nitrato de plata amoniacal.
-5-
�Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
Prepare cuatro tubos agregando en cada uno 0,5 ml de solución de AgNO3 al 2%, y solución acuosa de amoniaco
(NH3) al 1%, gota a gota hasta redisolución del precipitado inicialmente formado.
A tres de ellos agregue, respectivamente 4 gotas de:
a) Muestra de alcanos
b) Muestra de alquenos
c) Muestra de compuestos aromáticos.
Agite enérgicamente por unos segundos (excepto en d).
Observe cualquier cambio e intérprete escribiendo las reacciones químicas producidas.
5. Activación del Anillo Aromático.
En dos tubos de ensayo secos coloque:
a) Aproximadamente 0,1 gr. de fenol cristalizado;
b) 10 gotas de benceno.
Agregue a cada tubo 0,5 ml de ácido sulfúrico concentrado, y entibie en baño maría a 50-60°C durante 10 min.
Agregue a continuación, OPERANDO BAJO CAMPANA, CON PRECAUCION, 10 gotas de ácido nítrico concentrado en
cada tubo. Agítelos, observe cualquier cambio. Si es necesario caliéntelos 10 – 15 min a 50 – 60 °C a baño maría.
Diluya el contenido de ambos tubos con 5 ml de agua destilada; agite nuevamente y observe.
Observe los cambios ocurridos en los tubos de ensayos e intérprete escribiendo las reacciones químicas producidas.
Analice la diferente reactividad de las muestras analizadas frente a esta reacción.
6. Obtención y caracterización de acetileno.
El acetileno (y todos los hidrocarburos gaseosos) forma con el aire mezclas explosivas. Por lo tanto evite encender
la llama en las proximidades de los equipos generadores de gas.
Coloque trozos de carburo de calcio en el erlenmeyer, agregue una gota de agua y tápelo con el tapón
especialmente diseñado para esta experiencia, tal como se muestra en la figura. Observe e intérprete escribiendo la
ecuación química correspondiente.
Tenga previamente preparados los siguientes tubos:
a) 0.5 ml de bromo en tetracloruro de carbono (Br2 en CCl4).
b) O.5 ml de MnO4K al 0.5%.
-6-
�Química Orgánica (FCNyM) Seminario 04: Hidrocarburos y Haluros de alquilo y arilo
c) 0.5 ml de cloruro cuproso amoniacal
d) 0.5 ml de solución de AgNO3 al 2%, y gotas de solución acuosa de amoniaco (NH3) al 1%, hasta redisolución
del precipitado inicialmente formado.
Haga burbujear el acetileno en los tubos anteriores, con la precaución de enjuagar la boquilla en agua antes de
continuar en el siguiente tubo.
Observe lo que ocurre en cada tubo, registre sus observaciones e interprételas escribiendo las reacciones químicas
correspondiente.
B. HALOGENUROS DE ALQUILO Y ARILO
1. Ensayo de Beilstein:
Caliente a la llama oxidante de un mechero un alambre de cobre (Cu), hasta que la llama deje de colorearse. Déjelo
enfriar e introduzca el alambre limpio en las siguientes muestras problema:
a) Alcano
b) Productos de la reacción de bromación de alquenos y alquinos
c) Solución de o-diclorobenceno al 2% en etanol.
Vuelva a llevarlo a la llama y observe si se desarrolla o no color verde-azulado. Esta coloración es el indicio de
probable presencia de halógeno en la muestra de estudio.
Interprete las observaciones realizadas.
2-Reacción con solución de nitrato de plata ( NO3Ag) en etanol:
Sobre los tubos que ensayó la bromación de alquenos y alquinos, y en un tercer tubo que contenga 0,5 ml de
solución de p-diclorobenceno al 2% en etanol, agregue 2 ml de solución de nitrato de plata (NO3Ag) al 1% en etanol.
Si a los 5 minutos a temperatura ambiente no se observa cambio, caliente suavemente la mezcla hasta ebullición.
Observe los cambios ocurridos e intérprete escribiendo las reacciones químicas correspondientes.
-7-