0% encontró este documento útil (0 votos)
54 vistas3 páginasSoluciones o Disoluciones 2 2023
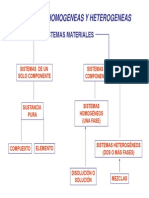
Las soluciones son mezclas homogéneas compuestas por un soluto y un solvente. La mayoría de las reacciones químicas ocurren en solución. Existen tres clases de soluciones - sólidas, líquidas y gaseosas - dependiendo del estado físico del soluto y solvente. Factores como la naturaleza de las sustancias, la temperatura, la presión y la agitación afectan la solubilidad de las sustancias.
Cargado por
Jonathan Oscar Villalobos VillarrealDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
54 vistas3 páginasSoluciones o Disoluciones 2 2023
Las soluciones son mezclas homogéneas compuestas por un soluto y un solvente. La mayoría de las reacciones químicas ocurren en solución. Existen tres clases de soluciones - sólidas, líquidas y gaseosas - dependiendo del estado físico del soluto y solvente. Factores como la naturaleza de las sustancias, la temperatura, la presión y la agitación afectan la solubilidad de las sustancias.
Cargado por
Jonathan Oscar Villalobos VillarrealDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd