Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Sesión9 - LariosGuerra - Miércoles 12-14
Cargado por
Juan SanchezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Sesión9 - LariosGuerra - Miércoles 12-14
Cargado por
Juan SanchezCopyright:
Formatos disponibles
ESPECTROFOTOMETRÍA ULTRAVIOLETA
a) Nombre del laboratorio: Fundamentos de análisis instrumental
b) Nombre del alumno: Rodrigo Jofiel Larios Guerra
c) Fecha (hora/día): miércoles 12:00-14:00
d) Nombre del tema: Transiciones de enlace molecular
e) Objetivos:
Identifica las transiciones de enlace molecular y la influencia de los solventes
orgánicos en la absorción de radiación espectral.
f) Resumen de la investigación teórica
1. a) ¿Qué significa “transición de enlace molecular”?
Se refiere a la transición de orbital que ocurre cuando, se exita un electrón desde un
orbital de menor energía (enlazante) a uno de mayor energía (antienlazante)
b) ¿Cuál es su uso analítico?
Se utiliza para identificación de grupos funcionales en una molécula, puesto que al
aplicarse a un compuesto orgánico radiación UV, provoca una serie de transiciones
electrónicas, con un valor característico de longitud de onda y coeficiente de extinción
molar.
2. Las principales características de una banda o pico de absorción de radiación
espectral, son su posición e intensidad.
a) ¿Qué indica la posición de la absorción?
Indica la línea de resonancia, y es la medición de resonancia de un átomo, este puede
resonar de un lado a otro directamente entre el estado basal y el estado exitado por
absorción o emisión en la línea.
b) ¿De qué depende la intensidad?
Es dependiente de la concentración de especies, número de enlaces similares en la
molécula que absorben a la misma frecuencia
3. Define los siguientes términos:
a) Orbital molecular de enlace.
Es el primer orbital sigma, es de menor energía que la de cada uno de los orbitales
atómicos 1s. Esta aloja dos electrones en el estado fundamental.
b) Orbital molecular de no enlace.
Es el orbital en el que se encuentran los electrones no enlazantes, (electrones libres),
cuyo nivel de energía se encuentra entre las orbitales sigmas, pi, sigma*, pi*
c) Orbital molecular de antienlace.
Este orbital tiene mayor energía que los dos orbitales atómicos 1s, también se le
denomina orbital sigma* pues, el asterisco indica un orbital antienlace. Se visualiza como
un par de gotas con un nodo a mitad de camino entre ellos
d) Orbital molecular Sigma.
Son el resultado del solapamiento frontal de orbitales atómicos s. Es el orbital asociado a
los enlaces sencillos, así como los electrones que los constituyen.
e) Orbital molecular Pi.
Es resultado del solapamiento lateral de los orbitales atómicos p. Los dobles enlaces de
las moléculas orgánicas poseen dos tipos de orbitales moleculares sigmas, pi, así también
sigma* y pi*.
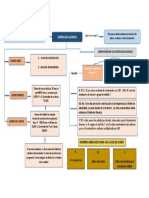
4. a) Representa con un esquema, los niveles de energía de las transiciones de
enlace molecular que puedan ocurrir en los compuestos por absorción de energía
espectral ultravioleta.
b)¿Cuáles son los rangos de los valores de los coeficientes de extinción molar y
de las longitudes de onda para estas transiciones?
Las mediciones de absorción atómica generalmente se hacen a 589 y 300 nm, debido a
que son las dos líneas de resonancia más intensas.
Coef. Extinción molar
n-sigma: entre 100 y 3000 abs/cm M
pi-pi: entre 1000 y 1500 abs/cm M
n-pi: entre 10 y 102 abs/cm M
5. Explica cómo los solventes podrían originar en las transiciones de enlace
molecular de los compuestos, el efecto batocrómico y cómo el efecto
hipsocrómico.
a) Efecto batocrómico: Los solventes pueden generar el efecto batocrómico cuando la
longitud de onda de absorción de una sustancia se desplaza hacía longitudes de onda
más largas, debido a un aumento de la polaridad del solvente en los compuestos donde
se presentan transiciones pi a pi*
b) Efecto hipsocrómico: Los solventes generales el efecto hipsocrómico cuando ocurre
un desplazamiento hacia longitudes de onda más cortas al aumentar la polaridad del
solvente. Se observa cuando se presenta las transiciones de n a pi* (antienlace).
Normalmente ocurre este efecto cuando se utiliza como solventes el agua o alcoholes.
g) Da cinco requisitos que deba cumplir un solvente para ser usado en los
sistemas de absorción de radiación espectral.
• Ser transparente
• Deben de tener un pH correcto o ideal
• Considerar los efectos sobre la muestra (no ser reactivo)
• Debe tener la misma polaridad que el analito
• Solventes cualquiera en visible son incoloro
h) 1. Menciona tres fuentes de energía luminosa para uso analítico en la región
del espectro ultravioleta. Explica el funcionamiento de una de ellas.
• Lampara de Tungsteno
• Lampara de Deuterio
• Lampara de Wolframio
Lámpara de Wolframio
El funcionamiento de la lámpara halógena requiere altas temperaturas, alrededor de los
250 ºC, con esta temperatura se evapora el wolframio del filamento que reacciona con los
halógenos dentro de la lámpara formando un gas, de esta forma se evita que se depositen
sólidos en la pared interior del cristal, lo que haría disminuir la capacidad lumínica de la
lámpara.
Como esta reacción de formación de halogenuros de wolframio es un proceso reversible,
cuando entran en contacto con una parte caliente del filamento, el wolframio se vuelve a
depositar y se forma de nuevo el gas, tratándose de un proceso cíclico
2. Menciona dos materiales transparentes en la región del espectro
ultravioleta.
• Vidrio
• Cuarzo
Bibliografía
George H. Schenk, Richard B. Hahn, Arleigh V. Hartkopf (1977).
Química analítica cuantitativa. (1a. ed.) México: CECSA.
Daniel C. Harris . (2003). Análisis Químico Cuantitativo
(3a ed.). Barcelona, España: Reverté.
Gary D. Christian. (2009). Química Analítica (6a ed.).
México, DF.: McGraw Hill.
También podría gustarte
- Espectrometría UV-VisibleDocumento37 páginasEspectrometría UV-VisibleOscar PortilloAún no hay calificaciones
- 2da UnidadDocumento29 páginas2da Unidadjuanosuna100% (1)
- Sesión10 SanchezRojas Martes14-16Documento3 páginasSesión10 SanchezRojas Martes14-16Sarah TristeAún no hay calificaciones
- TeoriaDocumento4 páginasTeoriaChristian Noe Esp. Her.100% (1)
- Sesión10 - 8-10Documento5 páginasSesión10 - 8-10Jose Luis AmbrisAún no hay calificaciones
- Sesion10 - Sanchez Najera - Miercoles 12-14Documento4 páginasSesion10 - Sanchez Najera - Miercoles 12-14Axel VasAún no hay calificaciones
- Sesion10 - Guerrero García - Miercoles 11-13 PDFDocumento5 páginasSesion10 - Guerrero García - Miercoles 11-13 PDFNayeli GarciaAún no hay calificaciones
- Aplicaciones de La Espectroscopia de Absorción Molecular UVDocumento13 páginasAplicaciones de La Espectroscopia de Absorción Molecular UVChloe MartínAún no hay calificaciones
- Actividad 2. Fundamentos Espectrocopia UV-visibleDocumento3 páginasActividad 2. Fundamentos Espectrocopia UV-visibleLizeth JuarezAún no hay calificaciones
- Sesión 10Documento3 páginasSesión 10coronadoleijamiriambeatrizAún no hay calificaciones
- Espectroscopia de Absorción Molecular UVDocumento6 páginasEspectroscopia de Absorción Molecular UVJanssen GomezAún no hay calificaciones
- Semana5 Vie09a11 ZamarripaInfanteDocumento7 páginasSemana5 Vie09a11 ZamarripaInfanteDiego InfanteAún no hay calificaciones
- UV VisDocumento9 páginasUV VisKarina Madela Landivar ZambranaAún no hay calificaciones
- 1° Parc - Vir Instru. 21-9-20Documento9 páginas1° Parc - Vir Instru. 21-9-20Laura PerdomoAún no hay calificaciones
- Radiación ElectromagneticaDocumento46 páginasRadiación ElectromagneticaMarianaAún no hay calificaciones
- Tarea No. 3 Espectro UV Visible Analisis Instrumental IBQ UAA 2021 (Completo 2)Documento10 páginasTarea No. 3 Espectro UV Visible Analisis Instrumental IBQ UAA 2021 (Completo 2)Derek Ebenezer Mata NavarroAún no hay calificaciones
- Cuestionario para Estudiar - AnálisisDocumento11 páginasCuestionario para Estudiar - AnálisisFernanda BlancoAún no hay calificaciones
- MonografiafisicaDocumento10 páginasMonografiafisicaTeodoro Quiza TintayaAún no hay calificaciones
- Trabajo de FotiquimicaDocumento12 páginasTrabajo de Fotiquimicajhostien lee arroyo huamancizaAún no hay calificaciones
- TQO-semana8 ValverdeDocumento27 páginasTQO-semana8 ValverdeGABRIEL MARINO MARTINEZ PARRAAún no hay calificaciones
- Espectrofotometria UVDocumento64 páginasEspectrofotometria UVAlex F. Perdomo0% (1)
- ULTRAVIOLETA-visible 2023Documento50 páginasULTRAVIOLETA-visible 2023Sebastian HernándezAún no hay calificaciones
- EspectrofotometríaDocumento9 páginasEspectrofotometríaSAMANTHA ASSUL PINTO ACOSTAAún no hay calificaciones
- Cuestionario EspectrometríaDocumento15 páginasCuestionario EspectrometríaJose PastorAún no hay calificaciones
- Espectroscopia y ColorimetriaDocumento11 páginasEspectroscopia y ColorimetriaYuriPaolaVallejoNovaAún no hay calificaciones
- 4.2.5.4 Espectrofotometría UV VisibleDocumento12 páginas4.2.5.4 Espectrofotometría UV VisibleAlejandro FuentesAún no hay calificaciones
- Practica Espectros Grupo CarboniloDocumento13 páginasPractica Espectros Grupo Carboniloxpasxraichar13Aún no hay calificaciones
- 56 GUIA Nro 1 La Estructura Electrónica de Los Átomos 2024Documento16 páginas56 GUIA Nro 1 La Estructura Electrónica de Los Átomos 2024Juan Pablo Nicolas CaseresAún no hay calificaciones
- Espectrofotometría de Absorción UV-VisibleDocumento16 páginasEspectrofotometría de Absorción UV-VisibleVanquelin100% (4)
- INVESTIGACIONDocumento16 páginasINVESTIGACIONAndrea GonzalezAún no hay calificaciones
- Tareas U2 - Gonzalez Flores Andrea - IntrumentalDocumento16 páginasTareas U2 - Gonzalez Flores Andrea - IntrumentalAndrea GonzalezAún no hay calificaciones
- Actividad No 2Documento5 páginasActividad No 2Andrea LemusAún no hay calificaciones
- Espectroscopia InfrarrojaDocumento13 páginasEspectroscopia Infrarrojakfbt369Aún no hay calificaciones
- Génesis Vera Quimí - Investigación 1Documento6 páginasGénesis Vera Quimí - Investigación 1gmveraq03Aún no hay calificaciones
- Sesion15 SanchezJuan Lunes13-15Documento7 páginasSesion15 SanchezJuan Lunes13-15Juan SanchezAún no hay calificaciones
- Taller Quimica de Analitica - Espectroscopia de AbsorcionDocumento14 páginasTaller Quimica de Analitica - Espectroscopia de AbsorcionNachoSebastiánMiranda100% (4)
- Sesion6 - Guerrero García - Miercoles 11-13 PDFDocumento6 páginasSesion6 - Guerrero García - Miercoles 11-13 PDFNayeli GarciaAún no hay calificaciones
- INVESTIGACIONDocumento16 páginasINVESTIGACIONAndrea GonzalezAún no hay calificaciones
- Espectroscopia de Absorcion Molecular Ultravioleta y VisibleDocumento20 páginasEspectroscopia de Absorcion Molecular Ultravioleta y VisibleGabiiee OliveraAún no hay calificaciones
- 9 ProblemarioDocumento22 páginas9 ProblemarioLEONEL CRUZ ORTIZAún no hay calificaciones
- Taller 1 (UV-VIS)Documento4 páginasTaller 1 (UV-VIS)Cristian MartinezAún no hay calificaciones
- Ensayo de Espectroscopia Infrarroja Luis RochaDocumento12 páginasEnsayo de Espectroscopia Infrarroja Luis RochaLuis RochaAún no hay calificaciones
- Métodos de Caracterización de Las MoléculasDocumento35 páginasMétodos de Caracterización de Las Moléculasdayono juAún no hay calificaciones
- Unidad 2 Espectroscopia de Absorción en El UvDocumento15 páginasUnidad 2 Espectroscopia de Absorción en El UvDiamante Hernandez Merida0% (1)
- Espectroscopía Atómica I. AbsorciónDocumento14 páginasEspectroscopía Atómica I. AbsorciónSol CVAún no hay calificaciones
- UNIVERSIDAD TÉCNICA DE AMBATO CuestioaDocumento8 páginasUNIVERSIDAD TÉCNICA DE AMBATO Cuestioaostz albanAún no hay calificaciones
- Taller3 Fisica3Documento4 páginasTaller3 Fisica3Horianita TrujilloAún no hay calificaciones
- VibracionesDocumento63 páginasVibracionesStefania Herenandez MotaAún no hay calificaciones
- 03 Tema3Documento29 páginas03 Tema3Rakel Martinez AlonsoAún no hay calificaciones
- EspectrofotometríaDocumento14 páginasEspectrofotometríaalejandro Gómez MiguelAún no hay calificaciones
- Espectroscopiair MariagDocumento8 páginasEspectroscopiair MariagJosé MenesesAún no hay calificaciones
- ESPECTROFOTOMETRIA Principio de La EspecDocumento13 páginasESPECTROFOTOMETRIA Principio de La EspecLoreneys Paternina ArnedoAún no hay calificaciones
- 2 Plantilla de Práctica # 2 Espectroscopia de EmisionDocumento9 páginas2 Plantilla de Práctica # 2 Espectroscopia de EmisionMilagro FloresAún no hay calificaciones
- Espectrofomo Bouguer BeerDocumento6 páginasEspectrofomo Bouguer BeerSofía ArellanoAún no hay calificaciones
- Informe 1Documento12 páginasInforme 1JESUS DAVID BOLA‹O JIMENEZAún no hay calificaciones
- Espectroscopía de Absorción AtómicaDocumento30 páginasEspectroscopía de Absorción AtómicaDamián LMAún no hay calificaciones
- Configuracion Electronica y El Espectro de Los ElementosDocumento9 páginasConfiguracion Electronica y El Espectro de Los ElementosAxssell Jurguen Cutipa QuispeAún no hay calificaciones
- Preguntas de Analisis 2do ExamenDocumento13 páginasPreguntas de Analisis 2do ExamenAdrián León PachecoAún no hay calificaciones
- InstrumentaciónDocumento9 páginasInstrumentaciónMariana Verónica BelliniAún no hay calificaciones
- AnalisisDocumento8 páginasAnalisisAzasu LuzAún no hay calificaciones
- Investigaciòn t4 Mecanica de MaterialesDocumento30 páginasInvestigaciòn t4 Mecanica de MaterialesDaniel VázquezAún no hay calificaciones
- PolimerosDocumento155 páginasPolimerosservando1957Aún no hay calificaciones
- AluminioDocumento18 páginasAluminioAlonso M HitzlspergerAún no hay calificaciones
- Marco TeoricoDocumento4 páginasMarco TeoricoJLuiss UPaadillaaAún no hay calificaciones
- Tarea 1 - Fundamentos de Electrónica Básica - 100414 - 119Documento5 páginasTarea 1 - Fundamentos de Electrónica Básica - 100414 - 119Diana marcela Mosquera cerqueraAún no hay calificaciones
- Cuestionario 3-1 Tecnología y Manejo de Materiales C2-22Documento3 páginasCuestionario 3-1 Tecnología y Manejo de Materiales C2-22Levi's LolAún no hay calificaciones
- RiserDocumento1 páginaRiserTurker FAún no hay calificaciones
- Diagrama PVTDocumento4 páginasDiagrama PVTNeilet Arias AgostiniAún no hay calificaciones
- Ingenieria MaterialesDocumento2 páginasIngenieria MaterialesAnonymous KxD9ocAún no hay calificaciones
- Evaluacion de Quimica Tecero San AgustinDocumento2 páginasEvaluacion de Quimica Tecero San AgustinCN KramAún no hay calificaciones
- 234-13 PLEXIGLAS ALLTOP SDP 16 EsDocumento2 páginas234-13 PLEXIGLAS ALLTOP SDP 16 Esfachadas bioclimaticasAún no hay calificaciones
- Ejercicios Resueltos de Recuperación MejoradaDocumento87 páginasEjercicios Resueltos de Recuperación MejoradaGema AndradeAún no hay calificaciones
- PDF TP 4 Ensayo de TracciónDocumento8 páginasPDF TP 4 Ensayo de TracciónPame MelussiAún no hay calificaciones
- Relé PRQ (Protección Función Q) : Merlin Gerin / División Media TensiónDocumento25 páginasRelé PRQ (Protección Función Q) : Merlin Gerin / División Media TensiónTaller ProvecaexAún no hay calificaciones
- Presentación Empresa de Marketing Formas Organicas CremaDocumento12 páginasPresentación Empresa de Marketing Formas Organicas CremaEduardo CullenAún no hay calificaciones
- Concreto Armado IIDocumento57 páginasConcreto Armado IIHerbert Yauri MachaccaAún no hay calificaciones
- Diseño SartaDocumento49 páginasDiseño SartaErnesto de la CarcovaAún no hay calificaciones
- El Vidrio Es Un LíquidoDocumento4 páginasEl Vidrio Es Un Líquidoluisernesto15Aún no hay calificaciones
- Unidad 2 Tratamientos TérmicosDocumento96 páginasUnidad 2 Tratamientos TérmicosDiana HernandezAún no hay calificaciones
- Caracteristicas Generales Del Concreto ArmadoDocumento11 páginasCaracteristicas Generales Del Concreto ArmadoAdriana MichelleAún no hay calificaciones
- Examen 1er Parcial 2021 - 22 SolucionsDocumento8 páginasExamen 1er Parcial 2021 - 22 Solucionsgonzalo.fernandez.peyraAún no hay calificaciones
- Actividad 5 - Conveccion TermicaDocumento10 páginasActividad 5 - Conveccion TermicaAlejandroAún no hay calificaciones
- Inversión de Giro en Motores Monofásicos A Través de Un Tablero ElectrónicoDocumento3 páginasInversión de Giro en Motores Monofásicos A Través de Un Tablero ElectrónicoBEYMAR CALLECONDEAún no hay calificaciones
- Mapa Aceros AleadosDocumento1 páginaMapa Aceros AleadosEduardo LLERENA LOPEZAún no hay calificaciones
- Resistencia A La Corrosión y Al Desgaste de RecubrimientosDocumento184 páginasResistencia A La Corrosión y Al Desgaste de RecubrimientosDavidAún no hay calificaciones
- Hoja de Calculo Secciones Aisc 341Documento36 páginasHoja de Calculo Secciones Aisc 341JhennyPatiñoYépezAún no hay calificaciones
- Treball de Recerca Powerpoint (Versión Final)Documento27 páginasTreball de Recerca Powerpoint (Versión Final)david_hurtado83% (12)