Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tensión superficial de soluciones: método del ascenso capilar
Cargado por
Jose Daniel Ballestero MontielTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tensión superficial de soluciones: método del ascenso capilar
Cargado por
Jose Daniel Ballestero MontielCopyright:
Formatos disponibles
“Tensión superficial de soluciones acuosas”
(Practica Nº 7)
Universidad del Zulia. Facultad de Ingeniería.
Escuela de Ingeniería Química. Laboratorio de Físico-Química
Prof.Valentina Millano
millanov@gmail.com
1. Objetivos: determinar la altura de varias soluciones acuosas de concentración
conocida utilizando el método de ascenso del tubo capilar. Determinar el tipo
de agente tenso activo presente en las soluciones. Determinar la tensión
superficial del agua destilada por medio del método del anillo de Dunnoy.
2. Fundamentos Teóricos: dentro del cuerpo de un líquido alrededor de una
molécula actúan atracciones casi simétricas. En la superficie, sin embargo,
dicha molécula se encuentra solo parcialmente rodeada por otras y, en
consecuencia, experimenta una atracción hacia el cuerpo del líquido. Esta
atracción tiende a arrastrarlas moléculas superficiales hacia el interior, y la
hacerlo el liquido se comporta como si estuviera rodeada por una membrana
invisible. Este fenómeno se conoce como tensión superficial, y es efecto
responsable de la resistencia que un liquido presenta a la penetración
superficial, observable en la forma casi esférica de gotas de lluvia, la forma
esférica de las partículas de mercurio situadas en una superficie lisa, el
ascenso de los líquidos en los tubos capilares, y la flotación de las hojas de
metal en la superficie liquida. Desde el punto de vista puramente
termodinámico, la tensión superficial puede considerarse como la tendencia de
un líquido a disminuir su superficie hasta un punto en que su energía de
superficie potencial es mínima, coedición necesaria para que el equilibrio sea
estable.
Puesto que una esfera presenta un área mínima para un volumen dado, la
tendencia de una partícula liquida será la de adquirir la forma de una esfera
bajo la acción de la tensión superficial, como acontece en la realidad.
Como la tendencia natural de un liquido es la de reducir su superficie, un
incremento de esta solo se lleva a cabo a expensas de cierto trabajo.
Consideremos una capa de líquido contenido dentro de una estructura de
alambre, ABCD, como la figura 1.
I Periodo 2009 Página 1
El lado CD = 1, es móvil. Si requiere una fuerza f para desplazar el alambre CD
contra la tensión superficial que actúa en el film a lo largo de CD, el trabajo, W,
al mover el alambre de CD a EG, es:
W fx (1)
La fuerza que actúa, f, es contrarrestada por la tensión superficial en CD. Si
designamos la fuerza por centímetro resulta:
F 2y1 (2)
W fx 2 y1x (3)
De la ecuacion (2) se define como
f
y (4)
21
Esto es, la fuerza en dinas que actúa en 1cm de longitud de superficie. Sin
embargo, 21x es el área de la nueva superficie del líquido producido por CD,
ΔA. De aquí que la ecuacion (3) se convierta también en:
W y(21x) yA (5)
W
Y (6)
A
En consecuencia, y puede considerarse también como el trabajo en ergios
necesario para formar un centímetro cuadrado de área superficial, y se
encuentra, por lo tanto, referido a la energía libre superficial por centímetro
cuadrado de área.
La tensión superficial es una propiedad característica de cada líquido y difiere
considerablemente de un líquido a otro. Existen diversos procedimientos para
medir la tensión superficial, entre ellos se encuentra: el del tensiómetro, peso
de la gota, el del anillo de dunnoy y el del ascenso capilar, es este ultimo el
mas importante y se considera el estándar.
El método capilar se basa en el hecho de que la mayoría de los líquidos
cuando se ponen en contacto con un tubo capilar de vidrio, es decir se adhiere
a el. Si no lo moja, como en el caso del mercurio, el nivel interior del capilar
queda por debajo del extremo, y la superficie del mercurio es convexa, en vez
de cóncava como en el caso anterior.
Para comprender la teoría del método, consideremos un tubo fino capilar de
radio uniforme, r, sumergido en un recipiente que contiene un liquido que
humedece el capilar, figura 2. Al humedecer la pared interna del capilar
aumenta la superficie del líquido y para decrecer la superficie libre aquel
ascenderá por el tubo. En cuanto así sucede, se humedece de nuevo el capilar,
I Periodo 2009 Página 2
y el líquido sigue ascendiendo. Pero este proceso no sigue indefinidamente, si
no que se detiene cuando la fuerza de tensión superficial que actúa hacia
arriba se iguala con la de la columna liquida que actúa hacia abajo.
Si designamos por y a la tensión superficial en dinas por centímetro en la
circunferencia interna, y consideramos que la fuerza actúa en el ángulo ,
llamado de contacto, con la vertical, entonces la fuerza de la tensión superficial
es:
F2 2 .ry cos (7)
Esta fuerza se halla balanceada por la de la columna liquida de altura h, es:
F2 .r 2 hpg (8)
Donde p es la densidad del liquido y g la gravedad, en centímetros por seg2.
Por lo tanto, como en el equilibrio f2 = f1
2r 2 y cos r 2 hpg (9)
rhpg
y (10)
2 cos
Para la mayoría de los líquidos que mojan el vidrio, es esencialmente cero, y
el coseno de 0 = 1. Entonces:
rhpg
y (11)
2
Si se utiliza una sustancia patrón como el agua, a la cual se le conoce su
tensión superficial a la temperatura a la cual se realiza la practica, y se utiliza el
mismo tensiometro, se determina la altura del agua en dicho tensiometro, como
I Periodo 2009 Página 3
se va a utilizar el mismo tensiometro, para medir la altura del agua y la altura
de las soluciones se tiene: el radio y la gravedad va a se constante por lo tato:
y1 p1 h1 rg / 2
(12)
y 2 p 2 h2 rg / 2
Como la gravedad y el radio son constante se elimina y se
Obtiene la siguiente ecuación:
y1 p1 h1
(13)
y 2 p 2 h2
Que es la ecuacion que se va a utilizar en la parte experimental.
Las soluciones presentan tensiones superficiales que son diferentes a las del
solvente puro, a causa de una distribución desigual del soluto entre el volumen
y la superficie de la solución.
Sustancias orgánicas tales como: jabones, ácidos sulfonicos, alcoholes de
peso molecular elevados, éteres, aldehidos, etc, disminuyen la tensión
superficial del agua y se encuentra que la concentración del soluto en la
superficie es mayor que en la solución. Por ejemplo: una solución acuosa de
alcohol caprilico al 0.1% revela una tensión superficial de 36 dinas/cm mientras
que una solución acuosa de alcohol butílico normal al 1.54% muestra una
tensión superficial de 48 dinas/cm.
En 1878 J. Willard Gibas demostró que la actividad superficial se debía a la
distribución desigual del soluto entre la superficie y el cuerpo de la solución.
Por un razonamiento puramente termodinámico, dedujo que si un soluto se
distribuye de manera de que la superficie contiene un exceso q moles de soluto
por 1cm2 de área al presente en el cuerpo de la solución, entonces en las
soluciones diluidas se cumple que
Cdy
q (14)
RTdy
Donde:
C = es la consetracion de la solución
T = la temperatura absoluta
R = la constante de los gases
dy/dC = la velocidad de variación de la tensión superficial de la solución con la
concentración.
Cuando dy/dC es positiva, es decir, cuando la tensión superficial de la solución
aumenta con la concentración, q debe ser negativa, y el cuerpo de la solución
es más rica en soluto que la superficie, como en el caso de muchos electrolitos.
Sin embargo, cuando la tensión superficial de la solución disminuye con la
I Periodo 2009 Página 4
concentración, dy/dC es negativo, q es positiva, y la superficie contiene una
concentración mayor del soluto que la solución. Esto último es lo que sucede
con los agentes activos superficiales. Por lo tanto, la actividad superficial
positiva esta asociada con una adsorcion del soluto desde la solución hacia la
superficie de esta, mientras que la actividad se debe a una expulsión de soluto
de la superficie. La ecuacion se conoce como la adsorcion de Gibbs.
No se conoce ninguna correlación teòrica que una las variables y solo se
conocen ecuaciones empíricas del tipo:
a) y y0 BC (15)
b) y y0 a ln(1 bc) (16)
c) y y0 bC eC d (17)
Donde, a, b, c, y d son cantantes particulares de cada solución.
3. Procedimiento Experimental:
Se Utiliza un sistema para medir tensión superficial, que consta de un cilindro
graduado, un capilar, mangueras entre otros. Se vierte agua destilada, se
colocara el tapón se observara que el nivel del agua coincida con el cero de la
escala, luego se sopla por la manguera para que el agua suba por el tubo
capilar hasta el tope; y al dejar de soplar el liquido vuelva a su posición de
equilibrio, equivale a la altura del liquido de agua bajo las condiciones en
estudio. Esta altura es medida dentro de la columna de agua en el tubo capilar.
Seguidamente se desecha el agua, y se procede de la misma forma con las
soluciones preparadas de acido acético a diferentes concentraciones,
realizándolo en orden creciente a las concentraciones de acido acético. Al
finalizar con una concentración no olvidar enjuagar varias veces el cilindro.
4. Materiales y Reactivos:
Ítem Descripción Cantidad
1 Aparato de tensión superficial (método del
tubo capilar)
2 Anillo de Dunnoy
3 Soluciones acuosas de acido acético de
concentraciones 5, 10, 15, 30, 50 y 70% p/p
I Periodo 2009 Página 5
5. Paso a Paso:
a. Cerciorarse que la manguera de goma tenga un trocito de algodón.
b. Quitar el tapón de goma y vertir agua destilada.
c. Apretar el tapón de goma y observar que el nivel del agua coincida con el
acero de la escala.
d. Soplar suavemente por la manguera para que el agua suba por el tubo
capilar.
e. Deje de soplar para que el líquido vuelva a su posición de equilibrio.
f. Succionar para que haga bajar el agua del tubo capilar y nuevamente
permitir que alcance su equilibrio.
g. Medir la altura que tiene la columna de agua en el tubo capilar, que en
ambos casos deben ser iguales, de lo contrario, indicar que el tubo capilar
esta sucio y que debe lavarse.
h. Botar el agua, enjuagar varias veces el tenciometro con la solución y medir
la altura capilar.
i. Continuar el mismo proceso, siempre en orden creciente a las
consentracines de la solución, obteniendo de esta forma las alturas
capilares.
6. Cuestionario:
1. Explicar la acción de las impurezas de una solución en la tensión
superficial.
2. ¿Cual es la función del tapón de algodón insertado en la
manguera?
3. ¿Por qué se deben usar las soluciones en orden creciente a sus
concentraciones?
4. ¿Por qué se recomienda guardar el tubo capilar en agua
destilada?
5. cuales son las dimensiones de R en la ecuacion:
q= - C dy
RT dC
I Periodo 2009 Página 6
6. ¿Que significa q/C?
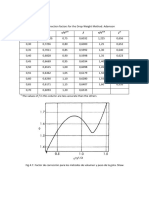
7. Para las soluciones acuosas de n-butanol a 20ºC Harkins and
Wampler. (J. Am. Chem. Soc., 53, 850 (1931), se tienen los siguientes
valores:
Tensión superficial Molaridad
72.80 0.00329
72.26 0.00658
70.82 0.01320
68.00 0.0264
63.14 0.0536
56.31 0.1050
48.08 0.2110
38.87 0.4330
Trazar: a) La grafica de tensión superficial vs. Concentración
b) Trazar la grafica de dy/dC vs. C
C) Calcular el valor de q para una concentración de 0.02M
I Periodo 2009 Página 7
7. Formato para el registro de los resultados Practica No.8
Fecha:____________ Sección:_________ Día/Hora:____________
Grupo No._____________
Integrantes:
1.-________________________ 2.-________________________
3.-________________________ 4.-________________________
Datos y/o Resultados experimentales alcanzados:
Solucion y Altura (cm) medida
Concentracion
I Periodo 2009 Página 8
También podría gustarte
- 09 Tipos de Juntas y Simbolos de SoldaduraDocumento90 páginas09 Tipos de Juntas y Simbolos de SoldaduraBrian Christian AVAún no hay calificaciones
- Capilaridad y Tensión SuperficialDocumento7 páginasCapilaridad y Tensión SuperficialJhonAlex100% (1)
- Oquímica de Los Elementos Traza y Tierras RarasDocumento67 páginasOquímica de Los Elementos Traza y Tierras Raraslumiss64% (11)
- Tensión Superficial en FlotaciónDocumento10 páginasTensión Superficial en FlotaciónClaudia T.Aún no hay calificaciones
- Vademecum Actualizado ECDocumento516 páginasVademecum Actualizado ECDaniel Gutierrez100% (3)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Propiedades de los fluidos y fuerzas hidrostáticasDocumento11 páginasPropiedades de los fluidos y fuerzas hidrostáticasRafael Salcedo50% (2)
- Unidad 3.propiedades Interfaciales y Separación de Fases.Documento20 páginasUnidad 3.propiedades Interfaciales y Separación de Fases.Andre_505Aún no hay calificaciones
- Fundamentos de Quimica y Estequiometria 1 PDFDocumento370 páginasFundamentos de Quimica y Estequiometria 1 PDFAbrahan Estrada100% (1)
- Interfase Liquido - GasDocumento40 páginasInterfase Liquido - GasJhon AyalaAún no hay calificaciones
- Analisis de MercadoDocumento5 páginasAnalisis de MercadopochagatoAún no hay calificaciones
- Vía de Los Ácidos UrónicosDocumento16 páginasVía de Los Ácidos UrónicosHenderson Vasquez Armas67% (3)
- Capitulo Tension Superficial y Adsorcion Fisicoquímica IIIDocumento78 páginasCapitulo Tension Superficial y Adsorcion Fisicoquímica IIIHugo Alberto Otero MontesAún no hay calificaciones
- CAPITULO 3 Fenomenos de SuperficieDocumento121 páginasCAPITULO 3 Fenomenos de Superficieisabel33% (3)
- La Tension Superficial de Los LiquidosDocumento10 páginasLa Tension Superficial de Los LiquidosJose Carlos SanchezAún no hay calificaciones
- Mecanica de Fluidos-2Documento35 páginasMecanica de Fluidos-2David TipanAún no hay calificaciones
- Fisicoquimica AplicadaDocumento64 páginasFisicoquimica AplicadaNicolas Salas WallachAún no hay calificaciones
- 3 Fenómenos de SuperficieDocumento112 páginas3 Fenómenos de SuperficieogreoogreoAún no hay calificaciones
- Ecuación de Gibbs para adsorción en superficies líquidasDocumento11 páginasEcuación de Gibbs para adsorción en superficies líquidasAndy AldamaAún no hay calificaciones
- Cap 3 Fenomenos de SuperficieDocumento132 páginasCap 3 Fenomenos de Superficiedeus07Aún no hay calificaciones
- Informe de Laboratorio Virtual 3Documento20 páginasInforme de Laboratorio Virtual 3erickAún no hay calificaciones
- Tension Superficial, Metodo Del AnilloDocumento11 páginasTension Superficial, Metodo Del Anillosystematicchaos24Aún no hay calificaciones
- Fenomenos de SuperficieDocumento110 páginasFenomenos de SuperficieKnspeisAún no hay calificaciones
- TENSION SUPERFICIAL Teoria!!Documento10 páginasTENSION SUPERFICIAL Teoria!!Elvis Henry MoscosoAún no hay calificaciones
- P2. Tensión SuperficialDocumento8 páginasP2. Tensión SuperficialammggttAún no hay calificaciones
- Fenómenos de interfaz líquido-gasDocumento110 páginasFenómenos de interfaz líquido-gassdyoksAún no hay calificaciones
- Determinación del coeficiente de tensión superficial mediante el método de RayleighDocumento11 páginasDeterminación del coeficiente de tensión superficial mediante el método de RayleighDiego Del CastilloAún no hay calificaciones
- Fenomenos de SuperficieDocumento3 páginasFenomenos de SuperficieLeonardo Medina GermanottaAún no hay calificaciones
- 3) Mecánica de Los Fluidos-Ejercicios 1 Al 29Documento320 páginas3) Mecánica de Los Fluidos-Ejercicios 1 Al 29MilagrosGavilanAún no hay calificaciones
- Clase 24 - Tensión SuperficialDocumento17 páginasClase 24 - Tensión Superficialxiomara valdezAún no hay calificaciones
- Tensión superficial: concepto, causas, propiedades y métodos de mediciónDocumento6 páginasTensión superficial: concepto, causas, propiedades y métodos de mediciónJhon JefferAún no hay calificaciones
- Fenómenos Interfaciales. en Una Fase, Tensión Y Cinética en La Superficie Y Relación Entre Tensión Superficial Y Tensión InterfácialDocumento19 páginasFenómenos Interfaciales. en Una Fase, Tensión Y Cinética en La Superficie Y Relación Entre Tensión Superficial Y Tensión InterfácialEkos RgAún no hay calificaciones
- Interfase Liquido - GasDocumento40 páginasInterfase Liquido - GasDexhuj0% (1)
- Tema 2. Fenómenos Capilares y Proceso de ContracciónDocumento14 páginasTema 2. Fenómenos Capilares y Proceso de ContracciónRené Lindemann Lorenz KruZpeAún no hay calificaciones
- Tension SuperficialDocumento15 páginasTension SuperficialMiriam Guerra RodríguezAún no hay calificaciones
- Informe #7 Tensión SuperficialDocumento6 páginasInforme #7 Tensión SuperficialSantiago MendozaAún no hay calificaciones
- Tension Superficial de TodosDocumento43 páginasTension Superficial de TodosAnalyabrilAún no hay calificaciones
- Tensión SuperficialDocumento7 páginasTensión SuperficialKarin Johanna ColomboAún no hay calificaciones
- Unidad 5 Fisicoquimica 2Documento31 páginasUnidad 5 Fisicoquimica 2Arturo Dominguez AdriaoAún no hay calificaciones
- Determinación del coeficiente de tensión superficial de líquidosDocumento30 páginasDeterminación del coeficiente de tensión superficial de líquidosJhony Chacon Robles0% (1)
- Método Dunoy para medir tensión superficialDocumento6 páginasMétodo Dunoy para medir tensión superficialAnonymous iIaMAfVAún no hay calificaciones
- 3 Tension Superficial 1 1Documento23 páginas3 Tension Superficial 1 1Marcos Orlando Calla CondoriAún no hay calificaciones
- Tensión Superficial y CapilaridadDocumento38 páginasTensión Superficial y Capilaridadfernando benottiAún no hay calificaciones
- Exposicion Hidraulica Unidad 1Documento76 páginasExposicion Hidraulica Unidad 1Jose L Macias HAún no hay calificaciones
- Interfases y Tension InterfacialDocumento11 páginasInterfases y Tension InterfacialKimberly PoronAún no hay calificaciones
- Lab 3 Qui-331 Determinacion Tension Superficial, Hecho Por Adrian MVR 100573987Documento12 páginasLab 3 Qui-331 Determinacion Tension Superficial, Hecho Por Adrian MVR 100573987Adrian Miguel Valerio Rosario100% (1)
- Tension SuperficialDocumento12 páginasTension SuperficialWendyAún no hay calificaciones
- Caratula FIMGMDocumento7 páginasCaratula FIMGMEfrain MendozaAún no hay calificaciones
- TensionDocumento12 páginasTensionJesús HdzAún no hay calificaciones
- Tension SuperficialDocumento5 páginasTension SuperficialHugo Angel VlrAún no hay calificaciones
- Laboratorio de Tension Superficial UNASAMDocumento16 páginasLaboratorio de Tension Superficial UNASAMpanachosaurioAún no hay calificaciones
- Práctica #04Documento12 páginasPráctica #04Luis Rolando Alvarez ChavezAún no hay calificaciones
- Termodinámica de SuperficiesDocumento11 páginasTermodinámica de SuperficiesMirian MartinezAún no hay calificaciones
- Cap. 2 Estatica Fluidos 1aparteDocumento40 páginasCap. 2 Estatica Fluidos 1aparteN. Tintaya YucraAún no hay calificaciones
- HIDROSTATICA (Autoguardado)Documento15 páginasHIDROSTATICA (Autoguardado)Eliseo Chino FenandezAún no hay calificaciones
- Tensión Superficial y CapilaridadDocumento16 páginasTensión Superficial y CapilaridadDiegoMorillasAún no hay calificaciones
- Fenómenos CapilaresDocumento8 páginasFenómenos CapilaresMartinAún no hay calificaciones
- Determinaciones de tensión superficialDocumento25 páginasDeterminaciones de tensión superficialAriana NoeliaAún no hay calificaciones
- 1 Mecánica de FluidosDocumento21 páginas1 Mecánica de FluidosJohan FloresAún no hay calificaciones
- Tensión SuperficialDocumento7 páginasTensión SuperficialHiroaki DarkAún no hay calificaciones
- Capitulo001Mécanica de Fluidos Fisica2Documento24 páginasCapitulo001Mécanica de Fluidos Fisica2RojasJosues0% (2)
- TensionDocumento4 páginasTensionJesus Tadeo SilaAún no hay calificaciones
- Diseño de Reactores para Reacciones ComplejasDocumento12 páginasDiseño de Reactores para Reacciones ComplejasJose Daniel Ballestero MontielAún no hay calificaciones
- Datasheet LGN MergedDocumento93 páginasDatasheet LGN MergedJose Daniel Ballestero MontielAún no hay calificaciones
- Macur 20864528 PDFDocumento2 páginasMacur 20864528 PDFJose Daniel Ballestero MontielAún no hay calificaciones
- Pirólisis de Hidrocarburos - Parte 1Documento39 páginasPirólisis de Hidrocarburos - Parte 1Jose Daniel Ballestero MontielAún no hay calificaciones
- Conclusión DesbloqueadoDocumento1 páginaConclusión DesbloqueadofreshaAún no hay calificaciones
- Datasheet LGNDocumento91 páginasDatasheet LGNJose Daniel Ballestero MontielAún no hay calificaciones
- Diagrama de FlujoDocumento1 páginaDiagrama de FlujoJose Daniel Ballestero MontielAún no hay calificaciones
- UntitledDocumento24 páginasUntitledJose Daniel Ballestero MontielAún no hay calificaciones
- Unidad IIDocumento55 páginasUnidad IIJose Daniel Ballestero MontielAún no hay calificaciones
- Tablas para El 3er ParcialDocumento2 páginasTablas para El 3er ParcialJose Daniel Ballestero MontielAún no hay calificaciones
- Practica 2Documento7 páginasPractica 2Jose Daniel Ballestero MontielAún no hay calificaciones
- Equilibrio de fases en sistemas simples: Potencial químico y energía libre de GibbsDocumento57 páginasEquilibrio de fases en sistemas simples: Potencial químico y energía libre de GibbsJose Daniel Ballestero MontielAún no hay calificaciones
- La Carboquimica: combustible fósil abundante y seguroDocumento30 páginasLa Carboquimica: combustible fósil abundante y seguroJose Daniel Ballestero MontielAún no hay calificaciones
- MVC Y PVCDocumento27 páginasMVC Y PVCJose Daniel Ballestero MontielAún no hay calificaciones
- Humidificacion 1Documento15 páginasHumidificacion 1Jose Daniel Ballestero MontielAún no hay calificaciones
- Solubilidad Mutua del Sistema Fenol-AguaDocumento8 páginasSolubilidad Mutua del Sistema Fenol-AguaJose Daniel Ballestero MontielAún no hay calificaciones
- Clase 3er Parcial AdsorDocumento35 páginasClase 3er Parcial AdsorJose Daniel Ballestero MontielAún no hay calificaciones
- Reportes de La Web Del EstudianteDocumento1 páginaReportes de La Web Del EstudianteJose Daniel Ballestero MontielAún no hay calificaciones
- Olefinas 1 y 2Documento33 páginasOlefinas 1 y 2Jose Daniel Ballestero MontielAún no hay calificaciones
- Seguridad laboratorio FQ-LUZDocumento5 páginasSeguridad laboratorio FQ-LUZJose Daniel Ballestero MontielAún no hay calificaciones
- Tensión superficial ácido acético ecuación Ramsay-ShieldsDocumento6 páginasTensión superficial ácido acético ecuación Ramsay-ShieldsJose Daniel Ballestero MontielAún no hay calificaciones
- Guía I ParcialDocumento5 páginasGuía I ParcialJose Daniel Ballestero MontielAún no hay calificaciones
- Práctica 5Documento50 páginasPráctica 5Jose Daniel Ballestero MontielAún no hay calificaciones
- Termo II EjercicioDocumento9 páginasTermo II EjercicioJose Daniel Ballestero MontielAún no hay calificaciones
- Problema 7.11 ModificadoDocumento19 páginasProblema 7.11 ModificadoJose Daniel Ballestero MontielAún no hay calificaciones
- Ecologia 5Documento15 páginasEcologia 5Jose Daniel Ballestero MontielAún no hay calificaciones
- Guia. II ParcialDocumento9 páginasGuia. II ParcialJose Daniel Ballestero MontielAún no hay calificaciones
- CatalisisDocumento18 páginasCatalisisJose Daniel Ballestero MontielAún no hay calificaciones
- Desactivación de Los CatalizadoresDocumento1 páginaDesactivación de Los CatalizadoresJose Daniel Ballestero MontielAún no hay calificaciones
- Plastico y MetalDocumento35 páginasPlastico y MetalAyme AsprillaAún no hay calificaciones
- Tesis Doctoral - Zaira MartínDocumento198 páginasTesis Doctoral - Zaira MartínHectorAún no hay calificaciones
- Orificios y Boquillas 2Documento12 páginasOrificios y Boquillas 2CollazemosAún no hay calificaciones
- Guia. Biomoleculas OrganicasDocumento13 páginasGuia. Biomoleculas OrganicasICP SERVICESAún no hay calificaciones
- Fichas de Datos de Seguridad Acetileno IndustrialDocumento7 páginasFichas de Datos de Seguridad Acetileno IndustrialCamilo OrtegaAún no hay calificaciones
- Catabolismo energía ATP respiraciónDocumento5 páginasCatabolismo energía ATP respiraciónJosé MiguelAún no hay calificaciones
- Cuestionario Farmacología CompletoDocumento8 páginasCuestionario Farmacología CompletoLourdes MendietaAún no hay calificaciones
- Desinfección de ImpresionesDocumento32 páginasDesinfección de ImpresionesViviana Montero MenaAún no hay calificaciones
- Especificaciones Tecnicas de II - EeDocumento20 páginasEspecificaciones Tecnicas de II - EelquillamoronAún no hay calificaciones
- Bioreductor de ViscosidadDocumento8 páginasBioreductor de ViscosidadYalil Shideni Maldonado PerezAún no hay calificaciones
- Quiz - API 1104 - 20120615Documento2 páginasQuiz - API 1104 - 20120615Mario MolinaAún no hay calificaciones
- Pasta estuco hormigón reparacionesDocumento1 páginaPasta estuco hormigón reparacionesCarito Alvarez LabbéAún no hay calificaciones
- Mem. Desc. CAO RS Aventuranza 08.set.2020Documento55 páginasMem. Desc. CAO RS Aventuranza 08.set.2020Javier Ramirez VeraAún no hay calificaciones
- Partes Constitutivas de TurbinasDocumento60 páginasPartes Constitutivas de TurbinasAlejandro Sánchez AnduagaAún no hay calificaciones
- Ua 3 Temas #5 y 6 Nomenclatura y Reacciones QuimicasDocumento38 páginasUa 3 Temas #5 y 6 Nomenclatura y Reacciones QuimicasMonografia MoreroAún no hay calificaciones
- Guía MineralogíaDocumento26 páginasGuía Mineralogíaturbio15Aún no hay calificaciones
- Sistema de Tratamiento de Agua Potable Seda HuanucoDocumento76 páginasSistema de Tratamiento de Agua Potable Seda HuanucoBryan Cortez100% (1)
- Servicio de agua y saneamiento en PillonaDocumento57 páginasServicio de agua y saneamiento en PillonaDarwin PerezAún no hay calificaciones
- ACTIVIDAD DE APRENDIJE Nuero 4 Guia # 7Documento7 páginasACTIVIDAD DE APRENDIJE Nuero 4 Guia # 7Alejandra HernandezAún no hay calificaciones
- Manual Ptap TurboDocumento20 páginasManual Ptap TurboRommel CuastumalAún no hay calificaciones
- Materiales de de Mecanica BasicaDocumento11 páginasMateriales de de Mecanica BasicaFrank A. CnzAún no hay calificaciones
- Practica OsmosisDocumento6 páginasPractica OsmosisJhonatan Santos MartínezAún no hay calificaciones
- La RosettaDocumento2 páginasLa Rosettaantonio minchilloAún no hay calificaciones
- Nanofiltros SELDONDocumento11 páginasNanofiltros SELDONLuis Eduardo MayaAún no hay calificaciones