Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Supongamos Que Pretendemos Llevar A Cabo A Temperatura Elevada Una Reacción Que Es Suavemenete Exotérmica A 298
Cargado por
Estuardo Chacon0 calificaciones0% encontró este documento útil (0 votos)
13 vistas5 páginasTítulo original
Supongamos que pretendemos llevar a cabo a temperatura elevada una reacción que es suavemenete exotérmica a 298
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
13 vistas5 páginasSupongamos Que Pretendemos Llevar A Cabo A Temperatura Elevada Una Reacción Que Es Suavemenete Exotérmica A 298
Cargado por
Estuardo ChaconCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
Supongamos que pretendemos llevar a cabo a temperatura elevada una reacción que es
suavemenete exotérmica a 298.15 K. ¿La reacción es endotérmica o exotérmica a temperatura
elevada? Para responder a esta pregunta, es necesario determinar a Hreacción engel_cap04.qxp
16/07/2006 19:08 Página 70 www.FreeLibros.org 4.4 Dependencia de las entalpías de reacción con
la temperatura 71 # Au: Engel / Reid Pg. No. 71 Título: Química Física. Traducción : Requena /
Zuñiga / Bastida C/M/Y/K Short / Normal / Long PROBLEMA EJEMPLO 4.2 Calcule la entalpía de
formación del HCl(g) a 1450 K y 1 bar de presión, sabiendo que = 292.3 kJ mol-1 a 298.15 K y en
este intervalo de temperatura. Los cocientes aparecen en estas ecuaciones para que la capacidad
calorífica tenga las unidades correctas. Solución Por definición, la reacción de formación se escribe
como 1/2 H2 (g)+1/2 Cl2 (g) → HCl(g) y C T dT ,1450 298 15 P 298 15 1450 o + . ∫ . ( ) ΔH f f , º ΔH º
K = K T T Ky K 22 C g T P m, ( ,) . . . o HCl K = +× + × − − 28 165 1 809 10 15 464 10 3 7 2 2 T K ⎛ ⎝ ⎜
⎞ ⎠ ⎟ − − J K mol 1 1 C g T P m, ( ,) . . . o Cl K 2 3 = +× −× 31 695 10 143 10 40 373 10 − − −− ⎛ ⎝ ⎜
⎞ ⎠ ⎟ 7 2 2 T K J K mol 1 1 C g T P m, ( ,) . . . o H K 2 3 = −×+× 29 064 0 8363 10 20 111 10 − −7 2 2 T
K J K mol 1 1 ⎛ ⎝ ⎜ ⎞ ⎠ ⎟ − − H g f o ( ,) HCl temperatura elevada. Suponemos que no ocurren
cambios de fase en el intervalo de temperatura de interés. La entalpía de cada reactante y
producto a la temperatura T está relacionada con su valor a 298.15 K mediante la Ecuación (4.22),
que tiene en cuenta la energía suministrada para a calentar la sustancia hasta la nueva
temperatura a presión constante: (4.22) La prima en la integral indica una “variable muda” que,
por lo demás, es igual a la temperatura. Esta notación es necesaria porque T aparece en el límite
superior de la integral. En la Ecuación (4.22), es la entalpía absoluta a 1 bar y 298.15 K. Sin
embargo, como no hay valores únicos de las entalpías absolutas, es útil combinar las ecuaciones
similares de los reactantes y productos con el fin de obtener la siguiente ecuación para la entalpía
de reacción a la temperatura T: (4.23) donde (4.24) En esta Ecuación, la suma se extiende a
reactantes y productos incluyendo tanto elementos como compuestos. Los elementos deben
incluirse, ya que solamente para un elemento en el estado estándar a la temperatura 298.15 K, y .
En el Problema Ejemplo 4.2 mostramos un cálculo de a temperatura elevada. Hreacción C T P,i( ) ≠
0 H f o = 0 C T vC T p i p i i () () , ′ =∑ ′ C T dT T ′ ′ ∫ 298 15 298 15 . . K ( ) K ΔH reacción,T º = ΔH
reacción º , + H298 15 . K o H H C T dT T P T o o = + ′ ′ 298 15 ∫ 298 15 . . ( ) K K engel_cap04.qxp
16/07/2006 19:08 Página 71 www.FreeLibros.org 72 C A P Í T U L O 4 Termoquímica # Au: Engel /
Reid Pg. No. 72 Título: Química Física. Traducción : Requena / Zuñiga / Bastida C/M/Y/K Short /
Normal / Long En este caso particular, el cambio en la entalpía de reacción no es grande. Esto es
debido a que es pequeña, aunque no lo sean las individuales. C T P,i( ) C T o P o ( ) H T 1450K 3 2
215 2 844 10 2 o = − + − − × + − − 92.3 kJ mol K 1 . . 5 595 10 7 2 2 298 15 1450 . . × ⎛ ⎝ ⎜ ⎞ ⎠ ⎟ ×
= − − ∫ T d T K K J mol 1 −− − −− − 92.3 kJ mol 2.836 kJ mol = 95.1kJ mol 11 1 C T T T P o () . . = +× + ×
. − − 28 165 1 809 10 15 464 10 3 7 2 K K2 ⎡ ⎣ ⎢ − −×+× − − K 1 2 29 064 0 8363 10 20 111 10 3 7 2 .. .
T T K K 2 3 1 2 31 695 10 143 10 40 373 1 ⎛ ⎝ ⎜ ⎞ ⎠ ⎟ − +× −× − .. . T 0 2 7 2 2 − −− ⎛ ⎝ ⎜ ⎞ ⎠ ⎟
⎤ ⎦ ⎥ = − T K J K mol 1 1 . . 215 2 844 10 25 595 10 . 3 7 2 2 −× + × ⎛ ⎝ ⎜ ⎞ ⎠ ⎟ − − T T K K J K− − 1 1
mol 4.5 Determinación experimental de ΔU y ΔH en las reacciones químicas Para las reacciones
químicas, y se determinan, generalmente, a través de experimentos. En esta sección, discutimos
cómo se llevan a cabo estos experimentos. Si alguno o todos los reactantes o productos son
volátiles, es necesario retener la mezcla de reacción para la que queremos medir y . Un
experimento tal se puede llevar a cabo en una bomba calorimétrica, mostrada esquemáticamente
en el Figura 4.3. En una bomba calorimétrica, la reacción tiene lugar a volumen constante. El
motivo de hacerlo así es que si dV = 0, . Por tanto, una medida del flujo de calor proporciona una
medida directa de . La utilización de la bomba calorimétrica está restringida a mezclas de reacción
que contengan gases, debido a que es impracticable llevar a cabo reacciones químicas a volumen
constante en sistemas que consten únicamente de líquidos y sólidos, como se mostró en el
Problema Ejemplo 3.2. ¿Cómo se determinan y en un experimento así? La bomba calorimétrica es
una buena ilustración de cómo se puede definir el sistema y el medio para simplificar el análisis de
un experimento. El sistema se define como el contenido de un vaso presurizado de paredes
gruesas de acero inoxidable, el mismo vaso presurizado y el baño de agua interno. Dada esta
definición del sistema, el medio consiste en el contenedor que mantiene el baño de agua interno,
la parte exterior del baño y el resto del universo. El contenedor que encierra al baño de agua
interno está inmerso en un baño de agua externo cuya temperatura se mantiene siempre a la
temperatura del baño interno a través de un calentador. Por tanto, no habrá flujo de calor entre el
sistema y el medio, y q = 0. Como el experimento tiene lugar a volumen constante, w= 0. Por
tanto, = 0. Estas condiciones describen un sistema aislado de tamaño finito que no está acoplado
al resto del universo. Solamente estamos interesados en una parte de este sistema, a saber, la
mezcla de reacción. ¿Cuáles son los componentes individuales que constituyen ? Consideremos el
sistema consistente en tres subsistemas: los reactantes en el calorímetro, el vaso del calorímetro y
el baño de agua interno. Estos tres subsistemas están separados por paredes diatérmicas rígidas y
están en equilibrio térmico. La energía se redistribuye en los subsistemas a través de los procesos
siguientes. Los reactantes se convierten en productos, la energía del baño de agua interno se
modifica por el cambio de temperatura, , y lo mismo es cierto para el calorímetro. T U U Hreacción
U reacción Ureacción U qV = U H U H engel_cap04.qxp 16/07/2006 19:08 Página 72
www.FreeLibros.org 4.5 La determinación experimental de ΔU y ΔH para reacciones químicas 73 #
Au: Engel / Reid Pg. No. 73 Título: Química Física. Traducción : Requena / Zuñiga / Bastida C/M/Y/K
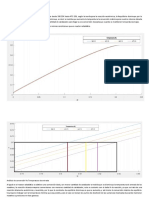
Short / Normal / Long Conexión eléctrica para ignición Agitador Termómetro Contenedor
diatérmico Baño de agua interno Recipiente de acero Reactantes en el vaso de reacción FIGURA
4.3 Diagrama esquemático de una bomba calorimétrica. La muestra líquida o sólida se sitúa en una
cubeta suspendida en el recipiente de acero de paredes gruesas, que está lleno de O2 gaseoso. El
vaso está inmerso en un baño de agua interno y su temperatura está monitorizada. El contenedor
diatérmico está inmerso en otro baño de agua externo (no mostrado) cuya temperatura se
mantiene al mismo valor que el baño interno mediante un calentador. Haciendo esto, no hay
intercambio de calor entre el baño de agua interno y el resto del universo. PROBLEMA EJEMPLO
4.3 Cuando 0.972 g de ciclohexano sufren una combustión completa en una bomba calorimétrica,
del baño de agua interno es 2.98°C. Para el ciclohexano, es -3913 kJ mol-1. Dado este resultado,
¿cuál es el valor de para la combustión del benceno si es 2.36°C cuando 0.857 g de benceno sufren
una combustión completa en el mismo calorímetro? La masa de agua en el baño interno es 1.812
× 103 g, y la CP,m del agua es 75.291 J K-1 mol-1. U T reacción m, Ureacción m, T (4.25) En la
Ecuación (4.25), es el cambio de temperatura del baño de agua interno. La masa de agua del baño
interno, su peso molecular, , su capacidad calorífica, , y la masa de la muestra, , y su peso
molecular, , son conocidos. Nuestro interés se centra en determinar . Sin embargo, para
determinar , debe determinarse primeramente la capacidad calorífica del calorímetro,
Ccalorímetro,llevando a cabo una reacción para la que se conozca , como se ilustra en el Problema
Ejemplo 4.3. En concreto, vamos a considerar una reacción de combustión entre un compuesto y
un exceso de O2 : Ureacción m, Ureacción m, Ucombustión m, CH O m ms Ms 2 , MH O2 mH O2
T U m M U m M C TC s s reacción m H O H O H O m cal =+ + , , 2 2 2 orímetroT = 0
engel_cap04.qxp 16/07/2006 19:08 Página 73 www.FreeLibros.org 74 C A P Í T U L O 4
Termoquímica # Au: Engel / Reid Pg. No. 74 Título: Química Física. Traducción : Requena / Zuñiga /
Bastida C/M/Y/K Short / Normal / Long Solución Para calcular la constante del calorímetro
mediante la combustión del ciclohexano escribimos la Ecuación (4.25) de la siguiente forma: Para
calcular para el benceno, usamos el valor de Ccalorímetro: U M m m M reacción C TC s s H O H O
H O m caloríme = − + 2 2 2 , troT ⎛ ⎝ ⎜ ⎞ ⎠ ⎟ = − × × − 78.12gmol 0.857 g 1.812 10 g 1 3
18.02gmol 75.291 Jmol K 2.36 C 7.59 1 11 o − − − × × + × × ⎛ ⎝ ⎜ ⎜ ⎞ ⎠ ⎟ ⎟ =− × − 10 J C) 2.36 C
3.26 10 Jmol 3o 1 o 6 ( −1 Ureacción C m M U m M C calorímetro s s reacción H O H O H O = − − 2
2 2 ,m T T 0.972g 84.16gmol 3913 1 = × − × − × × − − 10 Jmol 1.812 10 g 18.02gmol 75.291 J 3 1 3
1 mol K 2.98 C 2.98 C 7.59 11 o o − − × = ×10 J ( C) 3o 1− Una vez que se ha determinado se puede
determinar usando la siguiente ecuación: (4.26) Para reacciones que solamente involucran a
sólidos y líquidos, y . Si alguno de los reactatntes o productos son gases, se puede ignorar el
pequeño cambio de temperatura que se produce en el experimento del calorímetro y de modo
que (4.27) donde es el cambio en el número de moles de gas de la reacción global. Para la primera
reacción del Problema Ejemplo 4.3, C6 H12(l) + 9O2 (g) → 6CO2 (g) + 6H2 O(l) (4.28) y = 23. Nótese
que a T = 298.15 K, las forma más estable del ciclohexano y del agua es la líquida. (4.29) Para esta
reacción, y difieren tan sólo en un 0.2%. Si la reacción bajo estudio no implica gases o líquidos
altamente volátiles, no hay necesidad de operar bajo condiciones de volumen constante. Es
preferible llevar a cabo la reacción a P constante, y se determina directamente porque = qP. Un
vaso aislado mediante vacío por un tapón que ajusta fácilmente, como se muestra en la Figura 4.4
es adecuado en muchos casos y se puede tratar como un sistema compuesto aislado. La Ecuación
(4.25) toma la siguiente forma para un calorímetro a presión constante que trata la disolución de
una sal en agua: H (4.30) m M H m M reacción C s s solución m H O H O H O = + , , 2 2 2 m
calorímetro TC T + = 0 Hreacción H reacción Ureacción H reacción H U RT reacción reacción =
− =− × 3 3913 10 kJmol 3 − −− − × × =− × 1 1 1 3 3 8.314 J K mol 298.15 K 3920 10 Jmol−1 n n H U
nRT reacción reacción = + () ( ) PV = = nRT nRT H U ≈ U >> ( ) PV HU P reacción reacción = + ( )
V U H engel_cap04.qxp 16/07/2006 19:08 Página 74 www.FreeLibros.org 4.6 Calorimetría de
barrido diferencial 75 # Au: Engel / Reid Pg. No. 75 Título: Química Física. Traducción : Requena /
Zuñiga / Bastida C/M/Y/K Short / Normal / Long Termómetro H2O Tapón Sal Disolución FIGURA
4.4 Diagrama esquemático de un calorímetro a presión constante, adecuado para medir la
entalpía de disolución de una sal. PROBLEMA EJEMPLO 4.4 La entalpía de disolución para la
reacción Na2 SO4 (s) + H2 O(l) → 2Na+(aq) + SO4 2-(aq) se determina en un calorímetro a presión
constante. La constante del calorímetro que se determinó fue 342.5 J K-1. Cuando se disuelven
1.423 g de Na2 SO4 en 100.34 g de H2 O(l), = 0.037 K. Calcule para el Na2 SO4 a partir de estos
datos. Compare los resultados obtenidos con los calculados usando las entalpías de formación
estándar de la Tabla 4.1 (Apendice B, Tablas de datos) y la Tabla 10.1 del Capítulo 10. Solución A
continuación calculamos ΔH° disolución usando las tablas de datos. El acuerdo entre los resultados
calculados y los experimentales es satisfactorio. H H aq H aq H disolucíón f f oo o = +− + − 2 ( ,) ( ,)
Na SO4 2 f s o ( ,) ( Na SO 2 240.1kJ mol 2 1 4 = ×− − ) − + = − − − − 909.3 kJ mol 1387.1 kJ mol 2.4 kJ
mol 1 1 1 H M m m M disolución, m C TC s s H O H O H O m calorí , o = − + 2 2 2 metroT ⎛ ⎝ ⎜ ⎞ ⎠
⎟ = − × − 142.04 gmol 1.423 g 100.34 1 g 18.02 gmol 75.3 JK mol 0.037 K 34 1 1 1 − − − × × + 2.5 JK
0.037 K 2.8 10 Jmol 1 3 1 − − × ⎛ ⎝ ⎜ ⎜ ⎞ ⎠ ⎟ ⎟ =− × Hm T 4.6 Calorimetría de barrido
diferencial Los calorímetros de volumen constante y presión constante descritos en la Sección
precedente son adecuados para medir muestras individuales. Supongamos que es necesario
determinar la entalpía de fusión de una docena de materiales sólidos relacionados, y que
disponemos de una pequeña cantidad de cada uno de ellos. Como los experimentos se llevan a
cabo individualmente, los calorímetros a presión constante o volumen constante no son
adecuados para una determinación rápida de las propiedades termodinámicas de una serie de
materiales. La técnica elegida para estas medidas es la calorimetría de barrido diferencial. En la
Figura 4.5 se muestra esquemáticamente el aparato experimental para tales medidas. La palabra
diferencial aparece en el nombre de la técnica debido a que la lectura del calor se mide relativa a
la del material de referencia y barrido se refiere al hecho de que la temperatura de la muestra
varía linealmente con el tiempo. La temperatura del cilindro cerrado se incrementa linealmente
con el tiempo, usando una alimentación adicional.El calor fluye del recinto cerrado a través del
disco a la muestra, debido al gradiente de temperatura generado por el calentador. Como todas
las muestras y la referencia equidistan del recinto cerrado, el calor que fluye a cada muestra es el
mismo. El material de referencia se elige de forma que su punto de fusión no se encuentre en el
intervalo del de las muestras. La diferencia de temperatura medida entre una muestra y la
referencia, , es proporcional a la diferencia en la velocidad de toma del calor por la muestra y la
referencia: T (4.31) dq dt dq dt dq dt P referencia muestra = / = / − ⎛ / ⎝ ⎜ ⎞ ⎠ a a ⎟ T Nótese
que en este caso el agua del vaso de reacción que lo rodea es parte de la mezcla de reacción.
Como es despreciable para la disolución de una sal en un disolvente, . Se debe agitar la disolución
para asegurar que se alcanza el equilibrio antes de medir . T U H disolución = disolución ( ) PV
engel_cap04.qxp 16/07/2006 19:08 Página 75 www.FreeLibros.org 76 C A P Í T U L O 4
Termoquímica # Au: Engel / Reid Pg. No. 76 Título: Química Física. Traducción : Requena / Zuñiga /
Bastida C/M/Y/K Short / Normal / Long Termopar de la muestra Termopar de la referencia
Muestra Referencia q q T Tiempo Tapón Calentador de resistencia Disco soporte Alimentación ΔT
FIGURA 4.5 Un calorímetro de barrido diferencial consiste en un recinto grande y un tapón que se
calientan a la temperatura T, usando una resistencia. Un disco soporte, con buen contacto térmico
con el recinto soporta múltiples muestras y el material de referencia. La temperatura de cada una
de las muestras se mide con un termopar. dq dt Tiempo FIGURA 4.6 A temperaturas diferentes de
la de fusión, la velocidad con la que toman el calor la muestra y la referencia son casi idénticas. Sin
embargo, al tiempo correspondiente a T = Tfusión, la velocidad de toma del calor por la muestra
difiere significativamente de la de referencia. El retardo cinético debido a las velocidades finitas de
conducción del calor ensancha la forma de la transición de fusión en un intervalo finito. donde es
una constante del calorímetro que se determina experimentalmente. En el intervalo de
temperatura en el que no hay cambio de fase, ~ 0. Sin embargo, conforme una muestra funde,
toma más calor que la referencia y su temperatura permanece constante mientras que la de
referencia aumenta. La diferencia de temperatura entre la muestra y la referencia en función del
tiempo tiene la forma que se muestra en la Figura 4.6. Como se conoce la relación entre el tiempo
y la temperatura, la escala de tiempo puede convertirse a una escala de temperatura. Dado que la
muestra tiene un punto de fusión bien conocido, ¿por qué es ancho el pico de la Figura 4.6? El
sistema experimenta un retardo cinético debido a que el flujo de calor a través del disco no es
instantáneo. Por tanto, la función determinada experimentalmente tiene una anchura finita y la
forma de una curva gausiana. Como el eje vertical es y el eje horizontal es el tiempo, la integral del
área bajo la curva es (4.32) Por tanto, se puede averiguar determinando el área bajo la curva que
representa los datos de salida. La ventaja significativa de la calorimetría de barrido diferencial
sobre la calorimetría a presión constante o a volumen constante es la posibilidad de trabajar con
pequeñas cantidades de muestra. Como se ve en la Figura 4.5, el aparato que se muestra está
limitado para trabajar con sólidos y líquidos en los que se da un cambio de fase. Por ejemplo, la
técnica se ha empleado para determinar el intervalo de temperatura en el que las proteínas sufren
cambios conformacionales asociados a la desnaturalización. H fusión ⎛ / ⎝ ⎜ ⎞ ⎠ ⎟ = = ∫ dq dt dt
q H P P dq dt / P dq dt / P T a Vocabulario bomba calorimétrica calorímetría de barrido diferencial
calorímetro a presión constante endotérmico energía de enlace entalpía de enlace entalpía de
formación entalpía de fusión entalpía de reacción exotérmica estado estándar ley de Hess
engel_cap04.qxp 16/07/2006 19:08 Página 76 www.FreeLibro
También podría gustarte
- Tema 4 Sol PDFDocumento24 páginasTema 4 Sol PDFDarkflow33% (3)
- Unidad 5 Termofisica y TermoquimicaDocumento13 páginasUnidad 5 Termofisica y TermoquimicaChristian Paul Fausto Ruiz100% (1)
- Reporte Práctica 3. CalorimetriaDocumento4 páginasReporte Práctica 3. CalorimetriaSebastianAún no hay calificaciones
- Definiciones termodinámicas básicasDocumento21 páginasDefiniciones termodinámicas básicasDiana AvilaAún no hay calificaciones
- Practica 1 Quimica IndustrialDocumento20 páginasPractica 1 Quimica IndustrialAreely Alvaarez100% (2)
- Taller No. 3. Segunda Ley, Máquinas Térmicas y EntropíaDocumento2 páginasTaller No. 3. Segunda Ley, Máquinas Térmicas y EntropíaMiguelSalgado50% (2)
- Problemario de Termodinamica BasicaDocumento10 páginasProblemario de Termodinamica BasicaGuillen Morales M.Aún no hay calificaciones
- Solubilidad Del Ibuprofeno en Varias Mezclas de CosolventesDocumento14 páginasSolubilidad Del Ibuprofeno en Varias Mezclas de CosolventesCatalina PérezAún no hay calificaciones
- APLICACIONES de LAS ED - Resolucion de ProblemasDocumento5 páginasAPLICACIONES de LAS ED - Resolucion de ProblemasPEDRO LUIS BOZA SULLCAAún no hay calificaciones
- Determinación calor reacción ley HessDocumento14 páginasDeterminación calor reacción ley HessmiltonAún no hay calificaciones
- Termo QuimicaDocumento9 páginasTermo QuimicaKevin AquinoAún no hay calificaciones
- Laboratorio Nº8Documento13 páginasLaboratorio Nº8Armando Ibarra FernandezAún no hay calificaciones
- Influencia de La Temperatura Sobre La Velocidad de Reaccióninfluencia de La Temperatura Sobre La Velocidad de ReacciónDocumento14 páginasInfluencia de La Temperatura Sobre La Velocidad de Reaccióninfluencia de La Temperatura Sobre La Velocidad de ReacciónarteagapatyAún no hay calificaciones
- BE 2006 4 Calor LatenteDocumento15 páginasBE 2006 4 Calor LatenteJavier RivmatamAún no hay calificaciones
- Informe 3 FisicoquimicaDocumento5 páginasInforme 3 FisicoquimicaValentina Soto ValenciaAún no hay calificaciones
- U1901 Guia de Trabajos Prácticos Módulo III y IV 2020Documento22 páginasU1901 Guia de Trabajos Prácticos Módulo III y IV 2020Sebastian Lizarazo SotoAún no hay calificaciones
- Clase 5 TermoquimicaDocumento44 páginasClase 5 TermoquimicaFERNANDA RIVERAAún no hay calificaciones
- TP3 - Propiedades Termoquímicas de Reacciones y Compuestos InorgánicosDocumento8 páginasTP3 - Propiedades Termoquímicas de Reacciones y Compuestos InorgánicosAlejandro FloresAún no hay calificaciones
- Determinacion Calor de Formacion Del Ch3coona SergioDocumento13 páginasDeterminacion Calor de Formacion Del Ch3coona SergioGerson Oswaldo Diaz ContrerasAún no hay calificaciones
- Calor de CombustiónDocumento4 páginasCalor de CombustiónFelipe MunarAún no hay calificaciones
- Unidad 5 Termoquimica 530.011Documento33 páginasUnidad 5 Termoquimica 530.011Paula PaivaAún no hay calificaciones
- Practica 2 Quimica IndustrialDocumento5 páginasPractica 2 Quimica IndustrialRoberto Viquez100% (1)
- Laboratorio Nº11Documento15 páginasLaboratorio Nº11natalyAún no hay calificaciones
- Entalpia de CombustionDocumento16 páginasEntalpia de CombustionPilar AstoAún no hay calificaciones
- TermoquimicaDocumento12 páginasTermoquimicaV Mendizabal JocelynAún no hay calificaciones
- Protocolo No.01 Calor de NeutralizaciónDocumento18 páginasProtocolo No.01 Calor de NeutralizaciónJhordana EscribaAún no hay calificaciones
- TERMOQUIMICADocumento10 páginasTERMOQUIMICAShirley Chavez RubioAún no hay calificaciones
- Entalpía de combustión del naftalenoDocumento14 páginasEntalpía de combustión del naftalenoWilliam Anderson Muñoz OcampoAún no hay calificaciones
- Calorimetría y conceptos termodinámicosDocumento15 páginasCalorimetría y conceptos termodinámicoslina marcela arias jaramilloAún no hay calificaciones
- LT. Reporte N°6. Entalpía de Transformación. Brigada N°1. Grupo 17. Semestre 2023-2Documento9 páginasLT. Reporte N°6. Entalpía de Transformación. Brigada N°1. Grupo 17. Semestre 2023-2Rosas Pérez Erika ArlethAún no hay calificaciones
- Práctica #09 Determinacion de La Entalpia de Vaporizacion de LiquidosDocumento13 páginasPráctica #09 Determinacion de La Entalpia de Vaporizacion de LiquidosRAMOS OLLACHICA MARYORI JENNIFERAún no hay calificaciones
- 3er Laboratorio de FisicoquimicaDocumento13 páginas3er Laboratorio de FisicoquimicaElizabeth Troncos100% (1)
- Definición de EntalpiaDocumento7 páginasDefinición de EntalpiaHEyarEKAún no hay calificaciones
- BE 2006 3 Capacidad CalorificaDocumento17 páginasBE 2006 3 Capacidad CalorificaJavier RivmatamAún no hay calificaciones
- Ley de Hess (Termodinamica)Documento12 páginasLey de Hess (Termodinamica)Arnold José Aguas ZuñigaAún no hay calificaciones
- Guion Laboratorio TyC NyNDocumento12 páginasGuion Laboratorio TyC NyNRocio Alba paciosAún no hay calificaciones
- Ilovepdf MergedDocumento23 páginasIlovepdf MergedRocio Alba paciosAún no hay calificaciones
- Termoquímica: Calor de NeutralizaciónDocumento11 páginasTermoquímica: Calor de NeutralizaciónLEONARDO ALCIDES ROMERO ZAPANAAún no hay calificaciones
- Analisis CuantitativoDocumento8 páginasAnalisis CuantitativoEVCAún no hay calificaciones
- La Termoquímica Es La Rama de La Termodinámica Que Investiga El Flujo de Calor Hacia Dentro o Hacia Fuera en Un Sistema en Reacción y Deduce La Energía Almacenada en Los Enlaces QuímicosDocumento6 páginasLa Termoquímica Es La Rama de La Termodinámica Que Investiga El Flujo de Calor Hacia Dentro o Hacia Fuera en Un Sistema en Reacción y Deduce La Energía Almacenada en Los Enlaces QuímicosEstuardo ChaconAún no hay calificaciones
- Reacción de FormaciónDocumento3 páginasReacción de FormaciónPao AcostaAún no hay calificaciones
- TERMOQUIMICADocumento5 páginasTERMOQUIMICAChuck BartowskyAún no hay calificaciones
- TERMOQUIMICADocumento20 páginasTERMOQUIMICAMerinoAlvan75% (8)
- Auto Evaluacion de La Unidad 2Documento10 páginasAuto Evaluacion de La Unidad 2Flor TinocoAún no hay calificaciones
- Problemas de Termodinámica: Trabajo de Frontera y Análisis de Energía en Sistemas Cerrados.Documento3 páginasProblemas de Termodinámica: Trabajo de Frontera y Análisis de Energía en Sistemas Cerrados.Miguel L. ToledanoAún no hay calificaciones
- Taller TermodinámicaDocumento1 páginaTaller TermodinámicaAlejandro PerezAún no hay calificaciones
- Reporte Practica 3 Quimica IndustrialDocumento9 páginasReporte Practica 3 Quimica IndustrialMeliPmAún no hay calificaciones
- Aplicacion Termoquimica PDFDocumento20 páginasAplicacion Termoquimica PDFAnonymous hEjq4P3LAún no hay calificaciones
- Guia de Trabajos Prácticos 2do Módulo 2do Semestre 2018Documento23 páginasGuia de Trabajos Prácticos 2do Módulo 2do Semestre 2018genaradolores texeiraAún no hay calificaciones
- Lab 8 II FisicoquimicaDocumento23 páginasLab 8 II FisicoquimicaGustavo CondarcoAún no hay calificaciones
- Termoquimica Discusion Conclusiones CuestionarioDocumento4 páginasTermoquimica Discusion Conclusiones CuestionarioJavierTarazona100% (1)
- Calorimetría y termoquímica: medición y cálculo de entalpíasDocumento16 páginasCalorimetría y termoquímica: medición y cálculo de entalpíasAlejandro Concha SalazarAún no hay calificaciones
- Practica 3Documento6 páginasPractica 3Shukopopsita EmolotikaAún no hay calificaciones
- Practica 2 QUIMICA APLICADA ESIME ZACATENCODocumento9 páginasPractica 2 QUIMICA APLICADA ESIME ZACATENCOBraay FragooAún no hay calificaciones
- Informe #3 Calor 2Documento9 páginasInforme #3 Calor 2LeiraleAún no hay calificaciones
- Tarea 1 - Termodinámica y Soluciones - Grupo - 201604A - 611Documento31 páginasTarea 1 - Termodinámica y Soluciones - Grupo - 201604A - 611Maria Del Rosario0% (1)
- Tarea 1 - Termodinámica y Soluciones.Documento43 páginasTarea 1 - Termodinámica y Soluciones.CG Alex0% (1)
- Calor de NeutralizacionDocumento7 páginasCalor de NeutralizacionAlán López0% (3)
- 23-I P-4 Calor de NeutralizacíonDocumento10 páginas23-I P-4 Calor de NeutralizacíonbrnpayaAún no hay calificaciones
- Asignacion Principios FinalDocumento16 páginasAsignacion Principios Finalferjun1000Aún no hay calificaciones
- 06 TermoquímicaDocumento19 páginas06 TermoquímicaJeferson Maguiña EmAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Movimiento Flagelar El Flagelo Es Un Pequeño Motor de RotaciónDocumento11 páginasMovimiento Flagelar El Flagelo Es Un Pequeño Motor de RotaciónEstuardo ChaconAún no hay calificaciones
- Sobre La Base de Estos Experimentos y de Otros Sobre El Agente Causante de La TuberculosisDocumento10 páginasSobre La Base de Estos Experimentos y de Otros Sobre El Agente Causante de La TuberculosisEstuardo ChaconAún no hay calificaciones
- Aumento y Resolución El Aumento Total de Un Microscopio de Luz Compuesto Es El ProDocumento6 páginasAumento y Resolución El Aumento Total de Un Microscopio de Luz Compuesto Es El ProEstuardo ChaconAún no hay calificaciones
- Sobre La Base de Estos Experimentos y de Otros Sobre El Agente Causante de La TuberculosisDocumento10 páginasSobre La Base de Estos Experimentos y de Otros Sobre El Agente Causante de La TuberculosisEstuardo ChaconAún no hay calificaciones
- Aumento y Resolución El Aumento Total de Un Microscopio de Luz Compuesto Es El ProDocumento6 páginasAumento y Resolución El Aumento Total de Un Microscopio de Luz Compuesto Es El ProEstuardo ChaconAún no hay calificaciones
- Determinacion Problema MayoDocumento9 páginasDeterminacion Problema MayoEstuardo ChaconAún no hay calificaciones
- Estructuras de La Superficie Celular Muchos Procariotas Secretan A La Superficie Celular Materiales Pegajosos o Viscosos Formados Por Polisacáridos o Por ProteíDocumento9 páginasEstructuras de La Superficie Celular Muchos Procariotas Secretan A La Superficie Celular Materiales Pegajosos o Viscosos Formados Por Polisacáridos o Por ProteíEstuardo ChaconAún no hay calificaciones
- Estructuras de La Superficie Celular Muchos Procariotas Secretan A La Superficie Celular Materiales Pegajosos o Viscosos Formados Por Polisacáridos o Por ProteíDocumento9 páginasEstructuras de La Superficie Celular Muchos Procariotas Secretan A La Superficie Celular Materiales Pegajosos o Viscosos Formados Por Polisacáridos o Por ProteíEstuardo ChaconAún no hay calificaciones
- Movimiento Flagelar El Flagelo Es Un Pequeño Motor de RotaciónDocumento11 páginasMovimiento Flagelar El Flagelo Es Un Pequeño Motor de RotaciónEstuardo ChaconAún no hay calificaciones
- Es Una Demostración de La Ley de HessDocumento7 páginasEs Una Demostración de La Ley de HessEstuardo ChaconAún no hay calificaciones
- Desviaciones de La IdealidadDocumento2 páginasDesviaciones de La IdealidadEstuardo ChaconAún no hay calificaciones
- Cuaderno 5 BQDocumento7 páginasCuaderno 5 BQEstuardo ChaconAún no hay calificaciones
- Es Una Demostración de La Ley de HessDocumento7 páginasEs Una Demostración de La Ley de HessEstuardo ChaconAún no hay calificaciones
- Pero Se Mueve Durante La Expansión de Forma Que Continúa inDocumento6 páginasPero Se Mueve Durante La Expansión de Forma Que Continúa inEstuardo ChaconAún no hay calificaciones
- Pero Se Mueve Durante La Expansión de Forma Que Continúa inDocumento6 páginasPero Se Mueve Durante La Expansión de Forma Que Continúa inEstuardo ChaconAún no hay calificaciones
- Las Moléculas de Un Líquido No Están Fi Jas en Una Retícula RígidaDocumento6 páginasLas Moléculas de Un Líquido No Están Fi Jas en Una Retícula RígidaEstuardo ChaconAún no hay calificaciones
- La Termoquímica Es La Rama de La Termodinámica Que Investiga El Flujo de Calor Hacia Dentro o Hacia Fuera en Un Sistema en Reacción y Deduce La Energía Almacenada en Los Enlaces QuímicosDocumento6 páginasLa Termoquímica Es La Rama de La Termodinámica Que Investiga El Flujo de Calor Hacia Dentro o Hacia Fuera en Un Sistema en Reacción y Deduce La Energía Almacenada en Los Enlaces QuímicosEstuardo ChaconAún no hay calificaciones
- El Coeficiente de Reparto o de Participación KDocumento1 páginaEl Coeficiente de Reparto o de Participación KEstuardo ChaconAún no hay calificaciones
- La DestilaciónDocumento3 páginasLa DestilaciónEstuardo ChaconAún no hay calificaciones
- Muestra El Estado Del NegocioDocumento1 páginaMuestra El Estado Del NegocioEstuardo ChaconAún no hay calificaciones
- Separación de FasesDocumento3 páginasSeparación de FasesEstuardo ChaconAún no hay calificaciones
- Separación de FasesDocumento3 páginasSeparación de FasesEstuardo ChaconAún no hay calificaciones
- La Desecación Se Emplea para Extraer La Humedad de Los LíquidosDocumento1 páginaLa Desecación Se Emplea para Extraer La Humedad de Los LíquidosEstuardo ChaconAún no hay calificaciones
- GravimetriaDocumento1 páginaGravimetriaEstuardo ChaconAún no hay calificaciones
- Si Se Pueden DiferenciarDocumento1 páginaSi Se Pueden DiferenciarEstuardo ChaconAún no hay calificaciones
- La Desecación Se Emplea para Extraer La Humedad de Los LíquidosDocumento1 páginaLa Desecación Se Emplea para Extraer La Humedad de Los LíquidosEstuardo ChaconAún no hay calificaciones
- Fuerza de AdhesiónDocumento1 páginaFuerza de AdhesiónEstuardo ChaconAún no hay calificaciones
- Ácido FuerteDocumento2 páginasÁcido FuerteEstuardo ChaconAún no hay calificaciones
- Si Se Pueden DiferenciarDocumento1 páginaSi Se Pueden DiferenciarEstuardo ChaconAún no hay calificaciones
- TermoquimicaDocumento5 páginasTermoquimicaCarlos Jesús García LozanoAún no hay calificaciones
- Tipos de temperatura: escalas, corporal, basal, atmosférica e igniciónDocumento2 páginasTipos de temperatura: escalas, corporal, basal, atmosférica e igniciónLaubriNieves67% (3)
- Producto Académico N°1Documento4 páginasProducto Académico N°1Jenifer GomezAún no hay calificaciones
- Problemas Tipo Saber Fisica 11aDocumento4 páginasProblemas Tipo Saber Fisica 11aLauraAún no hay calificaciones
- Transferencia de Calor en Placa BidimensionalDocumento8 páginasTransferencia de Calor en Placa BidimensionalArielAún no hay calificaciones
- Informe Nº4Documento16 páginasInforme Nº4Angela Lizeth HEAún no hay calificaciones
- 1ra Unidad Quimica IDocumento30 páginas1ra Unidad Quimica ITarifa Felipez Diego HaroldAún no hay calificaciones
- Problemas Resueltos 1Documento3 páginasProblemas Resueltos 1erickAún no hay calificaciones
- U2-E1-Cardoso SánchezDocumento4 páginasU2-E1-Cardoso SánchezSajid Alberto Cardoso SanchezAún no hay calificaciones
- Ejercicios F RDocumento2 páginasEjercicios F RAngel Moran PachecoAún no hay calificaciones
- TP 4Documento4 páginasTP 4Gabii Van CauwenbergheAún no hay calificaciones
- Modulo I Unidades de MedidaDocumento9 páginasModulo I Unidades de MedidaFranko Encalada ValenciaAún no hay calificaciones
- Examen de ValoracionDocumento5 páginasExamen de ValoracionDairo DavilaAún no hay calificaciones
- Propiedades físicas en 15 experiencias con fluidosDocumento6 páginasPropiedades físicas en 15 experiencias con fluidosCarolinaAún no hay calificaciones
- Propiedades sustancias purasDocumento21 páginasPropiedades sustancias purasNanote OcampoAún no hay calificaciones
- Práctica 9 Determinación Del Calor Desprendido en Una Reacción QuímicaDocumento4 páginasPráctica 9 Determinación Del Calor Desprendido en Una Reacción QuímicaEra Hdz50% (2)
- Ducasa Programa Aire Acondicionado 2016Documento24 páginasDucasa Programa Aire Acondicionado 2016VEMATELAún no hay calificaciones
- Calentamiento de propileno con equipo alternativoDocumento2 páginasCalentamiento de propileno con equipo alternativoQC AmeAún no hay calificaciones
- Análisis para El Reactor No AdiabáticoDocumento10 páginasAnálisis para El Reactor No AdiabáticoAndres David GalindoAún no hay calificaciones
- DS 594 Parte 4Documento11 páginasDS 594 Parte 4faviikaujaAún no hay calificaciones
- Propiedades de Los Materiales DentalesDocumento6 páginasPropiedades de Los Materiales DentalesDianaAún no hay calificaciones
- Maquinas Termicas PDFDocumento8 páginasMaquinas Termicas PDFKleber RamirezAún no hay calificaciones
- Balance de materia, energía y exergiaDocumento31 páginasBalance de materia, energía y exergiaCarlos Uriel Martinez TinocoAún no hay calificaciones
- Fabrica de Alimentos BalanceadosDocumento47 páginasFabrica de Alimentos Balanceadosmilton talaveraAún no hay calificaciones
- Biblioteca de Aplicaciones COMSOL MultiphysicsDocumento19 páginasBiblioteca de Aplicaciones COMSOL MultiphysicsMarioAún no hay calificaciones
- Reconocimiento de Componentes Del Sistema de ClimatizaciónDocumento25 páginasReconocimiento de Componentes Del Sistema de ClimatizaciónPatricio Andres Ibañez Concha100% (1)