Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Rectas de Durhing
Cargado por
markoagustinDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Rectas de Durhing
Cargado por
markoagustinCopyright:
Formatos disponibles
Cap.
8 Evaporación
Punto de ebullición del agua (“C)
0 25 50 75 100 125
50% peso de NaOH I25
250 0
v
c
20% peso de NaOH
10% peso de NaOH
50 100 150 200 250 300
Punto de ebullición del agua (OF)
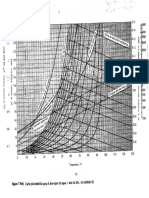
FIGURA 8.4-2. Líneas de Dühring para soluciones acuosas de hidróxido de sodio
Solución: De acuerdo con las tablas de vapor del Apéndice A.2, el punto de ebullición
del agua a 25.6 kPa es 65.6”C. Con base en la figura 8.4-2, a 65.6”C (150 “F) para NaOH
al 30%, el punto de ebullición de la solución es 79.5 “C (175 “F). La elevación del punto de
ebullición es (EPE) 79.5 - 65.6 = 13.9 “C (25 ‘F).
En la referencia de Perry y Green (P2) se incluye una gráfica para estimar la EPE de gran número
de soluciones acuosas comunes en procesos químicos y biológicos. Además de sales y solutos
comunes, tales como NaNOj, NaOH, NaC 1 y H2S04, se incluyen los solutos biológicos sacarosa, Sacido
cítrico, solución kraft y glicerol. Estos solutos biológicos tienen valores de EPE bastante bajos en
comparación con los de las sales comunes.
8.4D Gráficas de entalpía y concentración de soluciones
Cuando el calor de disolución de la solución acuosa que se está concentrando en eQ evaporador es
bastante alto, despreciarlo en los balances de calor puede causar errores considerables. Este
fenómeno del calor de disolución se explica como sigue. Cuando se disuelven lentejas de NaOH en
cierta cantidad de agua, se observa que se presenta una elevación considerable de la temperatura, esto
es, se desprende calor, al cual se le llama calor de disolución. La cantidad de calor desprendida
depende del tipo de sustancia y de la cantidad de agua usada. Además, cuando una solucih
558 8.4 M étodos de cálculo para evaporadores de un solo efecto
50
0 0.10 0.20 0.30 0.40 0.50 0.60
Concentración (fraccih en peso de NaOH)
FIGURA 8 . 4 - 3 . Gráfica de entalpia y concentracidn para el sistema NaOH-agua. Estado de referencia, agua
liquida a 0 “C (273 K) o 32 ‘F. [Tomado de W . L. McCabe. Trans. A.I.Ch.E,. 31, 129
(1935). Reproducida con autorizacidn.]
concentrada de NaOH se diluye a concentraciones más bajas también se libera calor. Por consiguien-
te, cuando una solución se concentra de una concentración baja a una más alta, es necesario
suministrar calor.
En la figura 8.4-3 se muestra una gráfica entalpía-concentración para NaOH (Ml), donde la
entalpía está en kJ/kg (btu/lb,) de solución, la temperatura en “C (“F) y la concentración en fracción
de NaOH en peso en la solución. Por lo general, estas grhfícas de entalpía y concentración no se
construyen para soluciones con calores de disolución despreciables, pues en estos casos es más fácil
usar las capacidades caloríficas para el cálculo de las entalpias. Además, estas gráficas ~610 existen para
algunas soluciones.
La entalpía del agua líquida de la figura 8.4-3 se refiere al mismo estado base o de referencia de
las tablas de vapor, esto es, agua líquida a 0 “C (273 K). Esto significa que las entalpías de la figura
pueden usarse con las de las tablas de vapor. Para la ecuación (8.4-7), los valores de he y he pueden
tomarse de la figura 8.4-3 y los valores de h y Hy de las tablas de vapor de agua. El siguiente ejemplo
ilustra el uso de la figura 8.4-3.
Ejemplo 8.4-3. Evaporacidn de una solucih de NaOH
Se usa un evaporador para concentrar 4536 kg/h de una solución al 20% de NaOH en agua
queentra a 60 “C (140°F) y sale con 50% de sólidos. La presión del vapor de agua saturado
que se usa es 172.4 kPa (25 lb/pulg2 abs) y la presih del vapor en el evaporador es ll .7
kPa (1.7 lb/pulg2 abs). El coeficiente total de transferencia de calor es 1560 W/m2 *K (275
btuh *pie2 *“F). Calcule la cantidad de vapor de agua usado, la economía de vapor en kg
vaporizados/kg de vapor de agua usados y el h-ea superficial de calentamiento en metros
cuadrados.
También podría gustarte
- Lineas de Durhing para NaOH-AguaDocumento2 páginasLineas de Durhing para NaOH-AguaYulissa Ramirez100% (1)
- Práctica 1 - Potenciometría Del Acido Acético en El VinagreDocumento11 páginasPráctica 1 - Potenciometría Del Acido Acético en El VinagreJordan Ulloa BelloAún no hay calificaciones
- Taller FasesDocumento3 páginasTaller Faseslaura100% (1)
- Informe 5Documento12 páginasInforme 5Brandon RodriguezAún no hay calificaciones
- Evaporadores PracticaDocumento20 páginasEvaporadores PracticaMj BasanAún no hay calificaciones
- Guia Problemas Qac 2018Documento24 páginasGuia Problemas Qac 2018Teresa MuchaAún no hay calificaciones
- Isoterma de AdsorcionDocumento8 páginasIsoterma de AdsorcionCristian Cervantes100% (2)
- Acido Debil Base FuerteDocumento7 páginasAcido Debil Base FuerteYOSELIN JANET RODRIGUEZ SALINASAún no hay calificaciones
- Práctica de La Laboratorio #5 Titulación Conductímétrica I. ObjetivoDocumento7 páginasPráctica de La Laboratorio #5 Titulación Conductímétrica I. ObjetivoJohnjairo Edu Romero EspinoAún no hay calificaciones
- Valoraciones Conductimetricas Acido BaseDocumento14 páginasValoraciones Conductimetricas Acido BaseRuth Ch50% (2)
- Acrylic-B en EsDocumento8 páginasAcrylic-B en Esyeison rafael madujano huaytaAún no hay calificaciones
- Practica 5 Lineas de DuhringDocumento9 páginasPractica 5 Lineas de DuhringAlan Gerardo Aguirre GonzalezAún no hay calificaciones
- Problemas Gomez DevraDocumento7 páginasProblemas Gomez DevraDevra GomezAún no hay calificaciones
- Introduccion A Las Operaciones de SeparacionDocumento5 páginasIntroduccion A Las Operaciones de SeparacionGab ArllenAún no hay calificaciones
- Informe Solubilidad Vs Temperatura (Fisicoquimica LL)Documento13 páginasInforme Solubilidad Vs Temperatura (Fisicoquimica LL)gerson velez100% (2)
- Efecto Del CatalizadorDocumento6 páginasEfecto Del CatalizadorMARIA PAULA MARTINEZ DUQUEAún no hay calificaciones
- Problemario Destilación PDFDocumento13 páginasProblemario Destilación PDFLiriamAún no hay calificaciones
- General 3Documento7 páginasGeneral 3eimyAún no hay calificaciones
- Construcción Del Diagrama de DühringDocumento11 páginasConstrucción Del Diagrama de DühringAndres Hernandez Lopez100% (7)
- Solubilidad Acido BenzoicoDocumento13 páginasSolubilidad Acido BenzoicoKamila MartinezAún no hay calificaciones
- Balances de Materia en Diagramas de Flujo de Procesos - CompressDocumento7 páginasBalances de Materia en Diagramas de Flujo de Procesos - CompressLizeth Arango MtzAún no hay calificaciones
- Química Plan Electivo Guía Numero 7 Viernes 5 de OctubreDocumento9 páginasQuímica Plan Electivo Guía Numero 7 Viernes 5 de OctubreMaría TemucoAún no hay calificaciones
- Guía 4 Cambio de FaseDocumento4 páginasGuía 4 Cambio de FaseFernando0% (1)
- Solubilidad Del Ácido Benzoico y Determinación de Su Calor de SoluciónDocumento13 páginasSolubilidad Del Ácido Benzoico y Determinación de Su Calor de SoluciónHector Jesus Roca LoaizaAún no hay calificaciones
- PRACTICA - 5to Parcial - QMC-206Documento5 páginasPRACTICA - 5to Parcial - QMC-206NEIL JESUS CLAURE CARDENASAún no hay calificaciones
- Guia 1Documento13 páginasGuia 1chemicalconsultingcoAún no hay calificaciones
- Equipo - 1 - Lab. Calor (Líneas de Dühring)Documento38 páginasEquipo - 1 - Lab. Calor (Líneas de Dühring)RODRIGO DELAROSA RODRIGUEZAún no hay calificaciones
- 4 Coligativas 2020Documento6 páginas4 Coligativas 2020Yimara AcostaAún no hay calificaciones
- 03 Columna de Relleno - Altura (Ejemplo3) 2021Documento17 páginas03 Columna de Relleno - Altura (Ejemplo3) 2021Nicolas SuarezAún no hay calificaciones
- Taller 2 TM David ParedesDocumento13 páginasTaller 2 TM David ParedesJhon Luis Muncha100% (1)
- Informe 4Documento6 páginasInforme 4Paola ChungaraAún no hay calificaciones
- Práctica Vi Fisicoquímica IDocumento9 páginasPráctica Vi Fisicoquímica IAldahirAún no hay calificaciones
- SeminarioN4-2017 FisicoquimicaDocumento9 páginasSeminarioN4-2017 FisicoquimicaGISELLEA1995Aún no hay calificaciones
- L3 Propiedades ColigativasDocumento6 páginasL3 Propiedades ColigativasJuan DavidAún no hay calificaciones
- Evaporadores PracticaDocumento20 páginasEvaporadores PracticaCesitar Calcina25% (4)
- Solubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Documento10 páginasSolubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Oscar Portillo100% (1)
- Evaporación - EPE PDFDocumento4 páginasEvaporación - EPE PDFHermi HernandezAún no hay calificaciones
- Tarea 3 Disoluciones QG AA 2022Documento2 páginasTarea 3 Disoluciones QG AA 2022Jorge Enrique Ordoñez GarciaAún no hay calificaciones
- Serie Equilibrio FasesDocumento9 páginasSerie Equilibrio FasesReza Alcivar SaulAún no hay calificaciones
- Balance de Materia y EnergiaDocumento17 páginasBalance de Materia y Energiamoam pdbdaAún no hay calificaciones
- Tarea Ponchon-SavaritDocumento2 páginasTarea Ponchon-SavaritJeancarlis Victoria Hernandez GonzalezAún no hay calificaciones
- Ejemplos Balance 5Documento7 páginasEjemplos Balance 5Uriel Rangel PenaAún no hay calificaciones
- Lab 7 Constante de Ionizacion de Un Acido DebilDocumento5 páginasLab 7 Constante de Ionizacion de Un Acido DebilFRANAún no hay calificaciones
- FISICOQUIMICA LL Titulacion ConductimetricaDocumento3 páginasFISICOQUIMICA LL Titulacion ConductimetricaRo CLAún no hay calificaciones
- CRIOSDocumento15 páginasCRIOSGuinette MaBu100% (1)
- Valoraciones Potenciométricas de Muestras de Carbonato de SodioDocumento11 páginasValoraciones Potenciométricas de Muestras de Carbonato de SodioingrossAún no hay calificaciones
- Reporte - Práctica 10Documento6 páginasReporte - Práctica 10jimenaAún no hay calificaciones
- Problemas Electroanalisis2010 11Documento12 páginasProblemas Electroanalisis2010 11John Quintana HuamaliesAún no hay calificaciones
- Santiago VegaDocumento12 páginasSantiago VegaDaniela MontenegroAún no hay calificaciones
- Cálculos CristalizaciónDocumento9 páginasCálculos CristalizaciónAna Rosa100% (1)
- Informe de Laboratorio N°4 TermodinámicaDocumento17 páginasInforme de Laboratorio N°4 TermodinámicaRoger LopezAún no hay calificaciones
- Practica #08 Acidos y Bases en VolumetriaDocumento4 páginasPractica #08 Acidos y Bases en VolumetriamiguelringoAún no hay calificaciones
- Valoraciones Conductimetricas-2Documento5 páginasValoraciones Conductimetricas-2wilder condori choqueAún no hay calificaciones
- FisicoquímicaDocumento1 páginaFisicoquímicaDavid SandovalAún no hay calificaciones
- Destilación 2017iiDocumento9 páginasDestilación 2017iiAlejandra Linda Gomez MenachoAún no hay calificaciones
- Exemple 2 Reactor BATCH NaOH Acetato de EtiloDocumento11 páginasExemple 2 Reactor BATCH NaOH Acetato de Etilokatrina SamirAún no hay calificaciones
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Curso Práctico de Química GeneralDe EverandCurso Práctico de Química GeneralCalificación: 4 de 5 estrellas4/5 (4)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Cuestionario DiagnosticoDocumento2 páginasCuestionario DiagnosticomarkoagustinAún no hay calificaciones
- Cuadernillo de Química 2-BLOQUE 3Documento15 páginasCuadernillo de Química 2-BLOQUE 3markoagustinAún no hay calificaciones
- Folleto Infantil para Actividades Proyectos y Juegos Con Niños Doodle Dibujado Turquesa y RojoDocumento2 páginasFolleto Infantil para Actividades Proyectos y Juegos Con Niños Doodle Dibujado Turquesa y RojomarkoagustinAún no hay calificaciones
- Cuadernillo de Química 2-BLOQUE 1Documento6 páginasCuadernillo de Química 2-BLOQUE 1markoagustinAún no hay calificaciones
- Evaporadores de Efecto Simple Metodos deDocumento5 páginasEvaporadores de Efecto Simple Metodos deRoberto Gonzalez JAún no hay calificaciones
- Cuestionario DiagnosticoDocumento2 páginasCuestionario DiagnosticomarkoagustinAún no hay calificaciones
- Acordeón InorganicaDocumento5 páginasAcordeón InorganicamarkoagustinAún no hay calificaciones
- Cuadernillo de Química 2-BLOQUE 2Documento12 páginasCuadernillo de Química 2-BLOQUE 2markoagustinAún no hay calificaciones
- Tarea 3 Numeros ComplejosDocumento11 páginasTarea 3 Numeros ComplejosmarkoagustinAún no hay calificaciones
- Cuestionario DiagnosticoDocumento1 páginaCuestionario DiagnosticomarkoagustinAún no hay calificaciones
- Carta Psicrometrica Treybal °CDocumento1 páginaCarta Psicrometrica Treybal °CmarkoagustinAún no hay calificaciones
- Marcos 02Documento3 páginasMarcos 02markoagustinAún no hay calificaciones
- Previo 1 Electroquímica y CorrosiónDocumento8 páginasPrevio 1 Electroquímica y CorrosiónJosé Emilio GómezAún no hay calificaciones
- Serie 1 InorgánicaDocumento5 páginasSerie 1 InorgánicamarkoagustinAún no hay calificaciones
- Gaia (Novela)Documento13 páginasGaia (Novela)markoagustinAún no hay calificaciones
- P3 - OnLine - Caída Libre de Un Cuerpo - 2022-IDocumento18 páginasP3 - OnLine - Caída Libre de Un Cuerpo - 2022-ImarkoagustinAún no hay calificaciones
- Balance de Energia GeneralDocumento1 páginaBalance de Energia GeneralmarkoagustinAún no hay calificaciones
- Incremento Del Punto de Ebullición (IPE) : Por Cent Aje Ma Sades Olut oDocumento1 páginaIncremento Del Punto de Ebullición (IPE) : Por Cent Aje Ma Sades Olut oAlexx WolfmanAún no hay calificaciones
- NUMEROS CUANTICOS Y CONFIGURACION 11JUNIO2021bDocumento10 páginasNUMEROS CUANTICOS Y CONFIGURACION 11JUNIO2021bmarkoagustinAún no hay calificaciones
- Serie 1-1Documento7 páginasSerie 1-1markoagustinAún no hay calificaciones
- Manual EqDocumento63 páginasManual EqmarkoagustinAún no hay calificaciones
- Conversión de TemperaturaDocumento1 páginaConversión de TemperaturamarkoagustinAún no hay calificaciones
- Carta Psicrometrica 760 MM HG ValconDocumento1 páginaCarta Psicrometrica 760 MM HG ValconmarkoagustinAún no hay calificaciones
- Grimorio de NomenclaturaDocumento14 páginasGrimorio de NomenclaturamarkoagustinAún no hay calificaciones
- Actividad de Configuracion Electrónica EMATDocumento3 páginasActividad de Configuracion Electrónica EMATmarkoagustinAún no hay calificaciones
- Ejercios y Tutoriales de Balanceo en Medio Ácido EMDocumento2 páginasEjercios y Tutoriales de Balanceo en Medio Ácido EMmarkoagustinAún no hay calificaciones
- Pasos A Seguir. Método Ion Electron Medio Acido BásicoDocumento1 páginaPasos A Seguir. Método Ion Electron Medio Acido BásicomarkoagustinAún no hay calificaciones
- Balance de Energia GeneralDocumento1 páginaBalance de Energia GeneralmarkoagustinAún no hay calificaciones
- Ejercicios Rad 7 Junio 2021Documento3 páginasEjercicios Rad 7 Junio 2021markoagustinAún no hay calificaciones
- TRIPTICO de Escalas TermometricasDocumento2 páginasTRIPTICO de Escalas TermometricasGiselle milagrosAún no hay calificaciones
- Tarea Semana 5 - Versión 3Documento3 páginasTarea Semana 5 - Versión 3Ventas Varias TalcaAún no hay calificaciones
- Equilibrio Quimico Expresiones KC y KPDocumento3 páginasEquilibrio Quimico Expresiones KC y KPJavier MoralesAún no hay calificaciones
- Diapo AlimentoDocumento23 páginasDiapo AlimentoOrly Alexander Fernandez ParragaAún no hay calificaciones
- Practica 1 de Termodinamica de FasesDocumento18 páginasPractica 1 de Termodinamica de FasesAlberto Arteaga100% (1)
- Informe de FenómenosDocumento17 páginasInforme de FenómenosAlejandraAún no hay calificaciones
- Trabajo Académico 4Documento5 páginasTrabajo Académico 4Vladimir Williams Velasquez PaucarAún no hay calificaciones
- T1sem2002 04Documento15 páginasT1sem2002 04andyandy888Aún no hay calificaciones
- ExamePractica Calificada #1 - 282112 - QUÍMICA ORGÁNICA - 2022-02 - FC-PREIAM02D1TDocumento6 páginasExamePractica Calificada #1 - 282112 - QUÍMICA ORGÁNICA - 2022-02 - FC-PREIAM02D1TCesar Mateo FernandiniAún no hay calificaciones
- Clase 2.2 Termodinamica D PDFDocumento36 páginasClase 2.2 Termodinamica D PDFMaria Catalina Rubiano GalindoAún no hay calificaciones
- Formulario TermodinamicaDocumento25 páginasFormulario TermodinamicaPenélope ManzurAún no hay calificaciones
- Turbinas de Gas - Pedro Fernández Díez Cap5Documento7 páginasTurbinas de Gas - Pedro Fernández Díez Cap5XXAún no hay calificaciones
- LAB - INTEGRAL I - U5yU6Documento13 páginasLAB - INTEGRAL I - U5yU6Alondra MendezAún no hay calificaciones
- Acumulador de SuccionDocumento5 páginasAcumulador de SuccionLalex MoretaAún no hay calificaciones
- 1ie 143 Ltc1 A Lab2 HR, HeDocumento16 páginas1ie 143 Ltc1 A Lab2 HR, HeEPIC7 TESTINGAún no hay calificaciones
- Ejercicios Tiempo de EsterilizaciónDocumento5 páginasEjercicios Tiempo de EsterilizaciónMarcus BrownAún no hay calificaciones
- Termodinamica U2 NewDocumento44 páginasTermodinamica U2 Newfabian1710Aún no hay calificaciones
- LabDocumento6 páginasLabOrlando SamudioAún no hay calificaciones
- Refrigeracion Por AbsorcionDocumento3 páginasRefrigeracion Por AbsorcionJose ManuelAún no hay calificaciones
- Practica 1 Termodinámica IIDocumento7 páginasPractica 1 Termodinámica IIRayluz ValdezAún no hay calificaciones
- ALETASDocumento15 páginasALETASHector Roldan0% (1)
- Termodinamica Taller 4Documento3 páginasTermodinamica Taller 4Veronica AvilaAún no hay calificaciones
- Mecanismos de Transferencia de CalorDocumento44 páginasMecanismos de Transferencia de CalorH�ctor Ricardo Gonz�lez FierroAún no hay calificaciones
- AULA VIRTUAL Equilibrio QuimicoDocumento37 páginasAULA VIRTUAL Equilibrio QuimicoNéstor Bazán ArribasplataAún no hay calificaciones
- CAMARAS FRIGORIFICAS Por Sebastian Gonzalo Quispe PonceDocumento7 páginasCAMARAS FRIGORIFICAS Por Sebastian Gonzalo Quispe PonceSebastian Quispe PonceAún no hay calificaciones
- Caso Practico TemperaturaDocumento4 páginasCaso Practico TemperaturaVictor leonardo Contreras RodríguezAún no hay calificaciones
- Examen Sustitutorio de Refrigeracion y CongelacionDocumento3 páginasExamen Sustitutorio de Refrigeracion y CongelacionJuan Carlos T G100% (1)
- Ejercicios Tercer Período PDFDocumento9 páginasEjercicios Tercer Período PDFAlfredo NavarreteAún no hay calificaciones
- La EnergíaDocumento18 páginasLa EnergíaDaniel CastilloAún no hay calificaciones
- DOCUMENTO Simbologia ElectricaDocumento12 páginasDOCUMENTO Simbologia ElectricascmingenieroAún no hay calificaciones