Documentos de Académico
Documentos de Profesional
Documentos de Cultura
CROMATOGRAFIA
Cargado por
Saúl AndrésDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
CROMATOGRAFIA
Cargado por
Saúl AndrésCopyright:
Formatos disponibles
CROMATOGRAFIA DE ADSORCIÓN: La cromatografía de adsorción es la forma clásica de
cromatografía ideada por Tswett por primera vez en 1903, con la que logró separar diferentes
pigmentos vegetales.
En la cromatografía de adsorción o cromatografía líquido-sólido, la fase estacionaria es un sólido,
habitualmente sílice, aunque en algunas ocasiones se emplea alúmina finamente dividida. Las
características de absorción en ambas columnas son similares y en ambas los tiempos de retención
se alargan a medida que la polaridad del analito aumenta. El analito queda retenido en la fase
estacionaria mediante fenómenos de adsorción. En
cromatografía de adsorción es más
conveniente aplicar la denominada fuerza eluyente (εº) de los disolventes ,
que es la energía de adsorción por unidad de área. Los valores de εº de los
disolventes dependen del adsorbente empleado como fase estacionaria, y
para la sílice son 0’8 veces mayores que para la alúmina. se emplea
fundamentalmente para la separación de compuestos no polares de bajo
peso molecular. Una característica particular de la cromatografía de
adsorción es su capacidad para diferenciar compuestos isómeros de
mezclas.
- Cromatografía de adsorción: la fase estacionaria sólida retiene a los solutos por un doble efecto
de adsroción física y química. Las interacciones implicadas son del tipo de furezas de van der
Waals.
Cromotagrafia de partición: Técnica de separación de moléculas basada en su diferente
solubilidad entre dos fases inmiscibles. La fase estacionaria es revestida o impregnada con
una fase solvente y la mezcla a separar se pasa en la fase móvil. la fase estacionaria es un
líquido soportado en un sólido inerte. Otra vez, la fase móvil puede ser un líquido (cromatografía
de partición líquido-líquido) o un gas (cromatografía de partición gas-líquido, GLC). La
cromatografía en papel es un tipo de cromatografía de partición en la cual la fase estacionaria es
una capa de agua adsorbida en una hoja de papel. La cromatografía de gases (GC) y de alta
resolución (HPLC) son técnicas de partición ampliamente empleadas.
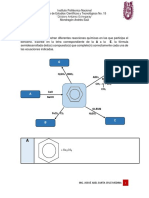
Cromatografía de intercambio iónico: La cromatografía de intercambio iónico (Ion
Exchange Chromatography, IEC) separa las moléculas en base a su carga ionica neta.
La separación se lleva a cabo por la competencia entre proteínas con diferente carga
superficial por grupos cargados opuestamente sobre un adsorbente o una matriz de
intercambio icónico. Actualmente, IEC es una de las técnicas de purificación de
proteínas más usadas. En una separación utilizando IEC, las interacciones hidrofóbicas
reversibles entre los solutos son controladas con el objetivo de favorecer la unión o
elución de moléculas específicas logrando su separación. Una proteína que no tiene
carga neta a un pH equivalente a su punto isoeléctrico (pl) no podrá interactuar con la
matriz o fase estacionaria cargada (ver Fig. 2). Sin embargo, a un pH por encima de su
punto isoeléctrico una proteína podrá ligarse a una matriz cargada positivamente o
intercambiador aniónico mientras que a un pH por debajo de su pl, una proteína podrá
unirse a una matriz cargada negativamente o intercambiador catiónico (Handbook GEa
2004; Cummins y col., 2011). Dichos intercambiadores existen en estado de equilibrio
entre la fase móvil y la fase estacionaria, dando lugar a dos tipos de IEC, llamados
aniónico y cationico, tal y como se muestra en la Fig. 3. La matriz intercambiadora
puede incluir protones (H+), grupos hidroxilo (OH-), iones monoatómicos cargados
(Na+, K+, Cl-), iones monoatómicos doblemente cargados (Ca2+, Mg2+) e iones
poliatómicos inorgánicos (SO24-, PO34-), además de bases orgánicas (NR3H+) y ácidos
(R-COO-) (Cummins y col., 2011).
Cromotografia de ultra filtración: La ultrafiltración es el proceso capaz de fraccionar, separar y
concentrar sustancias sin que éstas sufran cambios de fase, en el cual se utiliza una membrana
semipermeable con poros de tamaño definido, que determina el tamaño de las partículas que
pasarán a través de ella. Debido a que la membrana utilizada es semipermeable, es necesaria la
presencia de una presión (entre 4 a 8 atm) que auxilie a las partículas a fluir a través de la misma.
Tipos de Membranas: Existen actualmente dos categorías de membranas de ultrafiltración que
presentan ambas una estructura asimétrica. • Las membranas formadas con polímeros orgánicos.
Están constituidas de una "piel activa"(capa que define el tamaño de las partículas que podrán
pasar por la membrana) soportada sobre una estructura macroporosa. • La segunda generación
de membranas de ultrafiltración se prepara a partir de materiales cerámicos. Las capas sucesivas
se producen por un fritado de granos cerámicos que generan poros residuales cuyo tamaño
depende del tamaño de los granos; para obtener una capa activa de ultrafiltración es necesario
usar suspensiones coloidales de óxidos que luego se depositan sobre un material macro poroso y
se fritan. En la práctica se utilizan ambas, una delgada capa de las membranas orgánicas
determina el tamaño de macromoléculas que se pueden separar, sobre una gruesa capa de las
inorgánicas que le aportan resistencia a la presión. Factores que intervienen en el rendimiento de
una membrana: Formación de una capa de polarización en la superficie de la membrana. A
medida que el solvente es removido a través de ella, las especies rechazadas tienden a acumularse
en la interface membranasolución. Este efecto degradativo se manifiesta por si solo produciendo
una depresión del flujo, lo que significa una desventaja de la UF. La formación de una capa de
gel por coloides y las macromoléculas acumuladas delante de la membrana llegan a una
concentración crítica a partir de la cual se forma un gel que es responsable de una resistencia
adicional al pase del flujo transmembrana. Taponamiento interno de las membranas producido
por el bloqueo de los poros por el soluto. La presión influencia el flujo de solvente, el caudal de
filtrado aumenta con la presión hasta un cierto valor límite a partir del cual el caudal de estabiliza
o disminuye. En cuanto a la temperatura, se observa en general un aumento del flujo del
solvente con un aumento de la temperatura, el cual se debe esencialmente a la disminución de la
viscosidad del fluido. Diálisis y Ultrafiltración
Cromatografía por tamaño molecular: La cromatografía de exclusión molecular (Size
Exclusión Chromatography, SEC) es el nombre general para los procesos de separación
de biomoléculas de acuerdo a su tamaño cuando una solución fluye a través de una
cama empacada con un medio poroso (Irvine 1997; Kostanski y col., 2004).
Para la separación en SEC, se utilizan las propiedades de tamiz molecular de una
variedad de materiales porosos. El proceso de separación depende del tamaño y el
volumen hidrodinámico (volumen que ocupa una molécula en solución), el cual define
la capacidad de la molécula de penetrar o no en los poros de la fase estacionaria. De
tal forma que, las moléculas de alto peso molecular son excluidas de los poros debido
a un efecto estérico y pasan rápidamente a través de la matriz (ver Fig. 1). En el caso
de biomoléculas pequeñas, estas tienen diferente accesibilidad en las cavidades de la
matriz porosa.
También podría gustarte
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Cromatografía de ColumnaDocumento9 páginasCromatografía de ColumnaJuly Gaps100% (2)
- Elasticidad. Teoría y ejercicios prácticos resueltosDe EverandElasticidad. Teoría y ejercicios prácticos resueltosAún no hay calificaciones
- CromatografíaDocumento4 páginasCromatografíaAlexandra EAAún no hay calificaciones
- 4 CromatografiaDocumento19 páginas4 CromatografiaJhosy Yoss LPAún no hay calificaciones
- Los Seres Vivos Dependen De La Mecánica CuánticaDe EverandLos Seres Vivos Dependen De La Mecánica CuánticaAún no hay calificaciones
- CromatografíaDocumento13 páginasCromatografíaFernando Sanchez FuerteAún no hay calificaciones
- 12 Cromatografía de Capa Fina de LípidosDocumento8 páginas12 Cromatografía de Capa Fina de LípidosRukia SakataAún no hay calificaciones
- Cromatografía: Factores y Tipos enDocumento12 páginasCromatografía: Factores y Tipos enJudith TabaAún no hay calificaciones
- Cromatografía - Investigación PreviaDocumento9 páginasCromatografía - Investigación PreviaCarlos Andre Orta BarcenasAún no hay calificaciones
- Tecnicas CromatograficasDocumento9 páginasTecnicas CromatograficasAlain MartinezAún no hay calificaciones
- Cromatografía 5Documento11 páginasCromatografía 5D. ARMANDO R. TAPIAAún no hay calificaciones
- Conceptos CromatografíaDocumento31 páginasConceptos CromatografíaadolfoAún no hay calificaciones
- Introducción A La CromatografiaDocumento9 páginasIntroducción A La CromatografiaLhion Stevan33% (3)
- Practica 7 LQOBDocumento29 páginasPractica 7 LQOBAdolfo HernandezAún no hay calificaciones
- TIPOS DE CROMATOGRAFÍA EN COLUMNADocumento10 páginasTIPOS DE CROMATOGRAFÍA EN COLUMNAJesica MejiaAún no hay calificaciones
- CROMATOGRAFIADocumento37 páginasCROMATOGRAFIAMichael JacksonAún no hay calificaciones
- Clasificación de Las Técnicas CromatográficasDocumento5 páginasClasificación de Las Técnicas CromatográficasAnder Rivera100% (1)
- CromatografíaDocumento43 páginasCromatografíaMorales Vargas María JoséAún no hay calificaciones
- Resumen e Intro Cromatografia en PapelDocumento4 páginasResumen e Intro Cromatografia en PapelKimberly MartinezAún no hay calificaciones
- Cromatografia en Colmna Analitica 3 Segundo InformeDocumento6 páginasCromatografia en Colmna Analitica 3 Segundo InformeLeidys Begambre VergaraAún no hay calificaciones
- INFORME CromatografiaDocumento40 páginasINFORME CromatografiaMirian QuispeAún no hay calificaciones
- CromatografíaDocumento9 páginasCromatografíadelfinaAún no hay calificaciones
- La Cromatografía de Intercambio IónicoDocumento8 páginasLa Cromatografía de Intercambio IónicoAngelo GonzalezAún no hay calificaciones
- Cromatografia Clase Apuntes1Documento23 páginasCromatografia Clase Apuntes1Cristopher CuevasAún no hay calificaciones
- Adsorción-superficieDocumento5 páginasAdsorción-superficieJoel Ramirez Padilla100% (1)
- Qué Es CromatografíaDocumento13 páginasQué Es Cromatografíagabriela figueroaAún no hay calificaciones
- Lab 4 CromatografíaDocumento11 páginasLab 4 CromatografíaGlendaAún no hay calificaciones
- Informe 4 de Cromatografia (Leslie Lisbeth Chamaco Mamani)Documento17 páginasInforme 4 de Cromatografia (Leslie Lisbeth Chamaco Mamani)Luis Angel ChuraAún no hay calificaciones
- HPLC técnicaDocumento30 páginasHPLC técnicaRodrigo LopezAún no hay calificaciones
- Informe Cromatografia QMC-200L UmsaDocumento16 páginasInforme Cromatografia QMC-200L Umsacristhian vargas lauraAún no hay calificaciones
- Técnicas CromatográficasDocumento7 páginasTécnicas CromatográficasArantxa RodriguezAún no hay calificaciones
- Clasificación de Los Métodos CromatográficosDocumento6 páginasClasificación de Los Métodos Cromatográficosange FloresAún no hay calificaciones
- CromatografiaDocumento16 páginasCromatografiaBrën CooperAún no hay calificaciones
- Tema 1. Introduccion A La CromatografiaDocumento40 páginasTema 1. Introduccion A La CromatografiacharypooAún no hay calificaciones
- Inf. Lab. 4 CromatografiaDocumento9 páginasInf. Lab. 4 CromatografiaJhenny JimenezAún no hay calificaciones
- 11 CROMATOGRAFÍA DE CAPA FINA DE AAs - PDF 1aaDocumento11 páginas11 CROMATOGRAFÍA DE CAPA FINA DE AAs - PDF 1aaGina Alessandra M DAún no hay calificaciones
- Cromatografía analítica: Teoría de la cromatografíaDocumento45 páginasCromatografía analítica: Teoría de la cromatografíaAitana GinerAún no hay calificaciones
- 2 Cromatografia 2017Documento35 páginas2 Cromatografia 2017Sara JaimesAún no hay calificaciones
- Cromatografia Liquida de Alta ResolucionDocumento45 páginasCromatografia Liquida de Alta ResolucionKelvin GutierrezAún no hay calificaciones
- Cromatografía - Generalidades XPDocumento39 páginasCromatografía - Generalidades XPMargot Mendoza SalasAún no hay calificaciones
- SEMANA 6 - CromatografiaDocumento21 páginasSEMANA 6 - CromatografiaAnaisBriggitJacintoChavezAún no hay calificaciones
- 1tema 2 Técnicas Lab Bioquímica (Ii)Documento25 páginas1tema 2 Técnicas Lab Bioquímica (Ii)Natalia BoscoAún no hay calificaciones
- Cromatografía de colorantesDocumento21 páginasCromatografía de colorantesandrea paola navarro hernandez0% (1)
- Cromatografía Metodología UNAM ApurímacDocumento29 páginasCromatografía Metodología UNAM ApurímacLeydi MamaniAún no hay calificaciones
- Practica 1Documento3 páginasPractica 1Fernando Tuni HuancaAún no hay calificaciones
- (QMC 200) L CromatografiaDocumento11 páginas(QMC 200) L CromatografiaJhenny JimenezAún no hay calificaciones
- Bou2 U3 A2 MaaaDocumento6 páginasBou2 U3 A2 MaaaCarmem ArbesuAún no hay calificaciones
- PRACTICO CROMATOGRAFIA TerminadoDocumento10 páginasPRACTICO CROMATOGRAFIA TerminadoAnonymous TJAsmCkAún no hay calificaciones
- Cromatografia UwuDocumento4 páginasCromatografia UwuLidia Muñoz CastroAún no hay calificaciones
- Cromatografía de filtración en gelDocumento9 páginasCromatografía de filtración en gelRogelio Hernandez GAún no hay calificaciones
- Práctica Cromato en Columna FinalDocumento6 páginasPráctica Cromato en Columna FinalAlejandro RuizAún no hay calificaciones
- Cromatografía separa pigmentosDocumento29 páginasCromatografía separa pigmentosAdolfo HernandezAún no hay calificaciones
- Principios de Cromatografia PDFDocumento31 páginasPrincipios de Cromatografia PDFIgnacio Bascuñán OyarceAún no hay calificaciones
- Anteproyecto de CromatografiaDocumento11 páginasAnteproyecto de CromatografiaMancilla García Bruno AndrésAún no hay calificaciones
- Cuestionario CromatografíaDocumento8 páginasCuestionario CromatografíaJesika LemosAún no hay calificaciones
- Cromatografía en Capa FinaDocumento2 páginasCromatografía en Capa Finamartha ceclia seay lemusAún no hay calificaciones
- Cromatografía de intercambio iónico: separación basada en cargaDocumento4 páginasCromatografía de intercambio iónico: separación basada en cargaAnthonellaMejiaCalleAún no hay calificaciones
- Actividad LúdicaDocumento1 páginaActividad LúdicaSaúl AndrésAún no hay calificaciones
- Alteraciones Cualitativas y Cuantitativas LeucocitosDocumento1 páginaAlteraciones Cualitativas y Cuantitativas LeucocitosSaúl AndrésAún no hay calificaciones
- Actividad 4.7Documento1 páginaActividad 4.7Saúl AndrésAún no hay calificaciones
- Actividad 4.1Documento1 páginaActividad 4.1Saúl AndrésAún no hay calificaciones
- Actividad Integradora - BDocumento9 páginasActividad Integradora - BSaúl AndrésAún no hay calificaciones
- Actividad Integradora BiologiaDocumento17 páginasActividad Integradora BiologiaSaúl AndrésAún no hay calificaciones
- Actividad 2.7Documento1 páginaActividad 2.7Saúl AndrésAún no hay calificaciones
- Actividad 2.1Documento2 páginasActividad 2.1Saúl AndrésAún no hay calificaciones
- Densidad laboratorio físicoquímicaDocumento2 páginasDensidad laboratorio físicoquímicaSaúl AndrésAún no hay calificaciones
- Diagrama QuimicaDocumento2 páginasDiagrama QuimicaSaúl AndrésAún no hay calificaciones
- Celda de ConfinamientoDocumento2 páginasCelda de ConfinamientoSaúl AndrésAún no hay calificaciones
- Actividad 1.14Documento2 páginasActividad 1.14Saúl AndrésAún no hay calificaciones
- Actividad 2.2Documento2 páginasActividad 2.2Saúl AndrésAún no hay calificaciones
- Actividad LúdicaDocumento1 páginaActividad LúdicaSaúl AndrésAún no hay calificaciones
- 6im6 E3 Mondragón Saúl DesafíoDocumento1 página6im6 E3 Mondragón Saúl DesafíoSaúl AndrésAún no hay calificaciones
- 6im6 Mondragón Saúl CuestionarioDocumento4 páginas6im6 Mondragón Saúl CuestionarioSaúl AndrésAún no hay calificaciones
- Características clave de un profesional de ingenieríaDocumento3 páginasCaracterísticas clave de un profesional de ingenieríaSaúl AndrésAún no hay calificaciones
- 6im6 E3 Mondragón Saúl CalorytemperaturaDocumento8 páginas6im6 E3 Mondragón Saúl CalorytemperaturaSaúl AndrésAún no hay calificaciones
- 6IM6-E3-Moderador-Lucero-2do AvanceDocumento8 páginas6IM6-E3-Moderador-Lucero-2do AvanceSaúl AndrésAún no hay calificaciones
- Pon de ValeroDocumento7 páginasPon de ValeroDanny bladimir choque mamaniAún no hay calificaciones
- Modulo2 PresentacioÌ N EDS OkDocumento14 páginasModulo2 PresentacioÌ N EDS OkCarla TejedorAún no hay calificaciones
- Proyecto Inverciones Deras Mercadotecnia InternacionalDocumento36 páginasProyecto Inverciones Deras Mercadotecnia InternacionalEdgar DerasAún no hay calificaciones
- Analisis de Fisica ModernaDocumento2 páginasAnalisis de Fisica ModernajuanAún no hay calificaciones
- Proyecto ChorizoDocumento20 páginasProyecto ChorizoFernando ValenzuelaAún no hay calificaciones
- SibacDocumento29 páginasSibacMauricio RiveraAún no hay calificaciones
- Estudio de Impacto Ambiental Relavera La EsperanzaDocumento30 páginasEstudio de Impacto Ambiental Relavera La Esperanzadavid aguirreAún no hay calificaciones
- DPFDocumento4 páginasDPFDIONYBLINKAún no hay calificaciones
- Plan de TesisDocumento24 páginasPlan de Tesiseddson leonAún no hay calificaciones
- Ensayo de La LinguisticaDocumento4 páginasEnsayo de La LinguisticaStephany Nicolle Ordoñez vasquezAún no hay calificaciones
- TESTs CONDICIÓN FÍSICA 4º ESODocumento3 páginasTESTs CONDICIÓN FÍSICA 4º ESOmatepebeAún no hay calificaciones
- Epistemologia y EnfermeriaDocumento7 páginasEpistemologia y EnfermeriaAYLEEN YAJAHIRA MARRUFO SALASAún no hay calificaciones
- 48 Escaques Ajedrez y MatematicasDocumento20 páginas48 Escaques Ajedrez y MatematicasClaudio Esteban Contreras FernandezAún no hay calificaciones
- Exposición Diapositivas VinoDocumento12 páginasExposición Diapositivas VinoAlicia VargasAún no hay calificaciones
- Catálogo Yerbabuena c8 Ed 2Documento72 páginasCatálogo Yerbabuena c8 Ed 2Ttury LadinoAún no hay calificaciones
- Informe Laboratorio Electrónica I DiodosDocumento9 páginasInforme Laboratorio Electrónica I DiodosEdith ContrerasAún no hay calificaciones
- 30 Días Con La ComparonaDocumento26 páginas30 Días Con La ComparonaEmely Villegas Quiñónez100% (1)
- Huertos FamiliaresDocumento4 páginasHuertos FamiliaresRuth Alvarado RodriguezAún no hay calificaciones
- Colección de Poemas para El Día de Las MadresDocumento31 páginasColección de Poemas para El Día de Las MadresGerko VergaraAún no hay calificaciones
- Bloques en movimiento: Trabajo, potencia y energíaDocumento5 páginasBloques en movimiento: Trabajo, potencia y energíaAlejandro ValenciaAún no hay calificaciones
- Bendición y Consagración Del TemploDocumento12 páginasBendición y Consagración Del TemploDiegoAún no hay calificaciones
- Estadística Aplicada: Estimación de la Varianza en Prácticas de ProducciónDocumento1 páginaEstadística Aplicada: Estimación de la Varianza en Prácticas de ProducciónTito CasasAún no hay calificaciones
- Cerco PerimetricoDocumento31 páginasCerco PerimetricoGiancarlo Flores DelgadoAún no hay calificaciones
- Cianuracion Por Agitacion - Caso en EcuadorDocumento8 páginasCianuracion Por Agitacion - Caso en EcuadorWalter-uniAún no hay calificaciones
- Tig OpnDocumento17 páginasTig OpnRenato Defilippi CurichAún no hay calificaciones
- Unidad 4 Física Cuántica Reporte de Exposición 1Documento27 páginasUnidad 4 Física Cuántica Reporte de Exposición 1Edgar IbarraAún no hay calificaciones
- Calcula El Tamaño de La Tierra para Que Fuese Un Agujero Negro. Teoría de John Michell de Agujeros Negros.Documento3 páginasCalcula El Tamaño de La Tierra para Que Fuese Un Agujero Negro. Teoría de John Michell de Agujeros Negros.IsabelAún no hay calificaciones
- El Partimiento Del Pan - WATCHMAN NEEDocumento10 páginasEl Partimiento Del Pan - WATCHMAN NEEYunielYaneisy Álvarez SuárezAún no hay calificaciones
- Lectura Maquiladoras en MéxicoDocumento7 páginasLectura Maquiladoras en MéxicoDiego AguilarAún no hay calificaciones
- Ejercicios de Qca InstrumentalDocumento1 páginaEjercicios de Qca InstrumentalMab FabAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Borges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonDe EverandBorges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonCalificación: 5 de 5 estrellas5/5 (4)
- Nunca fuimos modernos: Ensayos de antropología simétricaDe EverandNunca fuimos modernos: Ensayos de antropología simétricaAún no hay calificaciones
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Investigación de operaciones: Conceptos fundamentalesDe EverandInvestigación de operaciones: Conceptos fundamentalesCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Estoicismo y dureza mental: Descubre los secretos psicológicos de la filosofía estoica en la vida moderna. Construir una autodisciplina inquebrantable y hábitos diarios que garanticen el éxitoDe EverandEstoicismo y dureza mental: Descubre los secretos psicológicos de la filosofía estoica en la vida moderna. Construir una autodisciplina inquebrantable y hábitos diarios que garanticen el éxitoCalificación: 4 de 5 estrellas4/5 (23)
- Cálculo infinitesimal: El lenguaje matemático de la naturalezaDe EverandCálculo infinitesimal: El lenguaje matemático de la naturalezaCalificación: 5 de 5 estrellas5/5 (3)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Teoría de juegos: Una introducción matemática a la toma de decisionesDe EverandTeoría de juegos: Una introducción matemática a la toma de decisionesCalificación: 4 de 5 estrellas4/5 (1)
- Estadística básica: Introducción a la estadística con RDe EverandEstadística básica: Introducción a la estadística con RCalificación: 5 de 5 estrellas5/5 (8)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)