Documentos de Académico
Documentos de Profesional
Documentos de Cultura
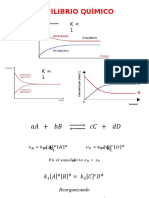
REACCIÓNES
Cargado por
MelySaGalindresGarciaDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
REACCIÓNES
Cargado por
MelySaGalindresGarciaCopyright:
Formatos disponibles
1.
REACCIÓN REVERSIBLE DEL CLORURO DE AMONIO
Ilustración 1. Aumento de temperatura Ilustración 2. Difusión del gas al Erlenmeyer 2
En la experimentación se observó que al aumentar la
temperatura en el matraz 1 el cloruro de amonio se
descompone en amoniaco y ácido clorhídrico gaseoso.
La masa del solido disminuye en el Erlenmeyer 1 y los gases
se difunden. Por tanto, mediante la experimentación se
evidenció que una reacción reversible es aquella que en
algún punto de su transcurso alcanza un estado de
equilibrio en el que las concentraciones de los reactivos y
productos permanecen constantes; es decir, no varían, pues
la velocidad con que se consume uno es la misma con la que
Ilustración 3. Datos de la reacción de
aparece el otro. Se dice también que tal estado corresponde a descomposición del NH4Cl
un equilibrio dinámico (Chang, 2011).
Por otra parte, se comprobó descompone cuando se calienta, formando amoníaco y cloruro de
hidrógeno. Cuando los dos gases se enfrían lo suficiente reaccionan de manera conjunta para formar
cloruro de amonio de nuevo. La reacción reversible se puede escribir como:
NH4Cl(s) ⇌ NH3(g) + HCl(g)
¿Puede volverá a obtener todo el solido de nuevo en el matraz de la izquierda?
A partir de la experimentación se comprobó que, si es posible obtener todo el solido de nuevo en el
matraz, puesto que la reacción de descomposición del cloruro de amonio es reversible, es decir
además de los reactivos convertirse en productos, en las reacciones reversibles los productos también
se pueden convertir en reactivos. Ambas reacciones, tanto de un sentido como de otro, pueden
suceder al mismo tiempo; esto es hasta que se establece un equilibrio relativo entre reactivos y
productos en donde las concentraciones se igualan.
¿Como confirma esta práctica lo estudiado en el documento? se confirma a partir de la
experimentación en el simulador yenka, donde se aprecia que al aumentar la temperatura se
descompone el cloruro de amonio y la masa del solido disminuye en el Erlenmeyer 1 y los gases se
difunden al Erlenmeyer 2, de esta manera al alcanzar el equilibrio la concentración de reactivos y
productos es la misma.
2. EQUILIBRIO DEL CLORURO DE AMONIO
Ilustración 4. Equilibrio cloruro de amonio T1
Ilustración 5. Equilibrio cloruro de amonio T1
Kc a 275°C
Kp a 275° C=1,04∗10−2
(kp)
Kc= ∆n
( RT )
(1,04∗10−2)
Kc= 1
L∗atm
(0,082 ∗623 K )
k∗mol
Kc = 2,03¿ 10−4
Bibliografía
Chang, R. (2011). Fundamentos de química. Mexico-McGraw-Hill.
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- EstequiometriaDocumento20 páginasEstequiometriaC21$70100% (6)
- Capítulo 09 - Equilibrio QuímicoDocumento44 páginasCapítulo 09 - Equilibrio QuímicoLia Midori Giraldo CruzAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Hidrolisis Acida de Acetato de EtiloDocumento14 páginasHidrolisis Acida de Acetato de Etilokarina huayhuaAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Respiratorio 3mDocumento30 páginasRespiratorio 3mIvánBejaranoAlonzoAún no hay calificaciones
- Papers de Traduccion de Cinetica MetalurgicaDocumento52 páginasPapers de Traduccion de Cinetica MetalurgicaNestor Zinan RzAún no hay calificaciones
- Equilibrio QuimicoDocumento30 páginasEquilibrio QuimicoMiguel André Salinas RevillaAún no hay calificaciones
- Reacciónes Quimica. Reacciónes HeterogeneasDocumento11 páginasReacciónes Quimica. Reacciónes HeterogeneasLeonel LopzAún no hay calificaciones
- UNIDAD IV Semana 13 - EQUILIBRIO QUIMICODocumento10 páginasUNIDAD IV Semana 13 - EQUILIBRIO QUIMICOOmar Isaac Villaverde LopezAún no hay calificaciones
- Equilibrio QuimicoDocumento36 páginasEquilibrio QuimicoMaria Paula Viveros QuintanillaAún no hay calificaciones
- Equilibrio QuimicoDocumento45 páginasEquilibrio QuimicoflorZZ12Aún no hay calificaciones
- Trabajo en EquipoDocumento23 páginasTrabajo en EquipoJose David Escalona GarateAún no hay calificaciones
- Taller Equilibrio Qco.21Documento5 páginasTaller Equilibrio Qco.21Valentina DuqueAún no hay calificaciones
- Examen Pau j02Documento4 páginasExamen Pau j02rosa_hi1Aún no hay calificaciones
- Practica Dirigida 01Documento6 páginasPractica Dirigida 01Denis Alberca CarrascoAún no hay calificaciones
- Equilibrio Quimico de IndicadoresDocumento7 páginasEquilibrio Quimico de IndicadoresfernandoAún no hay calificaciones
- Cuestionari 8 oDocumento6 páginasCuestionari 8 oHache ZG FernandoAún no hay calificaciones
- Equilibrio QuimicoDocumento26 páginasEquilibrio Quimicogacv0925Aún no hay calificaciones
- Ex Parcial 2007 IiDocumento1 páginaEx Parcial 2007 IiLuis Fernando Chalco RamosAún no hay calificaciones
- Equilibrio Quimico ConceptoDocumento11 páginasEquilibrio Quimico ConceptoKido JazzAún no hay calificaciones
- Informe 5 Con AmorDocumento10 páginasInforme 5 Con AmorCristian Adrian Barreto ChozoAún no hay calificaciones
- Ejercicios TermodinámicaDocumento8 páginasEjercicios TermodinámicaIngrid AlvaradoAún no hay calificaciones
- Ejercicios+termodinámica Pedro de ValdiviaDocumento8 páginasEjercicios+termodinámica Pedro de ValdiviaIngrid AlvaradoAún no hay calificaciones
- UTP Equilibrio Quimico.Documento28 páginasUTP Equilibrio Quimico.jherson ascacibarAún no hay calificaciones
- Definición de Equilibrio QuímicoDocumento15 páginasDefinición de Equilibrio QuímicoSergio SuarezAún no hay calificaciones
- Semana #3 Equilibrio QuímicoDocumento15 páginasSemana #3 Equilibrio QuímicoJosue YuAún no hay calificaciones
- Preinforme Calor de CombustiónDocumento9 páginasPreinforme Calor de CombustiónCarolinaAún no hay calificaciones
- Unidad3-Tarea3-Equilibrio y Cinetica (1) - 2Documento58 páginasUnidad3-Tarea3-Equilibrio y Cinetica (1) - 2Jhon Ramirez TamayoAún no hay calificaciones
- Capitulo 4Documento28 páginasCapitulo 4ANTHONY FREIREAún no hay calificaciones
- ClaseN°4 2018 PDFDocumento53 páginasClaseN°4 2018 PDFAnonymous 9IwTTjHzAún no hay calificaciones
- QuimicaDocumento53 páginasQuimicaAXspeechware DjkAún no hay calificaciones
- Equilibrio QuimicoDocumento7 páginasEquilibrio QuimicoSebastian Barrientos GomezAún no hay calificaciones
- EJERCICIOS DE EQUILIBRIO QUIMICO Modificado VirtualDocumento20 páginasEJERCICIOS DE EQUILIBRIO QUIMICO Modificado Virtualkaneki kenAún no hay calificaciones
- Qma-111-U3 Guía de LecturaDocumento14 páginasQma-111-U3 Guía de LecturaLorna GonzálezAún no hay calificaciones
- 2 QEquilibrio ACTDocumento28 páginas2 QEquilibrio ACTIria Díaz BarrigaAún no hay calificaciones
- Practica 2 Quimica IndustrialDocumento5 páginasPractica 2 Quimica IndustrialRoberto Viquez100% (1)
- Leyes de La TermoquímicaDocumento13 páginasLeyes de La TermoquímicahenrykAún no hay calificaciones
- Examen de Quimica FinalDocumento3 páginasExamen de Quimica FinalKeisy Masseel DuranAún no hay calificaciones
- Practica 3 Propiedades ColigativasDocumento12 páginasPractica 3 Propiedades ColigativasRocio Carrillo FloresAún no hay calificaciones
- Informe Entalpias de NeutralizacionDocumento8 páginasInforme Entalpias de NeutralizacionAndres SernaAún no hay calificaciones
- Guia No 2 - Equilibrio QuimicoDocumento2 páginasGuia No 2 - Equilibrio QuimicoPatricia FRANCO VEGAAún no hay calificaciones
- Paso 1 Alexander RobayoDocumento11 páginasPaso 1 Alexander RobayoalexanderAún no hay calificaciones
- Equilibrio QuimicoDocumento9 páginasEquilibrio QuimicoPEDRO AARON REY CHAVEZAún no hay calificaciones
- Equilibrio QuímicoDocumento29 páginasEquilibrio QuímicofelipeAún no hay calificaciones
- Practica 14 Desplazamiento Del Equilibrio Quimico Efecto de La Concentracion y La Temperatura PDFDocumento6 páginasPractica 14 Desplazamiento Del Equilibrio Quimico Efecto de La Concentracion y La Temperatura PDFLuna HanabiAún no hay calificaciones
- Clase Práctica #01 - Diseño de ReactoresDocumento7 páginasClase Práctica #01 - Diseño de ReactoresLuis alejandro Perez mercadoAún no hay calificaciones
- Problemas Cinetica Electroquimica - Erika MarinasDocumento14 páginasProblemas Cinetica Electroquimica - Erika MarinasPablo HernándezAún no hay calificaciones
- LAB 3 Determinacion Del Calor de Formacion Del NH4Cl FISICOQUIMICADocumento13 páginasLAB 3 Determinacion Del Calor de Formacion Del NH4Cl FISICOQUIMICAYesenia M Carrillo75% (4)
- Unidad VII. Temperatura y Equilibrio TérmicoDocumento7 páginasUnidad VII. Temperatura y Equilibrio TérmicoBárbara WuefferAún no hay calificaciones
- Equilibrio QuimicoDocumento26 páginasEquilibrio QuimicopeccianAún no hay calificaciones
- Equilibrio QuímicoDocumento13 páginasEquilibrio QuímicoNathalia Regalado AraujoAún no hay calificaciones
- Practica 6 Grupo 9BDocumento8 páginasPractica 6 Grupo 9BElías Robles GarcíaAún no hay calificaciones
- Conductividad Térmica - WordDocumento5 páginasConductividad Térmica - Wordrosalia ramosAún no hay calificaciones
- Balances en Procesos ReactivosDocumento6 páginasBalances en Procesos ReactivosJavier DiazAún no hay calificaciones
- Repartido+Equilibrio+Químicov2 WatermarkDocumento10 páginasRepartido+Equilibrio+Químicov2 WatermarkBruno Rosa AlfaroAún no hay calificaciones
- Ex Parcial 2007 II SolucionarioDocumento3 páginasEx Parcial 2007 II SolucionarioJosue Gil SanchezAún no hay calificaciones
- Resultados PruebasDocumento2 páginasResultados PruebasMelySaGalindresGarciaAún no hay calificaciones
- CAPÍTULO 9 - Enzimas - Regulación de ActividadesDocumento15 páginasCAPÍTULO 9 - Enzimas - Regulación de ActividadesMelySaGalindresGarciaAún no hay calificaciones
- 42-Texto Del Artículo-57-1-10-20190409Documento7 páginas42-Texto Del Artículo-57-1-10-20190409MelySaGalindresGarciaAún no hay calificaciones
- Laboratorio Titulacion Acido Base (1) InformeDocumento15 páginasLaboratorio Titulacion Acido Base (1) InformeMelySaGalindresGarcia0% (1)
- Óxido de CalcioDocumento3 páginasÓxido de CalcioMelySaGalindresGarcia100% (1)
- Practica N°2 - Castelo Cortez Carmen (Semana N°1)Documento17 páginasPractica N°2 - Castelo Cortez Carmen (Semana N°1)CARMEN CASTELOAún no hay calificaciones
- Taller Ciencias Cambios de La MateriaDocumento12 páginasTaller Ciencias Cambios de La MateriaA'le J'androAún no hay calificaciones
- Desorcion Gaseosa FinalDocumento20 páginasDesorcion Gaseosa FinalArT1110100% (3)
- IMfacaftDocumento131 páginasIMfacaftArian VJAún no hay calificaciones
- 4 - Sistemas CerradosDocumento5 páginas4 - Sistemas CerradosMatias GuardiaAún no hay calificaciones
- Banco de Preguntas de Buzo ComercialDocumento29 páginasBanco de Preguntas de Buzo ComercialFelipe Andrés SotoAún no hay calificaciones
- Industria GasiferaDocumento14 páginasIndustria GasiferaLewisAún no hay calificaciones
- HOJA DE RUTA QUIMICA 2016 1 - Cuatrimestre PDFDocumento5 páginasHOJA DE RUTA QUIMICA 2016 1 - Cuatrimestre PDFSofiaPelaezAún no hay calificaciones
- TermodinámicaDocumento2 páginasTermodinámicaGabrielMolinaAún no hay calificaciones
- Accidente Uso Nitrogeno Sin Manorreductor BINVAC - 063Documento4 páginasAccidente Uso Nitrogeno Sin Manorreductor BINVAC - 063eduardomanuel3Aún no hay calificaciones
- Hidroeléctricas Del Ecuador Proyecto Hidroeléctrico Mazar DudasDocumento12 páginasHidroeléctricas Del Ecuador Proyecto Hidroeléctrico Mazar DudasJean AlarconAún no hay calificaciones
- Unidad 6 - Gases IdealesDocumento12 páginasUnidad 6 - Gases IdealesTutorías ZareAún no hay calificaciones
- Difusión InternaDocumento17 páginasDifusión InternaSandra Dávalos FigueroaAún no hay calificaciones
- El Bombeo y La Compresion de Hidrocarburos en La I.PDocumento11 páginasEl Bombeo y La Compresion de Hidrocarburos en La I.Pjose antonioAún no hay calificaciones
- 1400 20TV Manual EsDocumento28 páginas1400 20TV Manual EsLeonardo ChirinosAún no hay calificaciones
- Ejemplos MultifasicoDocumento8 páginasEjemplos MultifasicoJoel Vargas SampayoAún no hay calificaciones
- Desgasificación Del AluminioDocumento10 páginasDesgasificación Del AluminioAntonio GuíaAún no hay calificaciones
- PERFORMDocumento2 páginasPERFORMYael Hernandez LopezAún no hay calificaciones
- Refuerzo Del Verano 4º ESO FQDocumento16 páginasRefuerzo Del Verano 4º ESO FQFrancisco JavierAún no hay calificaciones
- Hidrostatica 2022 2P 1Documento17 páginasHidrostatica 2022 2P 1Katia Benegas100% (1)
- 16896853305422Documento2 páginas16896853305422emanuel david pineda tabordaAún no hay calificaciones
- Sistema de Alimentación de Combustible 2Documento6 páginasSistema de Alimentación de Combustible 2alexanderAún no hay calificaciones
- Sistema de Unidades de MedidaDocumento31 páginasSistema de Unidades de MedidaHantz Maximiliano Gomez MedinaAún no hay calificaciones
- Propiedades de Petróleo, Gas y AguaDocumento10 páginasPropiedades de Petróleo, Gas y AguaDaniel Guajala100% (1)
- Procesos Con ResinasDocumento11 páginasProcesos Con ResinasSteven CHAún no hay calificaciones
- PVTDocumento150 páginasPVTCharly HernandezAún no hay calificaciones
- Met A NoDocumento5 páginasMet A NoJose Maria Lopez LeyzanAún no hay calificaciones
- Nomenclatura InorganicaDocumento5 páginasNomenclatura InorganicaEden Suarez0% (2)
- Frank Blatt - 5Documento96 páginasFrank Blatt - 5JOSUE SEBASTIAN VALENCIA CUENCAAún no hay calificaciones