Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Segundo Mapa EYC
Cargado por
Rodolfo Justo CortesTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Segundo Mapa EYC
Cargado por
Rodolfo Justo CortesCopyright:
Formatos disponibles
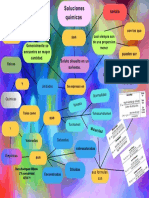
Unidad 4. Sistemas binarios.
Justo Cortés Rodolfo.
¿Qué es?
Mezcla de dos o más componentes que depende de la solubilidad.
Entonces
Son Aquellas que obedecen la Ley de Raoult en todo
Son disoluciones ideales
intervalo de concentraciones.
Se dividen en
Según su tipo de electrolito Según su volatilidad
Se dividen en
Se dividen en
Con solutos volátiles
En Con solutos no volátiles
Solución de electrolito Solución de no electrolito
El “vapor” se presenta tanto el En
Son
Son soluto y el disolvente
En
El “vapor” solo se
Aquella que se disocia Aquella que no se
Propiedades coligativas presenta el disolvente
completamente disocia en iones
El equilibrio L-V presenta diferentes
Hay Son Hay composiciones de cada uno. “Regla
de la palanca”
Menor modificación Presión-composición
Mayor modificación Dependen de la concentración
Se De tipo Se puede tener
del soluto y no de su naturaleza
Debido a el
Representa en diagramas Desviación Negativa
Ejemplos Desviación Positiva
Factor de Van´t Hoff
De tipo Entonces es
Disminución de la presión de vapor
Descenso de la temperatura de congelación un
Es Constante Temperatura-Composición
Aumento de la temperatura de ebullición Mínimo Entonces es un
Presión osmótica ebulloscopia
Relación entre la Mezcla líquida que se
concentración real
y crioscópica Máximo
Dependen comporta como si Se divide en
cuando una sustancia se estuviese formada por
Ejemplos Azeótropo
disuelve (se disocia) De la naturaleza del disolvente un solo componente Es
También podría gustarte
- Propiedades ColigativasDocumento1 páginaPropiedades ColigativasJesus DiazAún no hay calificaciones
- Resumen Cap 7 y 8Documento14 páginasResumen Cap 7 y 8Gabo Alejo Aguirre100% (1)
- DISOLUCIONESDocumento1 páginaDISOLUCIONESdeisy bejarano riveraAún no hay calificaciones
- Rúbrica Soluciones E.3Documento9 páginasRúbrica Soluciones E.3Estefania LimaAún no hay calificaciones
- Propiedades ColigativasDocumento5 páginasPropiedades Coligativasnaroa07rubAún no hay calificaciones
- Propiedades de Las Soluciones-RaoultDocumento30 páginasPropiedades de Las Soluciones-RaoultDiego PariAún no hay calificaciones
- SolucionesDocumento23 páginasSolucionesJose RuizesparzaAún no hay calificaciones
- Mapa Conceptual de Las Mezclas 2Documento1 páginaMapa Conceptual de Las Mezclas 2isaquispe993.qmcAún no hay calificaciones
- Mapa Conceptual Proyecto Cute Colores PastelDocumento1 páginaMapa Conceptual Proyecto Cute Colores PastelMARGARITA COLORADOAún no hay calificaciones
- DisolucionesDocumento1 páginaDisolucionesAnabell Lucio MontealvoAún no hay calificaciones
- Química Ciclo Uni Semana-07Documento19 páginasQuímica Ciclo Uni Semana-07Ronald FgAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualThomas Gomez AceroAún no hay calificaciones
- PLANTILLADocumento3 páginasPLANTILLAByeAún no hay calificaciones
- Prueba Diagnóstica IiDocumento1 páginaPrueba Diagnóstica Iimaria paula guerra meloAún no hay calificaciones
- Resumen Química Disoluciones-1Documento4 páginasResumen Química Disoluciones-1martinAún no hay calificaciones
- Mapa Conseptual OsmosisDocumento2 páginasMapa Conseptual OsmosisALBA0% (1)
- Xavier Tarea Ucsm Fisio 1Documento1 páginaXavier Tarea Ucsm Fisio 1luislechuga357Aún no hay calificaciones
- Mapa MarioDocumento1 páginaMapa Marioviveros coloradoAún no hay calificaciones
- Emulsion - Anyela Susana Aquize Flores.Documento2 páginasEmulsion - Anyela Susana Aquize Flores.celia Gutiérrez MamaniAún no hay calificaciones
- MAPA DE LIQUIDO - Docx AADocumento1 páginaMAPA DE LIQUIDO - Docx AAAllison AllaucaAún no hay calificaciones
- DisolucionesDocumento13 páginasDisolucionesCindy VillacisAún no hay calificaciones
- Soluciones Soluciones: EmpíricasDocumento1 páginaSoluciones Soluciones: EmpíricastrabajosAún no hay calificaciones
- Conceptos y Propiedades ColigativasDocumento1 páginaConceptos y Propiedades ColigativasThayra KiwanAún no hay calificaciones
- Mapa Unidad IDocumento1 páginaMapa Unidad IClau JuárezAún no hay calificaciones
- Mapa Conceptual - Lucero HCDocumento1 páginaMapa Conceptual - Lucero HCLUCERO HERNANDEZ CERECEDOAún no hay calificaciones
- Sistemas Dispersos "Disoluciones"Documento1 páginaSistemas Dispersos "Disoluciones"Rodrigo A. LopezAún no hay calificaciones
- MezclasDocumento1 páginaMezclasDaniel Cruz BecerrilAún no hay calificaciones
- Disoculciones y SolucionesDocumento2 páginasDisoculciones y SolucionesAle CalzadaAún no hay calificaciones
- Tema4 RESUMENDocumento1 páginaTema4 RESUMENIrene Perez BalbuenaAún no hay calificaciones
- Mapas 9 y 10Documento2 páginasMapas 9 y 10GiovanniAún no hay calificaciones
- Lectura de Evaporacion - Libro MccabeDocumento34 páginasLectura de Evaporacion - Libro MccabeSekken JabonesAún no hay calificaciones
- Compuestos OrganicosDocumento1 páginaCompuestos OrganicosMonSorinAún no hay calificaciones
- Mapa - Equilibrio - Iónico. SDALCDocumento1 páginaMapa - Equilibrio - Iónico. SDALCSamantha CruzAún no hay calificaciones
- Coloides 2013Documento7 páginasColoides 2013Uriel VázquezAún no hay calificaciones
- Quim P5 S1Documento2 páginasQuim P5 S1Edison QuintanaAún no hay calificaciones
- 2A DisolucionesDocumento1 página2A DisolucionesAn TonyAún no hay calificaciones
- Sistema Dispersión Tamaño de Partícula Aparien Cia Sedimentació N Tipo de Mezcla Filtrabilida D Refracció Ndelaluz Propiedades Coligativas SoluciónDocumento2 páginasSistema Dispersión Tamaño de Partícula Aparien Cia Sedimentació N Tipo de Mezcla Filtrabilida D Refracció Ndelaluz Propiedades Coligativas SoluciónRuth SalvadorAún no hay calificaciones
- DISOLUCIONESDocumento16 páginasDISOLUCIONESJorge Jimenez cillanAún no hay calificaciones
- Conceptos Básicos de DestilaciónDocumento20 páginasConceptos Básicos de DestilaciónvCPAún no hay calificaciones
- Mapa Conceptual - Quimica de Disolciones Ionicas-AlondraDocumento2 páginasMapa Conceptual - Quimica de Disolciones Ionicas-AlondraAlondra VillArAún no hay calificaciones
- Quimicxa Sipnotico3Documento2 páginasQuimicxa Sipnotico3Carlos Manuel Hernandez EnriquezAún no hay calificaciones
- So Luci OnesDocumento20 páginasSo Luci OnesJamir PastranaAún no hay calificaciones
- Tipos de Mezclas, PropiedadesDocumento11 páginasTipos de Mezclas, Propiedadesl.q.nan.vAún no hay calificaciones
- WWW MindomoDocumento1 páginaWWW MindomoSebastian Arenas CalderónAún no hay calificaciones
- PDF 70153491 I Soluciones DLDocumento31 páginasPDF 70153491 I Soluciones DLManuel G.CAún no hay calificaciones
- Mapa Conceptual de Cinetica de DisolucionDocumento2 páginasMapa Conceptual de Cinetica de DisolucionElio Lazo ChayanAún no hay calificaciones
- Mapa Conceptual Berra Rodriguez Oliblish.Documento1 páginaMapa Conceptual Berra Rodriguez Oliblish.OLIBLISHAún no hay calificaciones
- CARTEL Estados y FuerzasDocumento2 páginasCARTEL Estados y FuerzasAxel Fernando Garcia MedinaAún no hay calificaciones
- Soluciones Químicas: Paes Ciencias Química Común y MenciónDocumento49 páginasSoluciones Químicas: Paes Ciencias Química Común y Menciónsofia andrea ponce de león MoralesAún no hay calificaciones
- Mapa Conceptual - Aleaciones BinariasDocumento1 páginaMapa Conceptual - Aleaciones BinariasKaren SierraAún no hay calificaciones
- Coloide MapaDocumento1 páginaColoide Mapamelanie monroyAún no hay calificaciones
- 4 - PROPIEDADES DE LAS DISOLUCIONES - Parte BDocumento30 páginas4 - PROPIEDADES DE LAS DISOLUCIONES - Parte BLudekasAún no hay calificaciones
- DisolucionesDocumento1 páginaDisolucionesErick CamarilloAún no hay calificaciones
- Propiedades Coligativas..1Documento3 páginasPropiedades Coligativas..1Cataleya MoreAún no hay calificaciones
- Propiedades ColigativasDocumento9 páginasPropiedades ColigativasMARIA VICTORIA NARANJO FABRAAún no hay calificaciones
- Mapa Conceptual Unidad de Concentracion de La DisolucionesDocumento2 páginasMapa Conceptual Unidad de Concentracion de La DisolucionesRonald ChambiAún no hay calificaciones
- Mapa Conceptual - Propiedades ColigativasDocumento1 páginaMapa Conceptual - Propiedades ColigativasHelliot Villarroel0% (1)
- Preinforme SolucionesDocumento10 páginasPreinforme SolucionesPaula MazueraAún no hay calificaciones
- Cuestionario Unidad IVDocumento5 páginasCuestionario Unidad IVDianey CastroAún no hay calificaciones
- Reporte 2 LabEyCDocumento7 páginasReporte 2 LabEyCRodolfo Justo CortesAún no hay calificaciones
- 1 Examne Fisiologia Justo RodolfoDocumento5 páginas1 Examne Fisiologia Justo RodolfoRodolfo Justo CortesAún no hay calificaciones
- Previo de La Práctica 3Documento4 páginasPrevio de La Práctica 3Rodolfo Justo CortesAún no hay calificaciones
- Previo 8 EyCDocumento3 páginasPrevio 8 EyCRodolfo Justo CortesAún no hay calificaciones
- Práctica 5. PrevioDocumento5 páginasPráctica 5. PrevioRodolfo Justo CortesAún no hay calificaciones
- EYC Lab, Previo 7Documento2 páginasEYC Lab, Previo 7Rodolfo Justo CortesAún no hay calificaciones
- Quimica General Manual de Laboratorio BaDocumento95 páginasQuimica General Manual de Laboratorio BaKiara TrafficAún no hay calificaciones
- Bibliografia SugeridaDocumento3 páginasBibliografia SugeridaSoul KingAún no hay calificaciones
- Experiencia 03 - Activ. 02 - 1° Año 2022Documento3 páginasExperiencia 03 - Activ. 02 - 1° Año 2022Monica Gonzáles GonzálesAún no hay calificaciones
- Formulacion y Nomenclatura QuimicaDocumento46 páginasFormulacion y Nomenclatura QuimicaAlejandra FigueroaAún no hay calificaciones
- P1. Conductores ElectricosDocumento13 páginasP1. Conductores ElectricosDanyel k. joviAún no hay calificaciones
- 1a ENZIMOLOGÍA BÁSICA Y CLÍNICADocumento2 páginas1a ENZIMOLOGÍA BÁSICA Y CLÍNICAKatarina BonillaAún no hay calificaciones
- Reporte 2 Destilacion de Alcoholes PDFDocumento24 páginasReporte 2 Destilacion de Alcoholes PDFGabyAún no hay calificaciones
- Sesion N°2-Introd. A Los Procesos Industriales - Diagramas de FlujosDocumento32 páginasSesion N°2-Introd. A Los Procesos Industriales - Diagramas de FlujosLuana Isabel Grimani VelitoAún no hay calificaciones
- HDSM - 004 - ACEITE MOBIL 15W-40 - Docx-2019Documento7 páginasHDSM - 004 - ACEITE MOBIL 15W-40 - Docx-2019Andres Garcia QAún no hay calificaciones
- Acides de La Carne JJJJJDocumento5 páginasAcides de La Carne JJJJJJosue Mendoza choqueAún no hay calificaciones
- Carta para NataliaDocumento2 páginasCarta para Nataliafrancisco tarchettiAún no hay calificaciones
- Cs de La Tierra .Cambios Terrestres (Jose)Documento7 páginasCs de La Tierra .Cambios Terrestres (Jose)Wendys RodriguezAún no hay calificaciones
- Clasificación de Los MineralesDocumento5 páginasClasificación de Los MineralesClaudio PereraAún no hay calificaciones
- 2 Formulas y NomenclaturaDocumento4 páginas2 Formulas y NomenclaturaExodemAún no hay calificaciones
- AlquenosDocumento5 páginasAlquenosLeonardo TonazzolliAún no hay calificaciones
- Lab AQ Guía #7 KjeldahlDocumento5 páginasLab AQ Guía #7 KjeldahlValeria Ordoñez CastroAún no hay calificaciones
- ºespecificaciones Tecnicas - EstructurasDocumento3 páginasºespecificaciones Tecnicas - EstructurasAndres RicoAún no hay calificaciones
- Clase 14 - Unidad 4Documento31 páginasClase 14 - Unidad 4nvalenzuelaAún no hay calificaciones
- Flama OxiacetilénicaDocumento29 páginasFlama OxiacetilénicaKent RobinsonAún no hay calificaciones
- EFECTO DE ENMIENDAS ORGÁNICAS COMERCIALES EN EL DESARROLLO VEGETATIVO DE PORTAINJERTO DE PALTO (Persea Americana Mill) VDocumento72 páginasEFECTO DE ENMIENDAS ORGÁNICAS COMERCIALES EN EL DESARROLLO VEGETATIVO DE PORTAINJERTO DE PALTO (Persea Americana Mill) VLuis A. CFAún no hay calificaciones
- Exportación de Madera Plastica Colombiana Hacia Los Estados UnidosDocumento88 páginasExportación de Madera Plastica Colombiana Hacia Los Estados UnidosBrissvanyUribeChavarriaAún no hay calificaciones
- CuertiembresDocumento27 páginasCuertiembresJose PortocarreroAún no hay calificaciones
- Alkenos (Teoria)Documento2 páginasAlkenos (Teoria)Arturo MJAún no hay calificaciones
- Fertirrigacion de La Teoria A La PracticaDocumento249 páginasFertirrigacion de La Teoria A La PracticaJose Barros100% (2)
- Lab GranulometriaDocumento7 páginasLab Granulometriajuan diego carrilloAún no hay calificaciones
- INTRODUCCIONDocumento15 páginasINTRODUCCIONRobertoCarlosHmaJimenezZappa100% (1)
- NTP 1073Documento6 páginasNTP 1073TioPepeAún no hay calificaciones
- Clase N°5 Aglomerantes Aereos e HidraulicosDocumento102 páginasClase N°5 Aglomerantes Aereos e HidraulicosIgnacio FeijooAún no hay calificaciones
- Taller 1Documento2 páginasTaller 1Juan Esteban MontagutAún no hay calificaciones
- Ferco 1Documento1 páginaFerco 1cesario aguilarAún no hay calificaciones
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Había una vez el átomo: O cómo los científicos imaginan lo invisibleDe EverandHabía una vez el átomo: O cómo los científicos imaginan lo invisibleCalificación: 5 de 5 estrellas5/5 (3)
- Magia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioDe EverandMagia con Bicarbonato de Sodio: Decenas de Remedios y Usos Caseros que te Ahorrarán Dinero y Tiempo Utilizando el Bicarbonato de SodioCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Neurociencia en la escuela: Guía amigable (sin bla bla) para entender cómo funciona el cerebro durante el aprendizajeDe EverandNeurociencia en la escuela: Guía amigable (sin bla bla) para entender cómo funciona el cerebro durante el aprendizajeCalificación: 5 de 5 estrellas5/5 (5)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- SNC - Soporte neurocrítico: De la urgencia a la terapia intensivaDe EverandSNC - Soporte neurocrítico: De la urgencia a la terapia intensivaAún no hay calificaciones
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizDe EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizCalificación: 5 de 5 estrellas5/5 (7)
- Ciencia de datos: La serie de conocimientos esenciales de MIT PressDe EverandCiencia de datos: La serie de conocimientos esenciales de MIT PressCalificación: 5 de 5 estrellas5/5 (1)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Cerebro y silencio: Las claves de la creatividad y la serenidadDe EverandCerebro y silencio: Las claves de la creatividad y la serenidadCalificación: 5 de 5 estrellas5/5 (2)
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)