Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller 1
Cargado por
Juan Esteban MontagutDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Taller 1
Cargado por
Juan Esteban MontagutCopyright:
Formatos disponibles
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS-DEPARTAMENTO DE QUÍMICA
Química de Materiales
TALLER No. 1
;
1. El papel de aluminio que se usa para almacenar alimentos pesa unos 0,83 g
por pulgada cuadrada. ¿Cuantos átomos de aluminio contienen 24 pulgadas
cuadradas de ese papel?.
2. Con las densidades y los pesos atómicos (ver tabla periódica) calcule la
cantidad de átomos por centímetro cúbico de platino.
3. Determinar el número de portadores de carga presentes en un cilindro de
Cu cuyo diámetro es de 10cm y altura de 5dm. La densidad del Cu es
8,94g/cm3 y su peso atómico 63,5g/mol.
Vesfera 4 / 3r 3
4. La piedra caliza es un 85% de carbonato de calcio (CaCO3). ¿Cuántas moles
de esta sal son 70 g de piedra caliza?.
5. La piedra caliza es un 85% de carbonato de calcio (CaCO3). ¿En cuantos
gramos de piedra caliza se encuentran 0,28 moles carbonato de calcio?.
6. La piedra caliza es un 85% de carbonato de calcio (CaCO3). ¿En cuantos
gramos de piedra caliza se encuentran 1.5x1026 moléculas de carbonato de
calcio?.
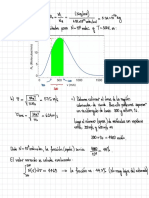
solución
U L 2 I
in not 6,022410"
.I
e
.0,83
.
enx
tin 27
y
2
9,05 X utomos
1023
6,022
21,45 Inot
n
2. Lon
1 imøy
us,1g.
xs00)--
3.
30
2 6,62 X 1022
utomos
3 h 452 en
resen socn 3927
V
:
s
?
=
07
o
;
;
6,022
8,90
Inot
3427
n en
3,sg.
x1o?3é
3-
3.
i
x
1020
I 3, 32 é
4. 70-0,85= 59,5
1
inot moles
= sg 0,6
,5
4
g
100 9
9-,0,20
s 70 32,8
Y
.
g
mot%
G X
6.0,
: mot 3,61
1023
inot
02x10?3
I,
70 1,5 41020 29,.085
0 y
g
I
3,61 X 23
10
También podría gustarte
- Fundamentos de econometría intermedia: Teoría y aplicacionesDe EverandFundamentos de econometría intermedia: Teoría y aplicacionesAún no hay calificaciones
- AGUADocumento1 páginaAGUARuddy FigueroaAún no hay calificaciones
- Mates T3Documento4 páginasMates T3Pilar Colino YáñezAún no hay calificaciones
- Abaco 01Documento1 páginaAbaco 01Segundo FernandezAún no hay calificaciones
- Captura de Pantalla 2020-08-11 A La(s) 3.49.08 P. M.Documento1 páginaCaptura de Pantalla 2020-08-11 A La(s) 3.49.08 P. M.Bladimir RodríguezAún no hay calificaciones
- Teórico 2 - Electrostática. Teorema de Helmholtz. Potenciales y EnergíaDocumento1 páginaTeórico 2 - Electrostática. Teorema de Helmholtz. Potenciales y Energíaaugusto mendezAún no hay calificaciones
- Algebra 「Esteban Madrid」Documento29 páginasAlgebra 「Esteban Madrid」copacabana123eAún no hay calificaciones
- Aplicación 2-Devanado, Campo, FemDocumento6 páginasAplicación 2-Devanado, Campo, FemJhonAún no hay calificaciones
- Anexo - S50 - Plan - de - CapacitaciónDocumento4 páginasAnexo - S50 - Plan - de - CapacitaciónYina DiazAún no hay calificaciones
- SILVERIODocumento1 páginaSILVERIOFredd BñyAún no hay calificaciones
- Largo - Sinfonía 9 Dvorak Nuevo Mundo - UkuleleDocumento1 páginaLargo - Sinfonía 9 Dvorak Nuevo Mundo - Ukulelejacufer283Aún no hay calificaciones
- Prueba 1Documento6 páginasPrueba 1DanielaAún no hay calificaciones
- Cotizacion AprobadaDocumento3 páginasCotizacion AprobadaRosa Tuesta vargasAún no hay calificaciones
- UntitledDocumento3 páginasUntitledAndrea Rodríguez OrrequiaAún no hay calificaciones
- Prueba 1 HoDocumento6 páginasPrueba 1 HoDanielaAún no hay calificaciones
- ComplementariaDocumento1 páginaComplementariaMaría José MartínezAún no hay calificaciones
- Inventario PcoDocumento26 páginasInventario PcoNataniel ReyesAún no hay calificaciones
- Bloc de Notas Sin TítuloDocumento2 páginasBloc de Notas Sin TítuloAlmudena Ros GarciaAún no hay calificaciones
- Mixer ON M5026Documento1 páginaMixer ON M5026Eugenia LorenzatiAún no hay calificaciones
- Mixer ON M 5026Documento1 páginaMixer ON M 5026Eugenia LorenzatiAún no hay calificaciones
- Repaso - )Documento12 páginasRepaso - )Mariano Rafael Paucar AvilaAún no hay calificaciones
- IP 12 Subasta A La BajaDocumento17 páginasIP 12 Subasta A La BajaAnibalAún no hay calificaciones
- Utmach Ep LevantamientoDocumento1 páginaUtmach Ep LevantamientoCarlos Sánchez-MendietaAún no hay calificaciones
- FM Taller 11-1Documento3 páginasFM Taller 11-1John PulidoAún no hay calificaciones
- Presentacion Caliza - TravertinoDocumento18 páginasPresentacion Caliza - TravertinoJorch GalvanAún no hay calificaciones
- 2022.10.19 Acera Calle 1 Lotes 103@107Documento1 página2022.10.19 Acera Calle 1 Lotes 103@107Edgardo CaballeroAún no hay calificaciones
- Problemas MCIADocumento4 páginasProblemas MCIAChristian SanchezAún no hay calificaciones
- Jugando - Con - La - Matemática - 2º - Primaria (2 Parte)Documento33 páginasJugando - Con - La - Matemática - 2º - Primaria (2 Parte)Brenda IdroboAún no hay calificaciones
- SERIES Y SUMATORIAS-teoria y PracticaDocumento3 páginasSERIES Y SUMATORIAS-teoria y PracticaJavier RojasAún no hay calificaciones
- Sobre La Anatomía Del Proceso Del Poder PolíticoDocumento4 páginasSobre La Anatomía Del Proceso Del Poder PolíticoXimenaAún no hay calificaciones
- Hormigon Armado 1.1Documento5 páginasHormigon Armado 1.1TITO CUVIAún no hay calificaciones
- Hidromiel Casera TaringaDocumento5 páginasHidromiel Casera TaringaEric Rivas OrtegaAún no hay calificaciones
- Activdad - 2.1 A01702633Documento4 páginasActivdad - 2.1 A01702633Ana Guadalupe Patiño RamírezAún no hay calificaciones
- 11 04 24Documento10 páginas11 04 24idrovoa469Aún no hay calificaciones
- HormigónDocumento3 páginasHormigónHugo ValdiviaAún no hay calificaciones
- PLANTA DE CONJUNTO (Asesoria 3)Documento1 páginaPLANTA DE CONJUNTO (Asesoria 3)Daniela Fernanda Urizar AvalosAún no hay calificaciones
- Sol TF Taller 6Documento2 páginasSol TF Taller 6KEVIN SANTIAGO DIAZ NIETOAún no hay calificaciones
- UBS JD Do Lago Ofuroterapia R06-ModelDocumento1 páginaUBS JD Do Lago Ofuroterapia R06-ModelThalitaAún no hay calificaciones
- Designation Key For Indexable Inserts For Drilling From Solid Es EsDocumento2 páginasDesignation Key For Indexable Inserts For Drilling From Solid Es EsnyuAún no hay calificaciones
- IDO Tarea 2 p.2Documento1 páginaIDO Tarea 2 p.2ghost blancoAún no hay calificaciones
- Planilla de StokesDocumento1 páginaPlanilla de Stokeseinaroeguez23Aún no hay calificaciones
- Trabajos PracticosDocumento4 páginasTrabajos Practicosdelfina marcucciAún no hay calificaciones
- Ejercicios Voluntarios Temas 8Y9Documento1 páginaEjercicios Voluntarios Temas 8Y9Paula Bravo OrtegaAún no hay calificaciones
- TRABAJODocumento1 páginaTRABAJOAaron Samaniego RimacheAún no hay calificaciones
- Guía-1sec-Especies AtómicasDocumento2 páginasGuía-1sec-Especies AtómicasGiuliana Churano TinocoAún no hay calificaciones
- Calculo Integral PDFDocumento24 páginasCalculo Integral PDFPupatOwOAún no hay calificaciones
- Bruno: Custace 205557Documento2 páginasBruno: Custace 205557Bruno CustodeAún no hay calificaciones
- Excel TanlasDocumento3 páginasExcel Tanlashgcfr8sm87Aún no hay calificaciones
- Plano Ul Aceso Top Perimetrico P TP A 1Documento1 páginaPlano Ul Aceso Top Perimetrico P TP A 1Sarc V VargasAún no hay calificaciones
- Licencia FuncionamDocumento1 páginaLicencia FuncionamDiomedes castilloAún no hay calificaciones
- Plano Planta Perfil Stork - PK13+597 - PbyDocumento1 páginaPlano Planta Perfil Stork - PK13+597 - PbyGiovani Escobar AlzateAún no hay calificaciones
- 28 PACRI Tomo 1 - CompressedDocumento303 páginas28 PACRI Tomo 1 - CompressedAngel SaenzAún no hay calificaciones
- TAREADocumento6 páginasTAREAamichellev29Aún no hay calificaciones
- Bidimensional A)Documento3 páginasBidimensional A)Ismael CopaAún no hay calificaciones
- Arboleda Curva Demanda de Cloro - Teoría y Práctica de La Purificación Del Agua, Tomo 2Documento18 páginasArboleda Curva Demanda de Cloro - Teoría y Práctica de La Purificación Del Agua, Tomo 2ArianaÁlvarez50% (2)
- Algebra Lineal PracticaDocumento34 páginasAlgebra Lineal PracticaJhulen MalloAún no hay calificaciones
- 04 - Seminario 4 2022-2023Documento1 página04 - Seminario 4 2022-2023promocion426.156Aún no hay calificaciones
- Tabla Periódica - Ptable - PropiedadesDocumento1 páginaTabla Periódica - Ptable - Propiedadescayetana.gomez.hidalgoAún no hay calificaciones
- Libro en Gases Arteriales PDFDocumento34 páginasLibro en Gases Arteriales PDFChristianGallegosPalermoAún no hay calificaciones
- Estabilizacion de Suelos Usando Resina ExpansivaDocumento29 páginasEstabilizacion de Suelos Usando Resina ExpansivajoseAún no hay calificaciones
- ET Slurry Seal - CSS-1HPDocumento10 páginasET Slurry Seal - CSS-1HPSteve Yovani100% (1)
- Flujograma Próctor PDFDocumento1 páginaFlujograma Próctor PDFMiguelo AlegriaAún no hay calificaciones
- Equilibrio Liquido-Liquido en El Sistema Ternario Acido Acetico-cloroformo-AguasDocumento14 páginasEquilibrio Liquido-Liquido en El Sistema Ternario Acido Acetico-cloroformo-AguasBranco R. R. Hermoza100% (1)
- Diapositivas de SurfactantesDocumento31 páginasDiapositivas de SurfactantesDayana Jaimes100% (2)
- FCNM Introduccion A La Fisica Moderna para Ingenieros Icf00802Documento4 páginasFCNM Introduccion A La Fisica Moderna para Ingenieros Icf00802Diego Chuquiyauri GomezAún no hay calificaciones
- Coleman ESDocumento162 páginasColeman ESlaura6236Aún no hay calificaciones
- Ponencia Metrados - 2 Hjvmmah PDFDocumento121 páginasPonencia Metrados - 2 Hjvmmah PDFJean Pierre Huamani LeonAún no hay calificaciones
- Equilibrio Físico y QuímicoDocumento4 páginasEquilibrio Físico y QuímicoBrendaJhocelynAún no hay calificaciones
- Ejercicios Propuestos Balance de EnergiaDocumento3 páginasEjercicios Propuestos Balance de EnergiaEmanuele ForteAún no hay calificaciones
- Detectores Gases Toxicos y Oxigeno DragerDocumento5 páginasDetectores Gases Toxicos y Oxigeno DragerelianacelestepereiraAún no hay calificaciones
- Valvulas de SeguridadDocumento25 páginasValvulas de SeguridadFranco Brandalesi100% (1)
- 26499-Article Text-41362-1-10-20190820Documento12 páginas26499-Article Text-41362-1-10-20190820David GermanAún no hay calificaciones
- Clasificacion de Los Metodos AnaliticosDocumento1 páginaClasificacion de Los Metodos Analiticosprimitivo5871% (14)
- Planta de RecicladoDocumento28 páginasPlanta de Recicladoamilcarosorio100% (1)
- Q. AnaliticaDocumento2 páginasQ. AnaliticaMelanieAún no hay calificaciones
- Practica #1Documento10 páginasPractica #1Nicholaus ShawAún no hay calificaciones
- NTP 111.010 2014 - IndustrialesDocumento85 páginasNTP 111.010 2014 - IndustrialesKarina Leyva DelgadoAún no hay calificaciones
- Tema 8. A - Materiales Poliméricos PDFDocumento22 páginasTema 8. A - Materiales Poliméricos PDFSamuelVelázquezAún no hay calificaciones
- Examenfluidossuelos2018 0Documento13 páginasExamenfluidossuelos2018 0KARELIAún no hay calificaciones
- T.ladrilllo HornoDocumento18 páginasT.ladrilllo HornoVanessa Lizet Cancho TayaAún no hay calificaciones
- Ejercicios Introduccion A La Termodinamica Smith Van Ness AbbottDocumento37 páginasEjercicios Introduccion A La Termodinamica Smith Van Ness AbbottRicardo Rosales70% (27)
- Guia Completa Qui112 1 de 2Documento55 páginasGuia Completa Qui112 1 de 2PirtTorre100% (1)
- Interpretación Sísmica de Un Cubo 3D Terrestre en El Sureste de MéxicoDocumento93 páginasInterpretación Sísmica de Un Cubo 3D Terrestre en El Sureste de MéxicoSerafin Hernandez TorresAún no hay calificaciones
- Clorador Informe Val PDFDocumento29 páginasClorador Informe Val PDFAnonymous m2asql7ZAún no hay calificaciones
- Quimica 2Documento30 páginasQuimica 2Erick XavierAún no hay calificaciones
- Ficha Técnica - PegasoDocumento2 páginasFicha Técnica - PegasoCesar Diaz Rojas100% (1)
- Tinte de ColoraciónDocumento12 páginasTinte de ColoraciónLoCVAún no hay calificaciones
- Silabo Original Semestral 2018Documento56 páginasSilabo Original Semestral 2018Evelyn Jiménez MacharéAún no hay calificaciones