Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Bu 090339
Bu 090339
Cargado por
Pamela GutteTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Bu 090339
Bu 090339
Cargado por
Pamela GutteCopyright:
Formatos disponibles
NOTA CLÍNICA
Leucodistrofia hipomielinizante de tipo 6. Claves clínicas
y de neuroimagen en la detección de un nuevo caso
Elvira Otero-Domínguez, Carmen Gómez-Lado, Patricia Fuentes-Pita, David Dacruz, Francisco Barros-Angueira,
Jesús Eirís-Puñal
Introducción. La leucodistrofia hipomielinizante de tipo 6 es una enfermedad neurodegenerativa rara de inicio temprano Servicio de Neuropediatría
(E. Otero-Domínguez, C. Gómez-Lado,
que cursa clínicamente con un patrón de afectación piramidoextrapiramidal y cerebeloso, y asocia en neuroimagen hipo- P. Fuentes-Pita, D. Dacruz, J. Eirís-
mielinización, hipoplasia cerebelosa y anomalías específicas en los ganglios basales, en concreto atrofia o práctica ausen- Puñal). Fundación de Medicina
cia del putamen y posible pérdida del volumen del caudado. Se debe a una alteración en la tubulina, está condicionada Molecular (F. Barros-Angueira).
Hospital Clínico Universitario de
por mutaciones en heterocigosis en el gen TUBB4A y muestra una penetrancia completa y una expresividad variable. Santiago de Compostela. Santiago
de Compostela, A Coruña, España.
Caso clínico. Niño de 8 años con clínica de retraso de la marcha, temblor, disartria, ataxia, nistagmo, afectación cognitiva
y distonía, con un patrón de hipomielinización, hipoplasia vermiana y ausencia del putamen. Estos hallazgos, aunque Correspondencia:
Dr. Jesús Eirís Puñal. Servicio de
distintivos, habían sido infraestimados en valoraciones previas y su objetivación conllevó el análisis y la identificación de Neuropediatría. Hospital Clínico
una variante patógena en el gen TUBB4A. Universitario de Santiago de
Compostela. Travesa da Choupana,
Conclusiones. El deterioro progresivo lleva al paciente a la dependencia total o el fallecimiento en la infancia o la juven- s/n. E-15706 Santiago de Compostela
tud, y no existe tratamiento específico capaz de modificar su curso natural. (A Coruña).
Palabras clave. Ataxia. Distonía. Hipomielinización. Leucodistrofia hipomielinizante de tipo 6. TUBB4A. E-mail:
eirisjm@yahoo.es
Aceptado tras revisión externa:
31.07.18.
Introducción forma precoz o posteriormente, con la evolución de Cómo citar este artículo:
la enfermedad. Otros síntomas neurológicos fre- Otero-Domínguez E, Gómez-Lado C,
Fuentes-Pita P, Dacruz D, Barros-
La leucodistrofia hipomielinizante de tipo 6 o hipo- cuentes, además de las alteraciones motoras, son el Angueira F, Eirís-Puñal J. Leuco-
mielinización con atrofia de los ganglios basales y el nistagmo, la disartria y las dificultades del aprendi- distrofia hipomielinizante de tipo 6.
Claves clínicas y de neuroimagen
cerebelo (OMIM 612438) es una enfermedad rara y zaje. Con menor frecuencia pueden presentarse en la detección de un nuevo caso.
de reciente descubrimiento. Fue en 2002 cuando van trastornos visuales, auditivos y epilepsia. Las alte- Rev Neurol 2018; 67: 339-42.
der Knaap et al describieron por primera vez un raciones cerebelosas causan la ataxia, la hipomieli- © 2018 Revista de Neurología
grupo de siete pacientes con características clínicas nización de los tractos piramidales ocasiona espas-
y prueba de imagen similares lo suficientemente es- ticidad y las alteraciones visuales, la hipoplasia del
pecíficas para presumir que estaban ante un mismo caudado y el putamen es responsable de los signos
tipo de leucoencefalopatía [1]. extrapiramidales, y el trastorno del habla obedece a
El signo de presentación más prevalente de esta una afectación extrapiramidal o cerebelosa [1].
enfermedad es el retraso motor, que deriva poste- Los avances en genética han permitido confirmar
riormente en una marcha diparética o tetraparética, que se trata de una entidad con un origen común, la
con espasticidad y síntomas extrapiramidales [1-6], alteración del gen TUBB4A, que afecta a la síntesis
que aboca evolutivamente a una pérdida temprana de tubulina β-IV [2], proteína constitutiva de los
de la marcha en los casos en los que ésta se haya microtúbulos de las neuronas y las células de la glía,
adquirido. Los hallazgos en la resonancia magnéti- principalmente oligodendrocitos [2,7,8]. La acumu-
ca cerebral son distintivos y conforman un patrón lación de microtúbulos en estas células daría lugar
fácilmente reconocible, incluyendo hipomieliniza- a la hipomielinización cerebral [2,8,9]. Presumible-
ción o ausencia de mielinización de la sustancia blan- mente, la mayor expresión de este gen en el cerebe-
ca, atrofia del vermis, hipoplasia del caudado y au- lo, el putamen y la sustancia blanca da explicación a
sencia o hipoplasia del putamen. En cualquier caso, la afectación preferente en estas áreas [2,9], frente
la combinación de síntomas extrapiramidales y la a la indemnidad en la región talámica, el globo páli-
hipomielinización de la sustancia blanca es casi pa- do y los nervios periféricos [1,2,9]. La sustancia gris
tognomónica de esta entidad [1,3]. La atrofia del cerebral puede verse reducida a largo plazo por atro-
vermis y de los ganglios de la base puede ocurrir de fia secundaria [3,6].
www.neurologia.com Rev Neurol 2018; 67 (9): 339-342 339
E. Otero-Domínguez, et al
dad, titubeo y caídas frecuentes, y temblor manual
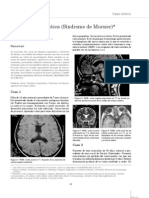
Figura. Imágenes de resonancia magnética del paciente a los 8 años y 3 meses. a) Secuencia axial FLAIR: que condicionaba la caída de objetos. El trastorno
ausencia de putamen, hipomielinización y asimetría en el contorno del asta anterior ventricular, lo que
motor tuvo un empeoramiento progresivo, hasta
sugiere la existencia de una leve atrofia del caudado derecho; b) Secuencia axial en T2: nótese la hiperin-
tensidad de la sustancia blanca, que se corresponde a hipomielinización, y la ausencia de putamen; c) Se- perder la marcha a los 7 años. Refería retraso en el
cuencia sagital en T2: atrofia del vermis cerebeloso. inicio del habla, la cual era de ritmo lento, con múl-
tiples errores articulatorios e inmadurez morfosin-
táctica, por lo que recibía intervención logopédica
a b c desde los 3,5 años. Mostraba problemas de apren-
dizaje desde la escolarización y no llegó a desarro-
llar competencias básicas de lectoescritura. Su ca-
pacidad cognitiva no se había valorado, pero se es-
timaba como muy baja, y precisaba adaptaciones
metodológicas y de acomodación en el entorno es-
colar, así como asistencia a una unidad de estimula-
ción, fisioterapia y terapia ocupacional desde su in-
fancia temprana. En el momento de su valoración
tomaba alimentos triturados por la aparición de epi-
sodios de atragantamiento con sólidos.
En la exploración destacaban signos de afecta-
ción de la vía piramidal, extrapiramidal y cerebelo-
Se han descrito diferentes mutaciones causantes, sa, y presentaba desequilibrio en bipedestación con
todas en el gen TUBB4A en heterocigosis y aconte- apoyo, sin reacción postural de equilibrio, asimetría
cidas de novo, o más raramente por mosaicismo global en la movilidad, con menor afectación del
germinal, como ha podido demostrarse en casos de hemicuerpo izquierdo y espasticidad de los múscu-
hermanos afectos [2,3]. La penetrancia es comple- los de las extremidades inferiores, sobre todo del
ta, con fenotipo clínico variable. La mutación más lado derecho, con hiperreflexia generalizada, pre-
prevalente, descrita por primera vez en el año 2013, dominante en las extremidades inferiores, clonía,
es la c.745G>A (p.Asp249Asn), que parece desarro- Chaddok y Babinski bilaterales. Adoptaba una posi-
llar un fenotipo clínico más leve en comparación ción distónica en las extremidades superiores, con
con otras mutaciones, aunque la evolución a largo apertura manual excesiva previa a la prensión. Los
plazo de la enfermedad no varía [2-6]. movimientos oculares estaban preservados, y pre-
No existe tratamiento específico para la leuco- sentaba nistagmo con sacudidas rápidas y de baja
distrofia hipomielinizante de tipo 6. La evolución amplitud en todas las posiciones de la mirada. El
es progresiva hacia la dependencia total y el falleci- perímetro del cráneo estaba en el percentil 40, con
miento en la infancia o la juventud [4]. La levodopa curva mantenida desde el período neonatal.
se ha utilizado –con resultados variables– como tra- Previamente a la consulta se habían realizado dos
tamiento sintomático para las manifestaciones ex- exploraciones de resonancia magnética cerebral, a
trapiramidales [5]. los 4 años y 7 meses y a los 8 años y 3 meses, que
describieron una hiperintensidad en FLAIR y T2 de
la sustancia blanca, principalmente periventricular,
Caso clínico en relación con retraso/ausencia de mielinización,
hipoplasia del cuerpo calloso y atrofia del vermis
Niño con diagnóstico inespecífico de parálisis cere- cerebeloso. Su reevaluación en el momento de su
bral, remitido a nuestro centro a la edad de 8 años y consulta permitió confirmar los hallazgos referidos y
9 meses para reevaluación diagnóstica. Nacido a las uno clave –la ausencia del putamen bilateral, inad-
42 semanas tras gestación, parto y período neona- vertido hasta el momento–, y una ligera atrofia del
tal sin incidencias. Apgar 6/10 y cribado de meta- caudado derecho (Figura).
bolopatías normal. No presentaba antecedentes fa- La combinación de hallazgos clínicos y radioló-
miliares de interés. Tenía una hermana menor sana gicos propició la sospecha de leucodistrofia hipo-
y no había consanguinidad entre los padres. mielinizante de tipo 6 y conllevó la secuenciación
La clínica se inició a los 4 meses de edad con un del gen TUBB4A, lo que permitió la identificación
nistagmo horizontal, leve hipotonía y menor utiliza- de la mutación c.745G>A (p.Asp249Asn) en hete-
ción de la mano derecha. La deambulación comenzó rocigosis. Los progenitores no fueron estudiados por
a los 2 años, caracterizada por torpeza, inestabili- discontinuación asistencial.
340 www.neurologia.com Rev Neurol 2018; 67 (9): 339-342
Leucodistrofia hipomielinizante de tipo 6
Discusión no alcanzan la deambulación ni llegan a hablar. En
nuestra observación, el paciente llegó a deambular
Las alteraciones de la marcha de inicio temprano y de forma autónoma, su capacidad cognitiva estaba
carácter progresivo, de tipo piramidal y extrapira- afectada en una forma leve y era capaz de comu
midal, con componente cerebeloso, sugieren siem- nicarse de manera efectiva pese a la disartria. Sin
pre un proceso neurodegenerativo, pero son ines- embargo, los síntomas comenzaron en la época de
pecíficas y pueden asociarse a diferentes entidades lactante y perdió pronto la marcha autónoma. El
patológicas, por lo que la aproximación diagnóstica tratamiento se basa en rehabilitación motora y tra-
ha de fundamentarse en hallazgos adicionales que tamiento de contracturas/espasticidad, logopedia,
permitan filtrar y dirigir la búsqueda. Aunque es soporte visual o auditivo si se requiere, y fármacos
habitual que el procedimiento diagnóstico en pro- antiepilépticos en los pocos casos que asocian epi-
cesos de esta entidad conlleve un amplio cribado lepsia [2,4,5].
etiológico que incluya pruebas metabólicas, estu- Nuestro paciente precisó tratamiento rehabilita-
dios electrofisiológicos y de neuroimagen, y evalua- dor motor y del habla, así como modificaciones en
ción oftalmológica o hematológica, entre otras prue- el tipo de alimentación por problemas de deglu-
bas, en ocasiones podemos encontrarnos con algún ción. En cuanto a la evolución, el deterioro fue pre-
hallazgo lo suficientemente específico para que pue- coz y progresivo, al igual que en otras series de pa-
da realizarse una aproximación directa que permita cientes descritos, y era totalmente dependiente para
obviar estudios adicionales. La objetivación de un las actividades de la vida diaria en la fecha de la úl-
patrón de hipomielinización implica que no ha ha- tima consulta a los 9 años.
bido cambios en la señal de la sustancia blanca en
dos pruebas de imagen realizadas con un intervalo En conclusión, se describe un caso de leucodistrofia
al menos de seis meses entre ellas en un paciente hipomielinizante de tipo 6 en el que el deterioro
mayor de 1 año de edad [10]. Sin embargo, este he- progresivo y característico de la marcha y el habla,
cho por sí mismo, aunque permite la exclusión de junto con la afectación piramidal y extrapiramidal,
un elevado número de leucoencefalopatías, nos si- en combinación con los hallazgos específicos de la
túa todavía ante un amplio espectro de posibilida- resonancia magnética cerebral, supusieron la clave
des que se deben considerar dentro del diagnóstico para el diagnóstico. El análisis de secuenciación de
diferencial [10]. Si al patrón de hipomielinización ADN confirmó la etiología de la enfermedad con el
asociamos el hallazgo de ausencia o práctica des- hallazgo de su mutación típica en el gen TUBB4A.
aparición del putamen o caudado y la atrofia del Ante un paciente con extrapiramidalismo e hi-
vermis, podremos concluir que estos datos susten- pomielinización de la sustancia blanca ha de consi-
tan inequívocamente el diagnóstico de leucoencefa- derarse esta posibilidad diagnóstica, y resulta rele-
lopatía hipomielinizante de tipo 6 [1]. Nuestro pa- vante e imprescindible una adecuada valoración clí-
ciente presentó la constelación de alteraciones clí- nica y de las imágenes de resonancia magnética ce-
nicas y de neuroimagen habituales (Figura) y tam- rebral, claves éstas por su especificidad para una
bién la hipoplasia del cuerpo calloso [1-6] descrita correcta identificación etiológica, que podrá corro-
como hallazgo adicional. El estudio genético fue borarse con el oportuno estudio genético.
positivo para la mutación c.745G>A (p.Asp249Asn)
en heterocigosis en el gen TUBB4A. Esta mutación Bibliografía
es la que más frecuentemente ocasiona la enferme- 1. Van der Knaap MS, Naidu S, Pouwels PJ, Bonavita S,
dad [2,3]. Aunque no se pudo estudiar a los padres, Van Coster R, Lagae L, et al. New syndrome characterized
dada la gravedad de la enfermedad y su letalidad a by hypomyelination with atrophy of the basal ganglia and
cerebellum. AJNR Am J Neuroradiol 2002; 23: 1466-74.
temprana edad, y teniendo una hermana sana, con 2. Simons C, Wolf NI, McNeil N, Caldovic L, Devaney JM,
gran probabilidad se trata de una mutación de novo, Takanohashi A, et al. A de novo mutation in the betatubulin
sin poder descartar la posibilidad de un mosaicis- gene TUBB4A results in the leukoencephalopathy hypo-
myelination with atrophy of the basal ganglia and cerebellum.
mo germinal, como se ha señalado en algunos casos Am J Hum Genet 2013; 92: 767-73.
[2]. Tal como parecen indicar algunos estudios, la 3. Hamilton EM, Polder E, Vanderver A, Naidu S, Schiffmann R,
mutación que presenta este paciente podría conlle- Fisher K, et al. Hypomyelination with atrophy of the basal
ganglia and cerebellum: further delineation of the phenotype
var una clínica menos grave que la asociada a otras and genotype-phenotype correlation. Brain 2014; 137: 1921-30.
variantes [2,3]. Al respecto, algunos pacientes pue- 4. Van der Knaap MS, Linnankivi T, Paetau A, Feigenbaum A,
den tener un desarrollo relativamente preservado Wakusawa K, Haginoya K, et al. Hypomyelination with atrophy
of the basal ganglia and cerebellum. Follow-up and pathology.
en etapas precoces de su enfermedad, sin retrasos Neurology 2007; 69: 166-71.
significativos en hitos motores, mientras que otros 5. Tonduti D, Aiello C, Renaldo F, Dorboz I, Saaman S, Rodríguez D,
www.neurologia.com Rev Neurol 2018; 67 (9): 339-342 341
E. Otero-Domínguez, et al
et al. TUBB4A-related hypomyelinating leukodystrophy: new Wolf NI, et al. TUBB4A mutations result in specific neuronal
insights from a series of 12 patients. Eur J Paediatr Neurol and oligodendrocytic defects that closely match clinically
2016; 20: 323-30. distinct phenotypes. Hum Mol Genet 2017; 26: 4506-18.
6. Ferreira C, Poretti A, Cohen J, Hamosh A, Naidu S. Novel 9. Duncan ID, Bugiani M, Radcliff AB, Morán JJ, López-Anido C,
TUBB4A mutations and expansion of the neuroimaging Duong P, et al. A mutation in the TUBB4A gene leads to micro-
phenotype of hypomyelination with atrophy of the basal ganglia tubule accumulation with hypomyelination and demyelination.
and cerebellum (H-ABC). Am J Med Genet 2014; 164A: 1802-7. Ann Neurol 2017; 81: 690-702.
7. Ludueuna RF. Are tubulin isotypes functionally significant. 10. Schiffmann R, Van der Knaap MS. An MRI-based approach
Mol Biol Cell 1993; 4: 445-57. to the diagnosis of white matter disorders. Neurology 2009;
8. Curiel J, Rodríguez-Bey G, Takanohashi A, Bugiani M, Fu X, 72: 750-9.
Hypomyelinating leukodystrophy type 6. Clinical and neuroimaging key features in the detection
of a new case
Introduction. Hypomyelinating leukodystrophy-6 is a rare and early onset neurodegenerative disease which entails a clinical
pattern of pyramidal-extrapyramidal and cerebellar involvement and it comes with a neuroimaging consisting of hypo
mielination, cerebellar hypoplasia and specific abnormalities in basal ganglia, particularly the absence or nearly absence
of putamen and the possible loss of caudate’s volume. It is due to an alteration in tubulin and it is determined by mutations
in heterocygosis in TUBB4A gene, showing complete penetrance.
Case report. An 8-year-old child with history of delayed motor development, tremor, dysathria, ataxia, nystagmus,
cognitive deficit and dystonia with pattern of hypomielination, vermis hypoplasia and absence of putamen. These findings,
although distinctive, had been underestimated in previous evaluations and their detection determined the analyse and
identification of a pathogenic variant in TUBB4A gene.
Conclusions. Progressive deterioration leads the patient to total dependence or death in infancy or youth and there is no
specific treatment capable of modifying its natural course.
Key words. Ataxia. Dystonia. Hypomyelinating leukodystrophy type 6. Hypomyelination. TUBB4A.
342 www.neurologia.com Rev Neurol 2018; 67 (9): 339-342
También podría gustarte
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Masajes OrofacialesDocumento45 páginasMasajes OrofacialesYelén Rojas MacoAún no hay calificaciones
- Enfermedad de HuntingtonDocumento11 páginasEnfermedad de HuntingtonmarcelaAún no hay calificaciones
- Instrucciones Protocolo de Evaluacion de HablaDocumento9 páginasInstrucciones Protocolo de Evaluacion de HablaRachel Andrea100% (2)
- Demencia FrontotemporalDocumento40 páginasDemencia FrontotemporalHenry Daniel100% (1)
- La Enfermedad de PickDocumento7 páginasLa Enfermedad de Pickcarla100% (1)
- Enfermedades NeurodegenerativasDocumento33 páginasEnfermedades NeurodegenerativasSofía Vanessa Velázquez JuárezAún no hay calificaciones
- Apunte de Estudio, Disartria, FonoaprendoDocumento47 páginasApunte de Estudio, Disartria, FonoaprendoDaniela aguirre abarca100% (1)
- Degeneración Cortico BasalDocumento8 páginasDegeneración Cortico BasalAnonymous zxTFUoqzklAún no hay calificaciones
- ACV ISQ - CASO CLINICO - OdtDocumento19 páginasACV ISQ - CASO CLINICO - OdtERICK FABIAN GARCIA SERRANOAún no hay calificaciones
- Las Disartrias-Rafael Gonzales PDFDocumento12 páginasLas Disartrias-Rafael Gonzales PDFANA CRISTINA MENDEZ DIAZAún no hay calificaciones
- Informe Fonoaudiológico - Julio BravoDocumento5 páginasInforme Fonoaudiológico - Julio BravoLoreto Andrea IbarAún no hay calificaciones
- Etiología AutismoDocumento99 páginasEtiología AutismoFausto D. Gomez100% (1)
- DISGLOSIA y DisartiaDocumento3 páginasDISGLOSIA y DisartiaDELFINA VILLAR FLORES100% (1)
- Terapia para La Disartria PDFDocumento43 páginasTerapia para La Disartria PDFMaría Paz Sepúlveda Reveco100% (1)
- Corea de HuntingtonDocumento2 páginasCorea de HuntingtonRuben PelaezAún no hay calificaciones
- SX MorssierDocumento4 páginasSX MorssierPatricia TufiÑoAún no hay calificaciones
- Reviisón Bibliográfica - Atrofia Muscular EspinalDocumento6 páginasReviisón Bibliográfica - Atrofia Muscular EspinalbaldovereAún no hay calificaciones
- Enfermedad de Huntington: U N A M F E S I PDocumento6 páginasEnfermedad de Huntington: U N A M F E S I PBrenda bonilla garciaAún no hay calificaciones
- 11 2 DEMENCIA Demencia AlzheimerDocumento39 páginas11 2 DEMENCIA Demencia AlzheimerSHAUL BEL SOTOMAYERAún no hay calificaciones
- Enfermedades Raras - WordDocumento9 páginasEnfermedades Raras - WordKiara ElíasAún no hay calificaciones
- Demencia Frontotemporal PDFDocumento10 páginasDemencia Frontotemporal PDFNoe ZapataAún no hay calificaciones
- Autismo, Epilepsia y Patologia Del Lobulo TemporalDocumento11 páginasAutismo, Epilepsia y Patologia Del Lobulo TemporalLuis TejeroAún no hay calificaciones
- Amnesia y Demensia SemanticaDocumento30 páginasAmnesia y Demensia SemanticaMaria Antezana OliveraAún no hay calificaciones
- Ciliopatías PDFDocumento2 páginasCiliopatías PDFSthefany Sato AguirreAún no hay calificaciones
- DemenciasDocumento4 páginasDemenciasRK Ohashi MendezAún no hay calificaciones
- Fisiopatologia Demencia ClaseDocumento25 páginasFisiopatologia Demencia ClaseYanet AsteteAún no hay calificaciones
- AlzheimerDocumento44 páginasAlzheimerChuy ManchaAún no hay calificaciones
- Caso Clínico - Ataxia de FriedreichDocumento17 páginasCaso Clínico - Ataxia de FriedreichMishel MochaAún no hay calificaciones
- Enfermedad de AlzheimerDocumento8 páginasEnfermedad de AlzheimerSusyy MarínAún no hay calificaciones
- Demencias HereditariasDocumento7 páginasDemencias HereditariasAbigail MolinaAún no hay calificaciones
- Módulo Iii T8Documento24 páginasMódulo Iii T8Ana Anaya GarcíaAún no hay calificaciones
- Demencia Frontotemporal: Camila Elgueta AcuñaDocumento14 páginasDemencia Frontotemporal: Camila Elgueta AcuñaCamila Elgueta AcuñaAún no hay calificaciones
- Enfermedad de HuntingtonDocumento2 páginasEnfermedad de HuntingtonLuis SuárezAún no hay calificaciones
- Enfermedad de Creutzeeldt Jacob en El Perú, Reporte de Once CasosDocumento6 páginasEnfermedad de Creutzeeldt Jacob en El Perú, Reporte de Once CasosCristhianEsequielQuispelayoRamosAún no hay calificaciones
- Sindrome de JoubertDocumento13 páginasSindrome de JoubertMiguel Angel Villarreal YbazetaAún no hay calificaciones
- Enfermedad Del Alzheimer Word NuevoDocumento3 páginasEnfermedad Del Alzheimer Word NuevocindyAún no hay calificaciones
- Embriopatía Por Isotretinoína Un Daño EvitableDocumento4 páginasEmbriopatía Por Isotretinoína Un Daño EvitableJean CarlosAún no hay calificaciones
- PRESENTACIÓN SD WestDocumento11 páginasPRESENTACIÓN SD WestCristhian Santos BejarAún no hay calificaciones
- Poster OINDocumento1 páginaPoster OINNeuro - Clínica de NeurologíaAún no hay calificaciones
- TrabajoIntegrador KatherineRojas Aaron PaillalDocumento7 páginasTrabajoIntegrador KatherineRojas Aaron PaillalKatherine Rojas PenaililloAún no hay calificaciones
- Enfermedad de FahrDocumento7 páginasEnfermedad de FahrAlex Rivas VillalvaAún no hay calificaciones
- AME Casos ClínicosDocumento15 páginasAME Casos ClínicosbarbaraAún no hay calificaciones
- SC Caso ClinicoDocumento2 páginasSC Caso ClinicoMatias Campos VenegasAún no hay calificaciones
- 11-Atrofia Muscular Espinal PDFDocumento3 páginas11-Atrofia Muscular Espinal PDFSally VelazquezAún no hay calificaciones
- Informe Case Report THDocumento5 páginasInforme Case Report THvrik20001Aún no hay calificaciones
- Degeneración Del Lóbulo FrontalDocumento8 páginasDegeneración Del Lóbulo FrontalBarbara Castillo CortesAún no hay calificaciones
- Zamora Ambar Caso Clinico EncefalopatiasDocumento16 páginasZamora Ambar Caso Clinico EncefalopatiasRoxanaAún no hay calificaciones
- Casos ClínicosDocumento3 páginasCasos ClínicosMaura MeloAún no hay calificaciones
- Alzheimer - RevisiónDocumento12 páginasAlzheimer - RevisiónpsychforallAún no hay calificaciones
- PANTOJA 2020 Frontotemporal IMAGENDocumento2 páginasPANTOJA 2020 Frontotemporal IMAGENMAXIMILIANO HEREDIAAún no hay calificaciones
- Actividad 6 Insomnio Familiar FatalDocumento9 páginasActividad 6 Insomnio Familiar FatalKevin Sierra GiraldoAún no hay calificaciones
- 354-Texto Del Artículo-883-1-10-20190413Documento3 páginas354-Texto Del Artículo-883-1-10-20190413OLA MILLERAún no hay calificaciones
- Estudio de Caso Insomnio Familiar FatalDocumento5 páginasEstudio de Caso Insomnio Familiar FatalDaniel Santiago PiscoAún no hay calificaciones
- AlzheimerDocumento13 páginasAlzheimerVilma FigueroaAún no hay calificaciones
- Enfermedades de La Sinpsis 1Documento6 páginasEnfermedades de La Sinpsis 1LETICIA DEL PILAR CASTREJON MAYNAAún no hay calificaciones
- Enfermedad de HuntingtonDocumento19 páginasEnfermedad de HuntingtonHair Alexander Rojas RojasAún no hay calificaciones
- Hipoacusia Neurosensorial Secundaria A EnfermedadDocumento4 páginasHipoacusia Neurosensorial Secundaria A EnfermedadPerla YedroAún no hay calificaciones
- Bioquimica Del AlzheimerDocumento8 páginasBioquimica Del AlzheimerLilia González parianAún no hay calificaciones
- Bioenergetica - Metabolismo de CarbohidratosDocumento41 páginasBioenergetica - Metabolismo de CarbohidratosRosa AlvaradoAún no hay calificaciones
- Demencias de Origen InfecciosoDocumento5 páginasDemencias de Origen InfecciosoLeidy JuliethAún no hay calificaciones
- Aprendizaje No Verbal y Espectro Autista Aprendizaje Procesal Desequilibrio MnésicoDocumento1 páginaAprendizaje No Verbal y Espectro Autista Aprendizaje Procesal Desequilibrio Mnésicoromero_munguia7901Aún no hay calificaciones
- CINESIOPATOLOGIADocumento17 páginasCINESIOPATOLOGIADaniel Angulo FunezAún no hay calificaciones
- Investigación Enfermedades GenéticasDocumento21 páginasInvestigación Enfermedades GenéticasKeebeth Espinal de ReyesAún no hay calificaciones
- T2-Síndrome Amnésico Del Lóbulo Temporal MedialDocumento5 páginasT2-Síndrome Amnésico Del Lóbulo Temporal MedialMarinaAún no hay calificaciones
- InstrumentaciónDocumento24 páginasInstrumentaciónJeisson MenaAún no hay calificaciones
- Alucinaciones Musicales en AncianosDocumento2 páginasAlucinaciones Musicales en AncianoskallfunAún no hay calificaciones
- Enfermedad de AlzheimerDocumento8 páginasEnfermedad de Alzheimerzajuarez98Aún no hay calificaciones
- Disartria CerebelosaDocumento4 páginasDisartria CerebelosaMaria TolentinoAún no hay calificaciones
- Trastornos Del Lenguaje, Del Habla y de La VozDocumento7 páginasTrastornos Del Lenguaje, Del Habla y de La VozNelson RodriguezAún no hay calificaciones
- Alteraciones Neuropsicologicas Del Lenguaje y PensamientoDocumento42 páginasAlteraciones Neuropsicologicas Del Lenguaje y PensamientoJosé Eduardo GÓNZALO MAMANIAún no hay calificaciones
- Clase Disartria IDocumento58 páginasClase Disartria IMARIA SOFIA VALENCIA RIOSAún no hay calificaciones
- Neurociencia 7Documento6 páginasNeurociencia 7Juan carlos Grimaldo maruriAún no hay calificaciones
- Casos Clínicos Adulto I: RespuestasDocumento3 páginasCasos Clínicos Adulto I: Respuestasvalentina jara sotoAún no hay calificaciones
- Tema 2 Expresion y ComunicacionDocumento15 páginasTema 2 Expresion y ComunicacionSara Abigail Vizcaino PerezAún no hay calificaciones
- Lesiones Cerebrales.Documento18 páginasLesiones Cerebrales.Luis D. TeodoroAún no hay calificaciones
- Estilos y Las Alteraciones Del AprendizajeDocumento2 páginasEstilos y Las Alteraciones Del AprendizajeSandra Cetina100% (1)
- Medicina Interna 3Documento123 páginasMedicina Interna 3Josselyn OviedoAún no hay calificaciones
- Alteración de Organos FonoarticulatoriosDocumento19 páginasAlteración de Organos Fonoarticulatoriosjtjsl100% (1)
- Disastria Hipocinética, Hipercinética y MixtaDocumento17 páginasDisastria Hipocinética, Hipercinética y MixtaFauricio Alexander PeñaAún no hay calificaciones
- Bases Neuroanatomicas y Funcionales Del LenguajeDocumento5 páginasBases Neuroanatomicas y Funcionales Del LenguajeMarcelo BardalesAún no hay calificaciones
- Seminario DisartriaDocumento12 páginasSeminario DisartriaBasti170 PvPAún no hay calificaciones
- Tarea La Dislalia-YuleinyDocumento3 páginasTarea La Dislalia-YuleinyPedro DelacruzmorelAún no hay calificaciones
- Exploración NeurológicaDocumento36 páginasExploración NeurológicaTai LinAún no hay calificaciones
- LogopediaDocumento8 páginasLogopediaLeslie OversluijsAún no hay calificaciones
- Paralisis y ParaplejiaDocumento21 páginasParalisis y ParaplejiaOscar GarcíaAún no hay calificaciones
- Fustinoni ExamenDocumento25 páginasFustinoni ExamenEvelyn JadïraAún no hay calificaciones
- Disartria y BradilaliaDocumento4 páginasDisartria y BradilaliagracielaAún no hay calificaciones
- Pae Evelyn TatianaDocumento55 páginasPae Evelyn TatianaYenny Suxe SánchezAún no hay calificaciones
- Clase 4 Intervención en Disartrias 2Documento47 páginasClase 4 Intervención en Disartrias 2Maria jose Hernandez CalzadillaAún no hay calificaciones