Documentos de Académico
Documentos de Profesional
Documentos de Cultura
A3 S1 Rosas Melissa
A3 S1 Rosas Melissa
Cargado por
Melissa RosasDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
A3 S1 Rosas Melissa
A3 S1 Rosas Melissa
Cargado por
Melissa RosasCopyright:
Formatos disponibles
TECNOLOGICO NACIONAL DE MEXICO CAMPUS CANANEA
Rosas Leon Melissa
Numero de control: 21691105
Química
Ing. Elda Portillo
Grupo: 602
09 de septiembre del 2021
H. Arizpe, Sonora, México.
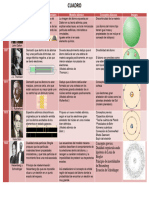
Nombre del
modelo o
Nombre del Descripción del modelo atómico o modelo
Fecha aportación a Ilustración
Científico matemático de la teoría cuántica
la teoría
cuántica
Demócrito (padre de Teoría atómica del • Los átomos son eternos, indivisibles, homogéneos,
450 a. C.
la física) universo incompresibles e invisibles.
ley de • Cuando ocurra un cambio químico en un sistema cerrado, la
Antoine Lavoisier 1785 conservación de la masa de los productos obtenidos era igual a la de los
masa reactivos, la masa se mantenía constante.
Ley de
• Algunas sustancias especificas siempre contienen algunos
Joseph Proust proporciones
elementos en la misma proporción de masas.
definidas
• Bajo ciertas condiciones químicas la materia puede ser
transformada en muchas formas, pero no puede ser creada
ni destruida
Jonh Dalton 1808 Teoría atómica
• Todas las sustancias (materia) están compuestas de
átomos, partículas indivisibles que no pueden ser creadas ni
destruidas
• El átomo es una esfera de materia con carga positiva
Modelo pastel de
J.J. Thomson 1897 uniforme en la cual los electrones estaban incrustados como
pasas
las pasas
Nombre del
modelo o
Nombre del Descripción del modelo atómico o modelo
Fecha aportación a Ilustración
Científico matemático de la teoría cuántica
la teoría
cuántica
Fenómeno de
• La energía estaba cuantizada
Max Plank 1900 radiación del
• No solo la energía sino la materia es discontinua
cuerpo negro
• Consiste en la emisión de electrones por un material al
incidir sobre la una radiación electromagnética (luz visible o
Albert Einstein 1905 Efecto fotoeléctrico
ultravioleta)
• Afirmación sobre que no solo la materia don discontinuadas
• la carga eléctrica está “cuantizada
Carga de
Robert Millikan 1909 • Logro medir la carga de un electrón y calcular la masa
electrones
siendo 9.10x10-28 g
• El átomo tiene un núcleo central en el que está concentrada
la carga positiva, y casi toda su masa.
• Descubrió que todas que casi todas las partículas pasaban
Modelo nuclear del a través de la lámina sin desviación mientras unas cuantas
Lord Rutherford 1911
átomo partículas se desviaban hacia atrás en la dirección de donde
provenían
• Los electrones tienen cargas negativas y son atraídos hacia
el núcleo positivo.
Nombre del
modelo o
Nombre del Descripción del modelo atómico o modelo
Fecha aportación a Ilustración
Científico matemático de la teoría cuántica
la teoría
cuántica
• Cada elemento posee un espectro diferente al de los demás
elementos
• Por lo que es imposible que un electrón permanezca en
algún punto intermedio entre dos orbitas
• Cada orbita posee una determinada energía y entre más
cerca se encuentra del núcleo menos energía tiene
• Todos los átomos tienen un numero infinito de orbitas
Modelo niveles de
Niels Bohr 1913 permitidas
energía
• Cuando los electrones regresan a la órbita original liberan
energía emitiendo luz y dando lugar a los espectros
atómicos
• La energía se absorbe o emite, en forma de energía radiante
(fotón)
• La absorción y la emisión de energía de los materiales se
lleva acabo, no de manera continua, si no en cantidades fijas
de energía.
Nombre del
modelo o
Nombre del Descripción del modelo atómico o modelo
Fecha aportación a Ilustración
Científico matemático de la teoría cuántica
la teoría
cuántica
• Introdujo dos modificaciones básicas: orbitas casi elípticas
para los electrones y velocidades relativas
• La excéntrica de la órbita dio un nuevo número cuántico: el
número cuántico azimutal, que determina la forma de las
modelo atómico de
Sommerfeld 1916 orbitas, se le representa con la letra L y toma valores que va
Sommerfeld
desde 0 hasta n-1
• El efecto fotoeléctrico es el fenómeno en el que las
partículas de luz llamada fotón, impactan con los electrones
de un metal arrancando sus átomos
• Asevero la dualidad onda-partícula de los electrones,
modelo atómico de sentando las bases de la mecánica ondulatoria
Broglie 1924
Broglie Explico el movimiento de los electrones alrededor del núcleo
atómico
• Principio de indeterminación o incertidumbre: es imposible
conocer simultáneamente la posición y la velocidad del
Modelo atómico de
Heisenberg 1925 electrón y por lo tanto imposible determinar su trayectoria
Heisenberg
• Cuanto mayor sea la exactitud con que se conozca la
posición, mayor será el error en la velocidad y viceversa.
Nombre del
modelo o
Nombre del Descripción del modelo atómico o modelo
Fecha aportación a Ilustración
Científico matemático de la teoría cuántica
la teoría
cuántica
• El comportamiento del electrón en función de sus
características andularios
• El núcleo del átomo está rodeado por una nube tenue de
electrones que retiene el concepto de niveles estacionarios
de energía donde no le atribuye al electrón trayectorias
definidas donde describe su localización en términos de
Modelo nube de probabilidad
E. Shrodinger 1926
electrones • La posición probable de un elemento está determinada por
cuatro parámetros llamados cuánticos los cuales tienen
valores dependientes entre si
• En el átomo hay tres clases de partículas: los electrones,
protones y neutrones.
• El número atómico (Z) de un elemento químico es igual al
número de protones de su núcleo
• Presencia de partículas neutras en el núcleo; estas
Descubrio el partículas se le conoce como neutrones y tienen una masa
James Chadwick 1932
neutrón similar a la que poseen los protones, una partícula atómica
sin carga en el núcleo del átomo
Conclusión
Toda sustancia se puede dividir hasta que se obtenga las partículas mas
pequeñas posibles a eso le llaman átomos;
Un sistema atómico está compuesto por un modelo atómico que es una
representación estructural de un átomo, que trata de explicar su comportamiento y
propiedades. Existen varios modelos atómicos y algunos más elaborados que
otros como: el modelo atómico de Rutherford (1911), el primero que distingue
entre el núcleo central y una nube de electrones a su alrededor y el modelo
atómico de Bohr (1913), que es un modelo cuantizado del átomo, con electrones
girando en órbitas circulares. El átomo está formado por dos partes: núcleo y
corteza. El núcleo es la parte central, de tamaño muy pequeño, donde se
encuentra toda la carga positiva (protón) y, prácticamente, toda la masa del átomo.
La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del
núcleo, aquí se encuentran los electrones con masa muy pequeña y carga
negativa (electrón). En los átomos neutros, la carga negativa de los electrones
está neutralizada por la carga positiva del núcleo, un átomo de este tipo se dice
que no está cargado. Esto implica que el número de los electrones que rodean al
núcleo sea igual al número de protones.
Gracias a científicos como Lavoisier, Proust, Plank, Einstein que motivaron a otros
científicos con sus trabajos para mejorar el modelo atómico, aun siendo que ellos
concretaban su trabajo sin ese fin.
También podría gustarte
- A2 S2 Rosas MelissaDocumento4 páginasA2 S2 Rosas MelissaMelissa RosasAún no hay calificaciones
- Bleichmar - Construcción de Legalidades Como Principio EducativoDocumento2 páginasBleichmar - Construcción de Legalidades Como Principio EducativoLuz Olivares67% (9)
- Rodando - Katz.manual Del Director de CinergmDocumento53 páginasRodando - Katz.manual Del Director de CinergmRenato Urquiaga SalcedoAún no hay calificaciones
- Resumen QuimicaDocumento51 páginasResumen QuimicaVale GárateAún no hay calificaciones
- Modelos ATOMICOSDocumento17 páginasModelos ATOMICOSEve ValdesAún no hay calificaciones
- Semana 2-1 - Estructura AtómicaDocumento39 páginasSemana 2-1 - Estructura AtómicaAntonella SuyónAún no hay calificaciones
- Resumen Química Común - Diferenciado PDFDocumento112 páginasResumen Química Común - Diferenciado PDFIsaac Sepulveda100% (1)
- Resumen Química Común - DiferenciadoDocumento112 páginasResumen Química Común - DiferenciadoJENNIFER POBLETE CONTRERAS100% (1)
- Teoría Atómica 8° CLAS. N°2Documento24 páginasTeoría Atómica 8° CLAS. N°2daniela100% (1)
- Materia Química OctavoDocumento21 páginasMateria Química OctavoLeonor VerdugoAún no hay calificaciones
- Teorias AtomicasDocumento10 páginasTeorias AtomicasMaritere1012Aún no hay calificaciones
- El ÁtomoDocumento16 páginasEl ÁtomoDaniel OrtuñoAún no hay calificaciones
- ModelosDocumento43 páginasModelosJesus HernándezAún no hay calificaciones
- TEMA5 AtomoDocumento10 páginasTEMA5 AtomoÁlvaro Muñoz PardinaAún no hay calificaciones
- Modelos AtómicosDocumento27 páginasModelos AtómicosMiryam Aguilar Velásquez100% (1)
- Taller Modelos AtomicosDocumento2 páginasTaller Modelos AtomicosJenny Patricia Mina Balanta0% (1)
- Quimica General Clase 1Documento48 páginasQuimica General Clase 1Barbara Reyes AriasAún no hay calificaciones
- Modelos AtómicosDocumento18 páginasModelos AtómicosAna Jenny PérezRojasAún no hay calificaciones
- Taller Modelos AtomicosDocumento3 páginasTaller Modelos AtomicosAleja DiazAún no hay calificaciones
- ModelosDocumento42 páginasModelosBriam Arnold Estrella RojasAún no hay calificaciones
- Cuadro Comparativo Modelos Atómicos - 004454Documento4 páginasCuadro Comparativo Modelos Atómicos - 004454Melissa CalzadaAún no hay calificaciones
- Semana 02. Teoría Atómica, Estructura Atómica, Unidades Químicas de MasaDocumento7 páginasSemana 02. Teoría Atómica, Estructura Atómica, Unidades Químicas de MasaLeyri DiazAún no hay calificaciones
- EXPOSICION DE FISICA MODERNA Nucleo AtomicoDocumento39 páginasEXPOSICION DE FISICA MODERNA Nucleo AtomicoEstefanny Estrada MoralesAún no hay calificaciones
- Tarea N3 Teoria AtomicaDocumento9 páginasTarea N3 Teoria AtomicaXavier MartinezAún no hay calificaciones
- Quimica 2 Semana 2Documento42 páginasQuimica 2 Semana 2SANTOS DIANAAún no hay calificaciones
- Clase 1 Modelos Atómicos, Estructura Atómica y Tipos de ÁtomosDocumento27 páginasClase 1 Modelos Atómicos, Estructura Atómica y Tipos de ÁtomosluisAún no hay calificaciones
- La Fascinante Historia de Los Modelos Atà Micos 4 de AbrilDocumento20 páginasLa Fascinante Historia de Los Modelos Atà Micos 4 de Abrilest.benjamin.munoz21Aún no hay calificaciones
- CIM Clase3 202320Documento30 páginasCIM Clase3 202320José David JaramilloAún no hay calificaciones
- Resumen Química PDFDocumento72 páginasResumen Química PDFAndrea PalmaAún no hay calificaciones
- Modelo AtomicoDocumento15 páginasModelo AtomicoCristian CarrascoAún no hay calificaciones
- Cuadro Comparativo de Los Modelos AtomicosDocumento1 páginaCuadro Comparativo de Los Modelos Atomicoslautarobre10Aún no hay calificaciones
- Infografia Historia Del Modelo AtomicoDocumento1 páginaInfografia Historia Del Modelo AtomicoCatalina Almendra Palma PintoAún no hay calificaciones
- Presentación Tema 4Documento38 páginasPresentación Tema 4Samuel Cortina PinaAún no hay calificaciones
- Estructura Atomica II - QuimicaDocumento4 páginasEstructura Atomica II - QuimicaBrinny VelazcoAún no hay calificaciones
- Unidad IIIDocumento30 páginasUnidad IIIQuique Marts TellezAún no hay calificaciones
- Tema n1. Teorias AtomicasDocumento21 páginasTema n1. Teorias AtomicasYovana SaavedraAún no hay calificaciones
- Modelos AtómicosDocumento19 páginasModelos AtómicosMarlene Plaza RiveraAún no hay calificaciones
- Teoria Atomica 1 v2.0Documento32 páginasTeoria Atomica 1 v2.0JOSE ANGEL BARRAZA CARRILLOAún no hay calificaciones
- Anexo No 2 Modelos AtómicosDocumento4 páginasAnexo No 2 Modelos AtómicosLuz Nelly Maya OrtizAún no hay calificaciones
- Presentación 1Documento17 páginasPresentación 1Nia NiaAún no hay calificaciones
- Los Modelos AtómicosDocumento16 páginasLos Modelos AtómicosBrigite Veronica Sonco GonzaloAún no hay calificaciones
- Clase 1Documento46 páginasClase 1JonatanAún no hay calificaciones
- Teoría Atómica y Estructura de La Materia Equipo 3Documento23 páginasTeoría Atómica y Estructura de La Materia Equipo 3lesliemartinezAún no hay calificaciones
- 2 - Átomo - Teoría CuánticaDocumento32 páginas2 - Átomo - Teoría Cuánticamadyuridramos25Aún no hay calificaciones
- Teoria Atomica 1 - QGDocumento31 páginasTeoria Atomica 1 - QGRosi DarAún no hay calificaciones
- Modelos AtomicosDocumento20 páginasModelos AtomicoscrissilviaAún no hay calificaciones
- El Nucle Atomico ExpocicionDocumento9 páginasEl Nucle Atomico ExpocicionMirian Pashanase laviAún no hay calificaciones
- Química PREDocumento4 páginasQuímica PREVictor Huerta RojasAún no hay calificaciones
- Modelos y Teorías AtómicasDocumento22 páginasModelos y Teorías AtómicasSimon Grisales Henao100% (1)
- Experimentos de ÁtomosDocumento3 páginasExperimentos de ÁtomosViviana LascanoAún no hay calificaciones
- Aporte Estructura MolecularDocumento3 páginasAporte Estructura MolecularMartha Echeverri TrochezAún no hay calificaciones
- Clase 2 - QG Unidad II - 02022022Documento22 páginasClase 2 - QG Unidad II - 02022022Juan Emmanuel Flores RangelAún no hay calificaciones
- Los Modelos Atomicos y Su HistoriaDocumento5 páginasLos Modelos Atomicos y Su HistoriaKennia Rivera GuapulemaAún no hay calificaciones
- Modelos AtomicosDocumento40 páginasModelos AtomicosPedro Miguel Palomares AtilanoAún no hay calificaciones
- Estructura Atomica El Etomo - TeoriaDocumento3 páginasEstructura Atomica El Etomo - TeoriaSilvia Esmeralda Atoche MirandaAún no hay calificaciones
- Clase 4 - U2 (Teorías Atómicas-Radiactividad)Documento24 páginasClase 4 - U2 (Teorías Atómicas-Radiactividad)Carlos SoraireAún no hay calificaciones
- Clase N°16 Teoria Atomica IV 1Documento18 páginasClase N°16 Teoria Atomica IV 1Miguel Angel Guzmán Montes de OcaAún no hay calificaciones
- Modelos AtómicosDocumento19 páginasModelos AtómicosLarissa VerásteguiAún no hay calificaciones
- Guia 7 Grado 10 QuimicaDocumento4 páginasGuia 7 Grado 10 Quimicaalexander cordobaAún no hay calificaciones
- Quimica - 4 ToDocumento5 páginasQuimica - 4 ToVictor Huerta RojasAún no hay calificaciones
- A2 S1 Funcionesyresponsabilidadesdehsi Rosas MelissaDocumento4 páginasA2 S1 Funcionesyresponsabilidadesdehsi Rosas MelissaMelissa RosasAún no hay calificaciones
- A15 S5 Rosas MelissaDocumento3 páginasA15 S5 Rosas MelissaMelissa RosasAún no hay calificaciones
- A8-S3-Investigacion de Riesgos-Lucas-RosasDocumento12 páginasA8-S3-Investigacion de Riesgos-Lucas-RosasMelissa RosasAún no hay calificaciones
- A10-Mapa de Riesgos - Rosas-MelissaDocumento2 páginasA10-Mapa de Riesgos - Rosas-MelissaMelissa RosasAún no hay calificaciones
- 2op.-A5-S2-Investigacionincumplimiento Normativo-Melissa-RosasDocumento8 páginas2op.-A5-S2-Investigacionincumplimiento Normativo-Melissa-RosasMelissa RosasAún no hay calificaciones
- A2 S2 Ejercicios Rosas MelissaDocumento3 páginasA2 S2 Ejercicios Rosas MelissaMelissa RosasAún no hay calificaciones
- A1-S1-Caso de Estudio-Melissa RosasDocumento3 páginasA1-S1-Caso de Estudio-Melissa RosasMelissa RosasAún no hay calificaciones
- 2op.-DIAGNOSTICO Y PROGRAMA CON METODOLOGIA 5'S-ROSAS-MELISSADocumento4 páginas2op.-DIAGNOSTICO Y PROGRAMA CON METODOLOGIA 5'S-ROSAS-MELISSAMelissa RosasAún no hay calificaciones
- 2op.-INVESTIGACION DE RIESGOS-ROSAS-MELISSADocumento13 páginas2op.-INVESTIGACION DE RIESGOS-ROSAS-MELISSAMelissa RosasAún no hay calificaciones
- A14-S5-Indice de Accidentabilidad-Costos de Accidentes-Rosas-Melissa PDFDocumento9 páginasA14-S5-Indice de Accidentabilidad-Costos de Accidentes-Rosas-Melissa PDFMelissa RosasAún no hay calificaciones
- Mapaconceptual Uni3 Rosas MelissaDocumento2 páginasMapaconceptual Uni3 Rosas MelissaMelissa RosasAún no hay calificaciones
- Tarea Uni2 Rosas MelissaDocumento8 páginasTarea Uni2 Rosas MelissaMelissa RosasAún no hay calificaciones
- A3 U1 Ejercicios Rosas MelissaDocumento7 páginasA3 U1 Ejercicios Rosas MelissaMelissa RosasAún no hay calificaciones
- A2-U1-Mapa Conceptual-Rosas-MelissaDocumento2 páginasA2-U1-Mapa Conceptual-Rosas-MelissaMelissa RosasAún no hay calificaciones
- A5 S5 Rosas MelissaDocumento2 páginasA5 S5 Rosas MelissaMelissa RosasAún no hay calificaciones
- Investigacion Uni4 Rosas MelissaDocumento12 páginasInvestigacion Uni4 Rosas MelissaMelissa RosasAún no hay calificaciones
- Ejercicios U3 FisicaDocumento4 páginasEjercicios U3 FisicaMelissa RosasAún no hay calificaciones
- Ejercicios Uni4 Rosas MelissaDocumento5 páginasEjercicios Uni4 Rosas MelissaMelissa RosasAún no hay calificaciones
- A3 S3 Rosas MelissaDocumento5 páginasA3 S3 Rosas MelissaMelissa RosasAún no hay calificaciones
- A2 S5 Rosas MelissaDocumento2 páginasA2 S5 Rosas MelissaMelissa RosasAún no hay calificaciones
- A1 S1 Rosas MelissaDocumento10 páginasA1 S1 Rosas MelissaMelissa RosasAún no hay calificaciones
- A1 S3 Rosas MelissaDocumento19 páginasA1 S3 Rosas MelissaMelissa RosasAún no hay calificaciones
- A1 S1 Rosas MelissaDocumento1 páginaA1 S1 Rosas MelissaMelissa RosasAún no hay calificaciones
- EXAM U2. PROB - ESTAD 2020 (9548)Documento3 páginasEXAM U2. PROB - ESTAD 2020 (9548)Melissa RosasAún no hay calificaciones
- A3 S3 Rosas MelissaDocumento23 páginasA3 S3 Rosas MelissaMelissa RosasAún no hay calificaciones
- A2 S3 Rosas MelissaDocumento6 páginasA2 S3 Rosas MelissaMelissa RosasAún no hay calificaciones
- A1 S2 Rosas MelissaDocumento5 páginasA1 S2 Rosas MelissaMelissa RosasAún no hay calificaciones
- Actividad Uno (Unidad Uno)Documento4 páginasActividad Uno (Unidad Uno)Melissa RosasAún no hay calificaciones
- A1 S3 Rosas MelissaDocumento10 páginasA1 S3 Rosas MelissaMelissa RosasAún no hay calificaciones
- Semana 7 Biologia PPT GeneticaDocumento55 páginasSemana 7 Biologia PPT Geneticahector maitaAún no hay calificaciones
- Mendez Mujer Historiografia ChilenaDocumento23 páginasMendez Mujer Historiografia ChilenaVíctor QuezadaAún no hay calificaciones
- TemaDocumento30 páginasTemaRoxana Estefania Zavala UrbinaAún no hay calificaciones
- MONOGRAFIAGUERRERODocumento63 páginasMONOGRAFIAGUERREROJudith Del Angel ZavalaAún no hay calificaciones
- Clase Psicobiologi - A Del AfectoDocumento27 páginasClase Psicobiologi - A Del AfectoArturo TorrínAún no hay calificaciones
- El Mercader de VeneciaDocumento4 páginasEl Mercader de VeneciaOscar CarrilloAún no hay calificaciones
- Que Es Un AbstractDocumento2 páginasQue Es Un Abstractjosericardo28Aún no hay calificaciones
- Secuencia Didáctica de La Sesión de AprendizajeDocumento2 páginasSecuencia Didáctica de La Sesión de AprendizajeErica Flores JimenesAún no hay calificaciones
- Técnicas Proyectivas Gráficas: Evolutiva Gráfica Mg. Ps. Lucía Puentes MatamalaDocumento82 páginasTécnicas Proyectivas Gráficas: Evolutiva Gráfica Mg. Ps. Lucía Puentes MatamalaKristenAún no hay calificaciones
- Autorregulacion - Autonomia y Autoestima - 1Documento7 páginasAutorregulacion - Autonomia y Autoestima - 1Gregorio Molina SalinasAún no hay calificaciones
- InditexDocumento13 páginasInditexliliam Camila castellanos saavedraAún no hay calificaciones
- Cómo Hacer Una Exposición EfectivaDocumento29 páginasCómo Hacer Una Exposición EfectivaDave SantoyAún no hay calificaciones
- El EmpirismoDocumento8 páginasEl EmpirismoInés Parraguez MacalopúAún no hay calificaciones
- Planilla Motricidad GruesaDocumento6 páginasPlanilla Motricidad GruesaElisa Mejuto100% (1)
- s12.s2 PPT Test CatDocumento22 páginass12.s2 PPT Test CatDiana flor Rojo churataAún no hay calificaciones
- Extracción de Eugenol A Partir de Clavo de Olor SDocumento5 páginasExtracción de Eugenol A Partir de Clavo de Olor SSOFIA AIMEE PEREIRA MARTINEZAún no hay calificaciones
- SESIÓN 04 - Parte 1 - Tórax PDFDocumento23 páginasSESIÓN 04 - Parte 1 - Tórax PDFKandhy Fiorella Mosqueira GrossoAún no hay calificaciones
- Funcion RacionalDocumento6 páginasFuncion Racionaljesica perezAún no hay calificaciones
- Rata Blanca, Volviendo A Casa - Tablatura para GuitarraDocumento5 páginasRata Blanca, Volviendo A Casa - Tablatura para GuitarraGerardo GamboaAún no hay calificaciones
- Unidad III Optimización de Redes de ActividadesDocumento7 páginasUnidad III Optimización de Redes de ActividadesJesiiAlonsitoAún no hay calificaciones
- Ejemplos de PaeDocumento18 páginasEjemplos de PaeFiorella FeierabendAún no hay calificaciones
- Revista No 12 Artículo 5Documento5 páginasRevista No 12 Artículo 5Sendero SaludAún no hay calificaciones
- Amor FraternalDocumento2 páginasAmor FraternalErick J. AriasAún no hay calificaciones
- PAT - Música en El Aula 4 - SecundariaDocumento8 páginasPAT - Música en El Aula 4 - SecundariaJhonatan ColquechambiAún no hay calificaciones
- Herrera Esquivel Karolaym - Entrega Final PDFDocumento51 páginasHerrera Esquivel Karolaym - Entrega Final PDFLuisAlbertoCachoZavaletaAún no hay calificaciones
- Fortalezas y Areas de Mejora Fichas DescriptivasDocumento3 páginasFortalezas y Areas de Mejora Fichas DescriptivasJOEL ROJAS CRUZAún no hay calificaciones
- Educación Especial en Venezuela PDFDocumento5 páginasEducación Especial en Venezuela PDFMaria GarciaAún no hay calificaciones
- Clase 3Documento52 páginasClase 3polinformaticoAún no hay calificaciones