0% encontró este documento útil (0 votos)
168 vistas13 páginasAnálisis Cualitativo de Compuestos Orgánicos
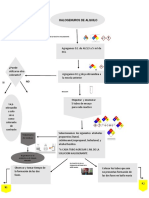
Este documento presenta los objetivos y el marco teórico de un experimento de análisis cualitativo elemental orgánico. El objetivo general es conocer pruebas sencillas de laboratorio para identificar carbono, hidrógeno, nitrógeno, azufre y halógenos. Describe métodos como la oxidación con óxido de cobre para identificar C e H, y la fusión alcalina con sodio para identificar otros elementos. El procedimiento experimental incluye pasos para realizar estas pruebas cualitativas en la sacarosa y analizar los resultados.
Cargado por
Amanda Guardia EspadaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
168 vistas13 páginasAnálisis Cualitativo de Compuestos Orgánicos
Este documento presenta los objetivos y el marco teórico de un experimento de análisis cualitativo elemental orgánico. El objetivo general es conocer pruebas sencillas de laboratorio para identificar carbono, hidrógeno, nitrógeno, azufre y halógenos. Describe métodos como la oxidación con óxido de cobre para identificar C e H, y la fusión alcalina con sodio para identificar otros elementos. El procedimiento experimental incluye pasos para realizar estas pruebas cualitativas en la sacarosa y analizar los resultados.
Cargado por
Amanda Guardia EspadaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd