Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Diferencia entre fases y solución sólida con ejemplos reales
Cargado por
David BarillasDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Diferencia entre fases y solución sólida con ejemplos reales
Cargado por
David BarillasCopyright:
Formatos disponibles
1.- ¿Cuál es la diferencia entre fases y solución solida?
Indique ejemplos
reales en su explicación.
La diferencia radica en que una solución sólida es una solución en estado
sólido de uno o más solutos en un solvente. El soluto puede incorporarse
dentro de la estructura cristalina del disolvente bien mediante sustitución,
reemplazando cada átomo del disolvente por un átomo del soluto (y formará
una solución sólida sustitucional), o bien de forma intersticial, encajándose los
átomos de soluto dentro del espacio que hay entre los átomos del disolvente.
Ambos tipos de solución sólida afectan a las propiedades del material ya que
distorsionan, aunque sea poco, la estructura cristalina y porque perturban la
homogeneidad física y eléctrica del material y cuando se agrega un soluto A a
una solución, al saturarse la solución (primera fase) aparecerá, coexistiendo
con la solución, una segunda fase; la aparición de la segunda fase coincide
con la saturación de la solución. Así, si al agregar soluto a
una solución aparece una segunda fase, es porque la solución se saturó.
Ejemplo: el acero, el bronce; y soluciones gaseosas, por ejemplo: el
aire, el humo.
2.- Explique en qué consiste el método de análisis térmico para la
construcción de diagrama de fases
El análisis térmico, o estudio de la variación de las temperaturas frente al tiempo para una determinada
velocidad de extracción de calor, permite analizar los cambios de fase que suceden en el paso de líquido
a sólido, o de sólido a sólido, por cuanto cada fase tiene una definida entalpía que la identifica. En
definitiva, un cambio de fase significa una liberación o absorción de calor de acuerdo con su entalpía
asociada. Para ganar sensibilidad en las transformaciones de fase, el análisis térmico se registra
diferencialmente con relación a un patrón que es invariante a los cambios de fase. De este modo las
variaciones registradas corresponden sólo a las investigadas por los cambios de fase.
3.- Explique la reacción perictectoide
Es la reacción de tres fases, por la que dos fases sólidas se transforman en otra sólida. Recristalización:
Proceso de formación de nuevos granos. Para que se produzca la recristalización es preciso deformar
previamente al material.
4.- Explique cuáles son las fases existentes en el diagrama Fe-C
El diagrama de fase Fe-Fe3C contiene cuatro fases sólidas; ferrita α, austenita, cementita (Fe3C), y
ferrita δ. A continuación, se presenta una descripción para cada una de estas fases. disminución de la
temperatura, hasta que éste presenta 0.008 por ciento a 0°C. Austenita.
5.- Explique las reacciones que ocurren en el diagrama Fe-C
Los puntos de fusión congruentes se producen cuando a una determinada temperatura se produce por
enfriamiento el paso de un líquido a un sólido. El término congruente es porque no existe variación en la
composición de las fases. hay tres reacciones invariantes: una reacción peritéctica (δ + L = γ ), otra
eutéctica (L = γ + Fe3C) y una eutectoide
6.- El carbono es soluble en el hierro hasta un máximo de 2% según se estudio en el diagrama Fe-C
diga entonces el tipo de solubilidad solida a la que corresponde
El carbono es soluble en el hierro hasta un máximo de 2% según se estudió en el diagrama Fe-C diga
entonces el tipo de solubilidad solida a la que corresponde.
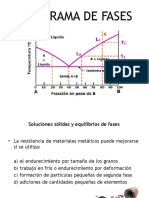
7.- Determina el % de fases y la composición química para una aleación de 45% pb a una temperatura
de 500ºC
A 500 ºC coexisten en equilibrio la fase α de composición 5 % de Pb y la fase β de composición 55 % Pb.
Porcentaje en peso de cada fase: % = 55-45 = 20% 55-5 % β= 80% 8.- Dibuje la microestructura esperada
durante el enfriamiento en equilibrio de un acero que contiene 0,8% de %C use el diagrama Fe-C.
8.- Dibuje la microestructura esperada durante el enfriamiento en equilibrio de un acero que contiene
0,8% de %C use el diagrama Fe-C
También podría gustarte
- Estrategia Competitiva en Tiempos de Cambio Caso de 5261558Documento4 páginasEstrategia Competitiva en Tiempos de Cambio Caso de 5261558Kenny Junior Mercedes RojasAún no hay calificaciones
- Actividad 3 - Identificando SistemasDocumento3 páginasActividad 3 - Identificando SistemasMercedes Meza Cabrales82% (11)
- Laboratorio 4 - MaterialesDocumento17 páginasLaboratorio 4 - MaterialesRoxana SánchezAún no hay calificaciones
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Problemas PropuestosDocumento9 páginasProblemas PropuestosElizabeth Pèrez100% (1)
- Resumen NIC 33Documento4 páginasResumen NIC 33Xiomara CardonaAún no hay calificaciones
- Panfleto #01 - El Cielo Abierto - Jose Bates 1846Documento29 páginasPanfleto #01 - El Cielo Abierto - Jose Bates 1846Jose Estuardo Ventura GutierrezAún no hay calificaciones
- Unidad 5 Diagramas de FaseDocumento27 páginasUnidad 5 Diagramas de FaseIgnacio Andres Díaz IbarraAún no hay calificaciones
- Diagrama de FaseDocumento11 páginasDiagrama de FaseAnonymous o5FX4oqBAún no hay calificaciones
- Ciencia de Materiales Practica 3.3 Grupo "A" Estudiantes: Docente: Ing. Ivan AguirreDocumento10 páginasCiencia de Materiales Practica 3.3 Grupo "A" Estudiantes: Docente: Ing. Ivan AguirreNEXUS OMGAún no hay calificaciones
- Diagramas de fases, reacciones y pruebas de durezaDocumento8 páginasDiagramas de fases, reacciones y pruebas de durezaJuan Diego Riano MurciaAún no hay calificaciones
- IMEC 1410 - Taller 12 PDFDocumento9 páginasIMEC 1410 - Taller 12 PDFJuan Andrés Sánchez OspinaAún no hay calificaciones
- Diagramas de FaseDocumento15 páginasDiagramas de FaseDiego NogalesAún no hay calificaciones
- Preguntas Examen 2011Documento21 páginasPreguntas Examen 2011MNayeli Rosas ReyesAún no hay calificaciones
- Fases de Transformaciones de Los MetalesDocumento8 páginasFases de Transformaciones de Los MetalesbryanAún no hay calificaciones
- Introducción al diagrama Fe-CDocumento37 páginasIntroducción al diagrama Fe-CRolando BobadillaAún no hay calificaciones
- Diagrama de FasesDocumento1 páginaDiagrama de FaseshunbertoAún no hay calificaciones
- Diagamas de Fase y AleacionesDocumento17 páginasDiagamas de Fase y AleacionesFrankAún no hay calificaciones
- Sesion 4Documento14 páginasSesion 4Yamix QuispeAún no hay calificaciones
- Curvas de Enfriamiento Labortorio Teoria Waldo BalarezoDocumento11 páginasCurvas de Enfriamiento Labortorio Teoria Waldo BalarezoBillyBonillaPauloAún no hay calificaciones
- Tecnología de Los Materiales Trabajo III PDFDocumento34 páginasTecnología de Los Materiales Trabajo III PDFwillianAún no hay calificaciones
- Diagrama Hierro Carbono PDFDocumento21 páginasDiagrama Hierro Carbono PDFHarold AriasAún no hay calificaciones
- Diagramas de FasesDocumento30 páginasDiagramas de FasesmonserrathAún no hay calificaciones
- CERTAMEN 3 PautaDocumento6 páginasCERTAMEN 3 PautaMichel MancillaAún no hay calificaciones
- Diagrama de FaseDocumento25 páginasDiagrama de FasegilbertoAún no hay calificaciones
- Unidad 3 Ing de MaterialesDocumento10 páginasUnidad 3 Ing de MaterialesIvan ReyesAún no hay calificaciones
- Diagrama de FasesDocumento51 páginasDiagrama de FasesXavier Andres Martínez GarciaAún no hay calificaciones
- Diagrama de FasesDocumento47 páginasDiagrama de FasesMartha RiosAún no hay calificaciones
- Tecnologia de Losmateriales 2.corte 10%Documento20 páginasTecnologia de Losmateriales 2.corte 10%Miguel MontañoAún no hay calificaciones
- Análisis Crítico Diagramas de FasesDocumento8 páginasAnálisis Crítico Diagramas de FasesEstefany Rosales MAún no hay calificaciones
- Capitulo 7 (Diagrama de Fases)Documento7 páginasCapitulo 7 (Diagrama de Fases)Connie Espinoza MarchantAún no hay calificaciones
- IntroducciónDocumento19 páginasIntroducciónYerson JunesAún no hay calificaciones
- Diagrama de FasesDocumento66 páginasDiagrama de FasesEduardo Ortiz SAún no hay calificaciones
- Digramas de FaseDocumento23 páginasDigramas de FaseJOTARUAún no hay calificaciones
- Las Derivadas y Sus AplicacionesDocumento66 páginasLas Derivadas y Sus AplicacionesPatricio Alejandro Benavides GuerraAún no hay calificaciones
- Sesion 3 (T)Documento67 páginasSesion 3 (T)LOLI LEON SHIRLEY SHANTALAún no hay calificaciones
- Diagramas de fase: Clasificación y aplicacionesDocumento27 páginasDiagramas de fase: Clasificación y aplicacionesDanniel BloomAún no hay calificaciones
- Diagrama de Fases Hierro-CarbonoDocumento57 páginasDiagrama de Fases Hierro-Carbonooscarpinzon92Aún no hay calificaciones
- Sistema EutecticoDocumento10 páginasSistema EutecticoSteeven2511Aún no hay calificaciones
- T2 - Diagramas - Equilibrio Del Hierro CarbonoDocumento12 páginasT2 - Diagramas - Equilibrio Del Hierro Carbonojose2277Aún no hay calificaciones
- Trabajo de Metalografia Diagrama Cu Ni Regla de La Palanca y Regla de Fases de GibbsDocumento16 páginasTrabajo de Metalografia Diagrama Cu Ni Regla de La Palanca y Regla de Fases de GibbsMartin MendozaAún no hay calificaciones
- Diagramas de Fase 1Documento23 páginasDiagramas de Fase 1elodulavalleAún no hay calificaciones
- Diagrama de FasesDocumento12 páginasDiagrama de FasesJason Q. CruzAún no hay calificaciones
- Sistema de Aleacion Binario EutecticoDocumento6 páginasSistema de Aleacion Binario EutecticoSergioAún no hay calificaciones
- Gibbs Aliaciones Isoformas PDFDocumento7 páginasGibbs Aliaciones Isoformas PDFAnderson Flores RiveraAún no hay calificaciones
- Equilibrio de Fases y Endurecimiento Por Solucion Sólida Cuarta SesionDocumento69 páginasEquilibrio de Fases y Endurecimiento Por Solucion Sólida Cuarta Sesionvitucho92100% (2)
- Diagrama de fases isomorfo del sistema cobre-níquelDocumento7 páginasDiagrama de fases isomorfo del sistema cobre-níquelJeremy Daniel Mendoza SegoviaAún no hay calificaciones
- Estructuras Bifásicas Formadas Al SolidificarDocumento9 páginasEstructuras Bifásicas Formadas Al Solidificarcoreano63Aún no hay calificaciones
- 3er Laboratorio de Fisicoquimica - Diagrama de FasesDocumento64 páginas3er Laboratorio de Fisicoquimica - Diagrama de FasesGhino Xavier Huertas Paico50% (2)
- Sistemas aleaciones binarias eutécticasDocumento6 páginasSistemas aleaciones binarias eutécticasMatias AriasAún no hay calificaciones
- 03 TM Met Metales Diagramas de Equilibrio Transformaciones en Estado SolidoDocumento8 páginas03 TM Met Metales Diagramas de Equilibrio Transformaciones en Estado SolidoErika BarrientosAún no hay calificaciones
- Grados libertad aleaciónDocumento9 páginasGrados libertad aleaciónArturo CollazosAún no hay calificaciones
- Manual Tema 8 Diagramas de Fase FORMATO2Documento43 páginasManual Tema 8 Diagramas de Fase FORMATO2henry erikAún no hay calificaciones
- Clasificacion Diagrama de FaseDocumento16 páginasClasificacion Diagrama de FaseMaría Jose Aranza Morales PalafoxAún no hay calificaciones
- Tratamientos Termicos para Materiales No FerrososDocumento40 páginasTratamientos Termicos para Materiales No FerrososSebastián Andrés Rojas MontielAún no hay calificaciones
- Materiales9 3y9 4Documento7 páginasMateriales9 3y9 4renato briceñoAún no hay calificaciones
- Aleaciones Eutectoides y Aleaciones HipoeutectoidesDocumento12 páginasAleaciones Eutectoides y Aleaciones HipoeutectoidesE Leonel Leonel Gonzales BarrionuevoAún no hay calificaciones
- S8 L1.en - EsDocumento35 páginasS8 L1.en - Esyeferson tamayoAún no hay calificaciones
- Cap 4. Revisado PDFDocumento25 páginasCap 4. Revisado PDFDanilo GuanoAún no hay calificaciones
- Diagramas de FaseDocumento40 páginasDiagramas de FasePaola PalaciosAún no hay calificaciones
- Trabajo Práctico N2 .OcxDocumento11 páginasTrabajo Práctico N2 .OcxJoaquín MaliziaAún no hay calificaciones
- Diagrama de FaseDocumento24 páginasDiagrama de Fasejulio gomezAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Mandala Ciencia de Los Materiales 1Documento2 páginasMandala Ciencia de Los Materiales 1David BarillasAún no hay calificaciones
- CV Jorge BarillasDocumento1 páginaCV Jorge BarillasDavid BarillasAún no hay calificaciones
- Mant. Mecánico 2004 Mod Jul-05 PDFDocumento1 páginaMant. Mecánico 2004 Mod Jul-05 PDFJose Jesus Valecillos EspinozaAún no hay calificaciones
- Cuenta Recaudadora BicentenarioDocumento1 páginaCuenta Recaudadora BicentenarioDavid BarillasAún no hay calificaciones
- Diferencia entre fases y solución sólida con ejemplos realesDocumento2 páginasDiferencia entre fases y solución sólida con ejemplos realesDavid BarillasAún no hay calificaciones
- Inv Resistencia de Los MaterialesDocumento8 páginasInv Resistencia de Los MaterialesDavid BarillasAún no hay calificaciones
- Ensayo Sobre TransmisionesDocumento2 páginasEnsayo Sobre TransmisionesDavid BarillasAún no hay calificaciones
- Presupuesto FideicomisoDocumento2 páginasPresupuesto FideicomisoDavid BarillasAún no hay calificaciones
- Rif JorgebarillasDocumento1 páginaRif JorgebarillasDavid BarillasAún no hay calificaciones
- Desarrollo de Un Prototipo DidácticoDocumento2 páginasDesarrollo de Un Prototipo DidácticoCamila Rodriguez RochaAún no hay calificaciones
- Document 3 - 3Documento2 páginasDocument 3 - 3David BarillasAún no hay calificaciones
- Calcular potencia bomba sistema hidráulicoDocumento2 páginasCalcular potencia bomba sistema hidráulicoDavid BarillasAún no hay calificaciones
- Transferencias en Dólares CoordenadasDocumento1 páginaTransferencias en Dólares CoordenadasAdrian marvalAún no hay calificaciones
- Guia PsiDocumento3 páginasGuia PsiAbel OropezaAún no hay calificaciones
- Medicion de Caudal Vena ContractaDocumento21 páginasMedicion de Caudal Vena ContractaRuben MartinezAún no hay calificaciones
- Problemario de Termodinamica Aplicada BAJO AzcapotzalcoDocumento227 páginasProblemario de Termodinamica Aplicada BAJO AzcapotzalcoEdwartRomeroVillegasAún no hay calificaciones
- PsicrometriaDocumento46 páginasPsicrometriaMiguel Jose LucenaAún no hay calificaciones
- Nueva Guía de Transmisión Poleas 2018.Documento17 páginasNueva Guía de Transmisión Poleas 2018.David BarillasAún no hay calificaciones
- Piezas sometidas a torsiónDocumento12 páginasPiezas sometidas a torsiónJoseLopezAún no hay calificaciones
- ASIG4Documento2 páginasASIG4David BarillasAún no hay calificaciones
- GuiaDocumento3 páginasGuiaDavid BarillasAún no hay calificaciones
- Mezcla de GasesDocumento14 páginasMezcla de GasesYanina PrietoAún no hay calificaciones
- Mecanismos de DeformaciónDocumento1 páginaMecanismos de DeformaciónDavid BarillasAún no hay calificaciones
- Ciclo Rankine ideal con recalentamiento en Termodinámica IIDocumento1 páginaCiclo Rankine ideal con recalentamiento en Termodinámica IIDavid BarillasAún no hay calificaciones
- Estructura cristalina de los metales determina propiedadesDocumento6 páginasEstructura cristalina de los metales determina propiedadesRoberto PortilloAún no hay calificaciones
- Asignación 1Documento2 páginasAsignación 1David BarillasAún no hay calificaciones
- 1589-Texto Del Artículo-5112-1-10-20140205 PDFDocumento11 páginas1589-Texto Del Artículo-5112-1-10-20140205 PDFJohanna LynchAún no hay calificaciones
- Iii. - Función Social y Rol o Papel DesempeñadoDocumento42 páginasIii. - Función Social y Rol o Papel DesempeñadoNicole Lewis100% (1)
- Momento IiiDocumento6 páginasMomento Iiitecnologia2403Aún no hay calificaciones
- Las Finanzas Públicas Es Un Campo de La Economía Que Se Encarga de Estudiar El Pago de Actividades Colectivas o GubernamentalesDocumento2 páginasLas Finanzas Públicas Es Un Campo de La Economía Que Se Encarga de Estudiar El Pago de Actividades Colectivas o GubernamentalesEleazarEmilioEmanuelTayMoraesAún no hay calificaciones
- Miii - 1.picao - Gpo 3 El Conflicto de 1941Documento27 páginasMiii - 1.picao - Gpo 3 El Conflicto de 1941Mayer nonalayaAún no hay calificaciones
- Creación del servicio de seguridad ciudadana en Mariscal CáceresDocumento18 páginasCreación del servicio de seguridad ciudadana en Mariscal Cáceresmanuel100Aún no hay calificaciones
- Tarea para 4to para Hacer en El CuadernoDocumento3 páginasTarea para 4to para Hacer en El CuadernoDiego TorresAún no hay calificaciones
- Platon y Los Privilegios de Los AmantesDocumento31 páginasPlaton y Los Privilegios de Los AmantesCarolina NavarroAún no hay calificaciones
- DensidadDocumento2 páginasDensidadAlba Johanna Castillo Rojas100% (1)
- EXPLICACIÓN SOBRE Las Ruinas CircularesDocumento4 páginasEXPLICACIÓN SOBRE Las Ruinas CircularesEmiliaGabrielaAún no hay calificaciones
- Practica 1 EX1026 21-22Documento26 páginasPractica 1 EX1026 21-22Fran EstellerAún no hay calificaciones
- Sistemas Actividad 1 y 2Documento3 páginasSistemas Actividad 1 y 2Harol MalagonAún no hay calificaciones
- Oración Por ConflictosDocumento3 páginasOración Por ConflictosLoengrith RosalesAún no hay calificaciones
- Fisiología (FCE UNLP) - Fisiología RenalDocumento10 páginasFisiología (FCE UNLP) - Fisiología RenalAlejandra Gricel CagliardiAún no hay calificaciones
- Proyectos de Medio AmbienteDocumento4 páginasProyectos de Medio AmbienteJessica Villagran VergaraAún no hay calificaciones
- 7.-Direccion Administrativa de La C.E.P.P.Documento102 páginas7.-Direccion Administrativa de La C.E.P.P.GUADALUPE CALDERON CONCEPCIONAún no hay calificaciones
- Trabajo de Microbiologia ProtozooaDocumento25 páginasTrabajo de Microbiologia Protozooajuan carlos aguilar diazAún no hay calificaciones
- LOS PODERES ECONOMICOS, Publicos y Privados en El Control de La Informacion PDFDocumento352 páginasLOS PODERES ECONOMICOS, Publicos y Privados en El Control de La Informacion PDFFernando ReynaAún no hay calificaciones
- Fiat TempraDocumento2 páginasFiat TempraNachi ToAún no hay calificaciones
- Estabilización de suelos con ceniza de coco 3% mejora propiedadesDocumento152 páginasEstabilización de suelos con ceniza de coco 3% mejora propiedadesErick Alexander Díaz ArruéAún no hay calificaciones
- Investigación Derecho Agrario. Alberto Manzano de La CruzDocumento7 páginasInvestigación Derecho Agrario. Alberto Manzano de La CruzChilin Yurem Manzano de la CruzAún no hay calificaciones
- Cuestionario - Evaluacion Edad MediaDocumento6 páginasCuestionario - Evaluacion Edad MediaGuerty Ibañez CancinoAún no hay calificaciones
- Urolitiasis NefrologiaDocumento56 páginasUrolitiasis NefrologiaKaroll Andrea Beltran FernandezAún no hay calificaciones
- Importancia Del AguaDocumento1 páginaImportancia Del AguaMario PeñalonzoAún no hay calificaciones
- Tema V La Educación en La Primera y Segunda República 1844-1924Documento4 páginasTema V La Educación en La Primera y Segunda República 1844-1924MarleniEspejoAún no hay calificaciones
- 2 (PG - 167 333) PDFDocumento167 páginas2 (PG - 167 333) PDFKelvin ValleAún no hay calificaciones
- Las Ventajas de Usar AutoCAD ElectricalDocumento7 páginasLas Ventajas de Usar AutoCAD ElectricalJhonatan Castillo BenitoAún no hay calificaciones