Documentos de Académico
Documentos de Profesional
Documentos de Cultura
1
Cargado por
Emmanuel Chacon Vargas0 calificaciones0% encontró este documento útil (0 votos)
43 vistas2 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
43 vistas2 páginas1
Cargado por
Emmanuel Chacon VargasCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
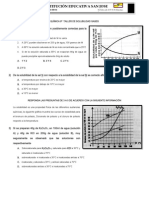
1 ¿Cómo puedes saber que una solución está sobresaturada?
Estará sobresaturada si se le ha agregado mayor cantidad de soluto que la que el
solvente puede resolver. Cuando una solución esta sobresaturada, puede verse restos de
soluto depositados debajo de la mezcla
2 ¿Cómo puede influir la agitación en la dilución de un soluto?
La agitación: La agitación disminuye el tiempo necesario para preparar una disolución,
pero no modifica la solubilidad del soluto a una determinada temperatura. De manera
análoga, sucede lo mismo con el estado de agregación de un soluto sólido.
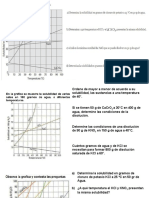
3 Determina la solubilidad en gramos de cloruro de potasio a 25°C en 50 g de agua
34g kCI x 34g KCI* 50g H2O
----------- = -------------- = ----------------------------------- = 17 g KCI
100g H2O 50g H2O 100g H2O
4 Determina a que temperatura el KCl y el KNO3 presentan la misma solubilidad.
Cuando tienen una temperatura de 23° aproximadamente
5 ¿Cuál es la máxima cantidad de NaCl que se puede disolver en 50 g de agua?
Con la solubilidad podemos saber la cantidad máxima de NaCl que podemos disolver en
100 mL de agua:
0.36 g NaCl/mL agua · 100 mL agua = 36 g NaCl
Así que, a 20 ºC sólo podremos disolver 36 gramos de NaCl en 100 mL de agua.
Por tanto, no es posible disolver 50 gramos de NaCl en 100 mL de agua a 20 ºC porque su
solubilidad es de 0.36 g NaCl/mL agua. En una disolución así preparada quedaría un
precipitado de NaCl de 14 gramos.
6 Determina la solubilidad en gramos del CaCrO4 a 50°C en 100 g de agua.
La solubilidad de la esta es aproximadamente 7g
7 Describa como prepararía una solución diluida, una saturada y una sobresaturada de KCl
a 40°C
Lo primero sería agregar a dicha mezcla entre 33y 34 g de kcl para hacer una solución
diluida, para una saturada seria entre 55 g y sobre saturada seria más de 60
8 Describa como prepararía una solución diluida, una saturada y una sobresaturada de
CaCrO4 a 60°C
debido a que esta susntacia es poco soluble no podemos llevarlo a una solución satura o
sobresaturada.
Evidencia del experimento
Según los datos obtenidos la cantidad de azúcar para dicha mezcla no fue suficientes por
eso no se puede apreciar la cristalización de este
También podría gustarte
- Mi Primer Pecera Todo lo que Necesitas Saber para Iniciarte en el Cuidado de los PecesDe EverandMi Primer Pecera Todo lo que Necesitas Saber para Iniciarte en el Cuidado de los PecesAún no hay calificaciones
- Practica 3 (Solubilidad)Documento9 páginasPractica 3 (Solubilidad)Massimo ImperatoAún no hay calificaciones
- Practica 2 SolubilidadDocumento4 páginasPractica 2 SolubilidadAxelAún no hay calificaciones
- Actividad de Aprendizaje 3Documento5 páginasActividad de Aprendizaje 3Michael AlejandroAún no hay calificaciones
- 2020-08-28 085756 oJLsoumGDEyUT3YLaOAhjg580776Documento8 páginas2020-08-28 085756 oJLsoumGDEyUT3YLaOAhjg580776Fiorella AlborAún no hay calificaciones
- Quimica Onces Guia 2solubilidad CurvaDocumento3 páginasQuimica Onces Guia 2solubilidad CurvaIngrid EspinozaAún no hay calificaciones
- Guia de Química II-2013Documento88 páginasGuia de Química II-2013Paola SalinasAún no hay calificaciones
- Ejercicios LabDocumento4 páginasEjercicios LabValeria LopezAún no hay calificaciones
- Taller de SolubilidadDocumento6 páginasTaller de Solubilidadrclugo100% (1)
- SOLUBILIDADDocumento21 páginasSOLUBILIDADDavid Enrique Ruiz LópezAún no hay calificaciones
- Temperatura en La SolubilidadDocumento5 páginasTemperatura en La SolubilidadCristina Valeria Espinoza ProvosteAún no hay calificaciones
- Ficha N°6 OA15 2° Medio QuimicaDocumento5 páginasFicha N°6 OA15 2° Medio QuimicaLiliana LisetAún no hay calificaciones
- Quimica Onces Guia 2Documento3 páginasQuimica Onces Guia 2Aaron MataAún no hay calificaciones
- Guia Taller de Souciones Quimicas 10Documento1 páginaGuia Taller de Souciones Quimicas 10Samuel EtoAún no hay calificaciones
- Informe 2Documento10 páginasInforme 2RAUL ROJAS RAMOSAún no hay calificaciones
- Curva de SolubilidadDocumento4 páginasCurva de SolubilidadLuis Alberto Blas Tongombol100% (1)
- Litros de Agua ¿Qué Disolución Se Formaría?Documento2 páginasLitros de Agua ¿Qué Disolución Se Formaría?sandraAún no hay calificaciones
- Santiago VegaDocumento12 páginasSantiago VegaDaniela MontenegroAún no hay calificaciones
- Practica 3Documento5 páginasPractica 3Euro2103Aún no hay calificaciones
- Quimica Medica Informe CompletoDocumento14 páginasQuimica Medica Informe CompletoHilary Lourdes Vargas LagunaAún no hay calificaciones
- Actividades de Cristalización y SolubilidadDocumento4 páginasActividades de Cristalización y SolubilidadBalty MéndezAún no hay calificaciones
- SolubilidadDocumento23 páginasSolubilidadDavid T Toribio ChavezAún no hay calificaciones
- Taller SolubilidadDocumento7 páginasTaller SolubilidadJhon Jaime Amaya0% (1)
- Quimica Inorganica - DisolucionesDocumento22 páginasQuimica Inorganica - DisolucionesxmarioxxAún no hay calificaciones
- TGL Ud5 DisolucionesDocumento29 páginasTGL Ud5 DisolucionesSilvia BaróAún no hay calificaciones
- Disoluciones y DilucionesDocumento25 páginasDisoluciones y DilucionesSilvia BaróAún no hay calificaciones
- CLASE-SEMANA 5 - CRISTALIZACIÓN-miercolesDocumento72 páginasCLASE-SEMANA 5 - CRISTALIZACIÓN-miercolesGerman GalvezAún no hay calificaciones
- Ejercicios Disoluciones.Documento2 páginasEjercicios Disoluciones.VILLA DOMÍNGUEZ ALEJANDRAAún no hay calificaciones
- Practica 6 Analitica AntecedentesDocumento2 páginasPractica 6 Analitica AntecedentesAbril SosaAún no hay calificaciones
- Practica N°6 Solubilidad Lab QuimicaDocumento5 páginasPractica N°6 Solubilidad Lab QuimicaJesus E. Cabezudo Calderon100% (1)
- Antep Roy EctoDocumento6 páginasAntep Roy EctoruberthAún no hay calificaciones
- Paginas 196, 197Documento7 páginasPaginas 196, 197Edilson RodriguezAún no hay calificaciones
- Laboratorio 1Documento3 páginasLaboratorio 1Mariana Cardona HenaoAún no hay calificaciones
- SolubilidadDocumento3 páginasSolubilidadSantiago Andres Puerta VelezAún no hay calificaciones
- CPU Q 2014 Clase 3 MezclasDocumento48 páginasCPU Q 2014 Clase 3 MezclasPedro Layza CandelaAún no hay calificaciones
- Las DisolucionesDocumento24 páginasLas Disolucionespepe suarezAún no hay calificaciones
- Solubilidad Informe UnmsmDocumento27 páginasSolubilidad Informe Unmsmjudith4greenAún no hay calificaciones
- Semana 5Documento8 páginasSemana 5jordanxnxAún no hay calificaciones
- Correcion CURVA DE SOLUBILIDAD - Andersson MarinDocumento2 páginasCorrecion CURVA DE SOLUBILIDAD - Andersson MarinLuisa MarquezAún no hay calificaciones
- SolubilidadDocumento4 páginasSolubilidadgarfireneAún no hay calificaciones
- Práctica II (Solubilidad de Una Sal A Distintas Concentraciones)Documento10 páginasPráctica II (Solubilidad de Una Sal A Distintas Concentraciones)Kelly RaudalesAún no hay calificaciones
- Practica 3 SolubilidadDocumento6 páginasPractica 3 SolubilidadHec ValenciaAún no hay calificaciones
- 189Documento6 páginas1891lvaro1javier1mej1a1100% (7)
- Fisicoquímica. Práct. 02Documento9 páginasFisicoquímica. Práct. 02KELLY MABEL BRICEÑO PRETELLAún no hay calificaciones
- Desarrollo QuimicaDocumento3 páginasDesarrollo QuimicaJavier TutistarAún no hay calificaciones
- Taller de Químic1Documento6 páginasTaller de Químic1Edirley EscalanteAún no hay calificaciones
- Taller Soluciones QuimicasDocumento3 páginasTaller Soluciones QuimicasJuan BertelAún no hay calificaciones
- Ejercicios 5-11 TécnicasDocumento2 páginasEjercicios 5-11 Técnicassara caro lópezAún no hay calificaciones
- Guia Quimica IIDocumento88 páginasGuia Quimica IIYenny Pau Hernández PrietoAún no hay calificaciones
- Laboratorio #01 Preparación de SolucionesDocumento7 páginasLaboratorio #01 Preparación de SolucionesJuan Rodríguez CarbonellAún no hay calificaciones
- Disoluciones - 1Documento80 páginasDisoluciones - 1DianikAún no hay calificaciones
- SolubilidadDocumento8 páginasSolubilidadJosman PriteAún no hay calificaciones
- Problemas de DisolucionesDocumento8 páginasProblemas de DisolucionesJuan David RejónAún no hay calificaciones
- Física 3º II EvaluacionDocumento17 páginasFísica 3º II EvaluacionMaye AceroAún no hay calificaciones
- Lab. Propiedades ColigativasDocumento2 páginasLab. Propiedades ColigativasMarithza Yadira Galindo LozanoAún no hay calificaciones
- Taller Quimica 11Documento14 páginasTaller Quimica 11nilsa yamile melo72% (36)
- Taller Quimica 11Documento35 páginasTaller Quimica 11nilsa yamile melo81% (16)
- Cómo Preparar Spotted Dick y Otros Pudines a Base de Sebo de ResDe EverandCómo Preparar Spotted Dick y Otros Pudines a Base de Sebo de ResAún no hay calificaciones
- Capítulo III. SeñalizaciónDocumento47 páginasCapítulo III. SeñalizaciónLuyer David Tovio PerezAún no hay calificaciones
- ConsultaDocumento5 páginasConsultaEmmanuel Chacon VargasAún no hay calificaciones
- Parcial Formulacion y eDocumento10 páginasParcial Formulacion y eEmmanuel Chacon VargasAún no hay calificaciones
- Mile MendezDocumento4 páginasMile MendezEmmanuel Chacon VargasAún no hay calificaciones
- Laboratorio de Quimica Actividad Numero 2Documento2 páginasLaboratorio de Quimica Actividad Numero 2Emmanuel Chacon VargasAún no hay calificaciones
- MODULO DE FISICA 10 RevDocumento120 páginasMODULO DE FISICA 10 RevEmmanuel Chacon Vargas100% (1)
- PROYECTO-CASA-2 (2) - Model - PDF VigasDocumento1 páginaPROYECTO-CASA-2 (2) - Model - PDF VigasEmmanuel Chacon VargasAún no hay calificaciones
- Omar 2Documento1 páginaOmar 2Emmanuel Chacon VargasAún no hay calificaciones
- PLANO 1. - Pendiente MaximaDocumento1 páginaPLANO 1. - Pendiente MaximaEmmanuel Chacon VargasAún no hay calificaciones
- Aspectos Hidrológicos de Urra 1Documento1 páginaAspectos Hidrológicos de Urra 1Emmanuel Chacon VargasAún no hay calificaciones
- Trabajo de Sanitaria 2 MedinaDocumento1 páginaTrabajo de Sanitaria 2 MedinaEmmanuel Chacon VargasAún no hay calificaciones
- Capítulo I. GeneralidadesDocumento50 páginasCapítulo I. GeneralidadesEmmanuel Chacon VargasAún no hay calificaciones
- Trabajo de Saneamiento AmbientalDocumento1 páginaTrabajo de Saneamiento AmbientalEmmanuel Chacon VargasAún no hay calificaciones
- FOR-FO-078 - Solicitud T. de G. Pasantias EMMANUEL CHACONDocumento1 páginaFOR-FO-078 - Solicitud T. de G. Pasantias EMMANUEL CHACONEmmanuel Chacon VargasAún no hay calificaciones
- ConsultaDocumento5 páginasConsultaEmmanuel Chacon VargasAún no hay calificaciones
- 1Documento2 páginas1Emmanuel Chacon VargasAún no hay calificaciones
- RUTINA DE EJERCICIOS AfinacionDocumento2 páginasRUTINA DE EJERCICIOS AfinacionEmmanuel Chacon VargasAún no hay calificaciones
- Resumen de Ejercicio Taller Tuiran SanitariaDocumento1 páginaResumen de Ejercicio Taller Tuiran SanitariaEmmanuel Chacon VargasAún no hay calificaciones
- ErickDocumento1 páginaErickEmmanuel Chacon VargasAún no hay calificaciones
- Ejercicios Distribución Normal - Estadística BásicaDocumento1 páginaEjercicios Distribución Normal - Estadística BásicaEmmanuel Chacon VargasAún no hay calificaciones
- Artefactos TecnologicoDocumento4 páginasArtefactos TecnologicoEmmanuel Chacon VargasAún no hay calificaciones
- Se Adquiere Una Máquina Financiada y Se Pacta Cancelarla en Tres Pagos de $600,000Documento2 páginasSe Adquiere Una Máquina Financiada y Se Pacta Cancelarla en Tres Pagos de $600,000Emmanuel Chacon VargasAún no hay calificaciones
- Capítulo II. Elemento Básicos de La Ingeniería de TránsitoDocumento53 páginasCapítulo II. Elemento Básicos de La Ingeniería de TránsitoDalmiro Pacheco RuizAún no hay calificaciones
- Ejercicios Preparación Parcial #1 EBX y XREG - Estadística Básica y GeneralDocumento3 páginasEjercicios Preparación Parcial #1 EBX y XREG - Estadística Básica y GeneralEmmanuel Chacon VargasAún no hay calificaciones
- Ejercicio 3 MafeDocumento3 páginasEjercicio 3 MafeEmmanuel Chacon VargasAún no hay calificaciones
- Consulta de Tipos de GraficosDocumento1 páginaConsulta de Tipos de GraficosEmmanuel Chacon VargasAún no hay calificaciones
- Guia de QuimicaDocumento16 páginasGuia de QuimicaEmmanuel Chacon VargasAún no hay calificaciones
- 250 A 300 PalabrasDocumento1 página250 A 300 PalabrasEmmanuel Chacon VargasAún no hay calificaciones
- Aplicación de La Estadística en Salud PublicaDocumento1 páginaAplicación de La Estadística en Salud PublicaEmmanuel Chacon VargasAún no hay calificaciones
- Actividad 4 y 5Documento3 páginasActividad 4 y 5Emmanuel Chacon VargasAún no hay calificaciones