Documentos de Académico
Documentos de Profesional
Documentos de Cultura
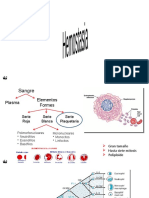
Para Leer Sistema Fribrbrbrolitico
Para Leer Sistema Fribrbrbrolitico
Cargado por
ANIBAL AUGUSTO CUBAS IPARRAGUIRREDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Para Leer Sistema Fribrbrbrolitico
Para Leer Sistema Fribrbrbrolitico
Cargado por
ANIBAL AUGUSTO CUBAS IPARRAGUIRRECopyright:
Formatos disponibles
TIPO DE ARTÍCULO
El sistema plasminógeno plasmina
Plasminogen/plasmin system
ARTÍCULO
DE REVISIÓN
Duboscq C
Servicio de Hematología y Hemoterapia, Hospital Británico de Bs As
HEMATOLOGÍA
Volumen 21 Nº Extrarodinario: 48-55
Fisiología de la hemostasia normal
cduboscq58@hotmail.com Agosto 2017
Palabras claves: plasminógeno,
plasmina,
fibrinólisis,
regulación.
Keywords: plasminogen,
plasmin,
fibrinolysis,
regulation.
El sistema plasminógeno/plasmina está formado por hibidor de fibrinólisis activado por trombina (TAFI),
una pro-enzima llamada plasminógeno la cual se que a su vez es activado por el complejo trombina/
convierte a la forma activa llamada plasmina(1,4) (Fi- trombomodulina(5). Además los componentes celu-
gura 1; Tabla 1). Existen dos activadores fisiológi- lares modulan el sistema plasminógeno-plasmina,
cos del plasminógeno: activador tisular del plasmi- con receptores de membrana como los receptores
nógeno (t-PA) y el activador del plasminógeno tipo de uroquinasa, receptores de plasminógeno o ane-
uroquinasa (u-PA) (Tabla 1). La inhibición del siste- xina 2 (Tabla 1). Actualmente se sabe que, además
ma plasminógeno/plasmina opera a tres niveles di- de su rol en la degradación de la fibrina, el sistema
ferentes: la inhibición más importante está dada por plasminógeno-plasmina cumple múltiples funciones
la antiplasmina que inhibe plasmina formando un a nivel de proteólisis pericelular, angiogénesis, im-
complejo equimolecular; el segundo nivel se com- plantación embrionaria, remodelación tisular, etc. El
pone de los inhibidores de los activadores del plas- t-PA está involucrado en la activación de la vía de
minógeno (PAIs), y por último, el tercer nivel donde degradación de fibrina, mientras que el u-PA activa
la fibrinólisis es modulada negativamente por el in- la vía que participa en la remodelación tisular.
48 HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017
TÍTULO DEL ARTÍCULO
PLASMINÓGENO
ACTIVATORES PLASMINOGENO
• t-PA INHIBIDORES
• u-PA DE LOS ACTIVATORES DE PLASNÓGENO
• FXII mediated • PAI-1
• PAI-2 (embarazo)
PLASMIN
INHIBIDORES DE PLASMINA
• α 2 - Antiplasmin
• α 2 - Macroglobulina
PROTEÓLISIS
• FibrinS
• Matrix Extracelular
• Otras proteínas
Figura 1. El sistema plasminógeno-plasmina t-PA: activador tisular del plasminógeno; u-PA: activador del
plasminógeno tipo urokinasa-; PAI: Inhibidor del activador del plasminógeno; TAFIa: inhibidor de la fibrinóli-
sis activable por trombina.
Tabla1. Componentes principales del sistema plasminógeno-plasmina
Localización/
Tamaño Nº de Concentrac Sitio Nombre longitud
Proteína Síntesis Función
kD aa plasma activo gen del gen
(kb)
Zimógeno
Plasminógeno 100-200
92 791 Hígado PLG Crom 6/52.5 kb (precursor
(PLG) mg/l
plasmina)
Proteólisis
His602, de fibrina,
Plasmina 88 715 - Asp645, matriz
Ser740 extracelular
y otras proteínas
Principal
Activador
His322, activador del
tisular 0.0005-
59 527 Endotelio Asp371, PLAT Crom 8/32.4 kb PLG sobre la
del PLG 0.01 mg/l
Ser478 superficie
(t-PA)
de fibrina
Endotelio
Principal
Activador Macrófagos
His204, activador
tipo Cél epiteliales 0.000-0.01
46 411 Asp371, PLAU Crom 11/6.4 kb del PLG sobre
uroquinasa Cél renales mg/l
Ser478 la superficie
(u-PA) Algunas
celular.
cél tumorales
HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017 49
TIPO DE ARTÍCULO
Principal
α2-antiplasmina Arg364,
50 452 Hígado 70 mg/l SERPINF2 Crom 17/16 kb inhibidor
(APL) Met365
de plasmina
Inhibidor del
Endotelio Inhibidor de
activador del 0.024 mg/l Arg346,
47 379 Cél musc. liso SERPINE1 Crom 7/12 kb t-PA y
PLG -1 (variable) Met347
Tejido adiposo u-PA
(PAI-1)
Inhibidor del Inhibidor de
activador del Placenta t-PA y
46 413 < 0.01 mg/l SERPINE2 16 kb
PLG 2 Humana u-PA
(PAI-2) en embarazo
Modulador de
Inhibidor de
fibrinólisis a
fibrinólisis
Hígado través
activable 56 423 4-15 µg/ml CPB2 Crom 13/48KB
Megacariocitos de la remoción de
por trombina
grupos lisina
(TAFI)
de la fibrina
Componentes del sistema fibrinolítico
Plasminógeno sina carboxi terminales. Estos dominios median in-
El plasminógeno es una proenzima sintetizada en el teracciones específicas con la fibrina, receptores de
hígado que circula en el plasma en concentraciones membrana y otras proteínas como la antiplasmina(4,5).
de 1-5 µmol/L. La molécula está organizada en sie- El plasminógeno es activado a plasmina por el cliva-
te dominios estructurales comprendiendo el péptido je del péptido Arg-Val en posición 560-561 por dos
pre-activador, cinco zonas homólogas de estructuras de los mayores activadores fisiológicos de plasminó-
de bucle triple llamadas kringles y el dominio pro- geno, t-PA y u-PA. Es notable que el t-PA activa al
teinasa. El kringle 1 y kringle 4 muestran sitios de plasminógeno sólo en presencia de fibrina en sus dos
alta y baja afinidad respectivamente por residuos li- isoformas, soluble o insoluble(1,2) (Figura 2).
Figura 2. Fibrinolisis intravascular
A- En ausencia de fibrina. El t-PA liberado constitutivamente por la célula endotelial es inactivado por PAI. El
complejo t-PA-PAI es removido de la circulación a través de la depuración hepática. En esta situación, las peque-
ñas cantidades de plasmina libre, no unida a fibrina, son inhibidas rápidamente por alfa 2 antiplasmina.
B- En presencia de fibrina. El t-PA y el PLG se unen a la fibrina a través de los residuos Lys presentes en la fibrina,
permitiendo la rápida conversión del PLG a plasmina. La acción de esta serinoproteasa sobre la fibrina aumenta
la exposición de residuos Lys amplificando la activación del PLG. EL TAFI activado por trombina remueve estos
residuos Lys atenuando la fibrinólisis. Finalmente, cuando el coágulo es disuelto la plasmina libre es rápidamente
inhibida por alfa 2 antiplasmina.
50 HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017
TÍTULO DEL ARTÍCULO
Plasminógeno y t-PA se enlazan a los residuos de La plasmina, la calicreína y el FXII de la coagula-
lisina en la superficie de la fibrina y el t-PA con- ción son capaces de clivar las cadenas de u-PA de
vierte plasminógeno en plasmina. Así, la fibrinólisis una sola cadena generando dos moléculas de u-PA
es amplificada por la exposición residuos de lisina diferentes: uPA de alto peso molecular y u-PA de
del C terminal de los formados por la propia plas- bajo peso molecular, cuya mayor parte está presente
mina(6,7). en orina. Ambas formas de u-PA pueden activar al
La función más importante del sistema fibrinolítico plasminógeno pero sólo la de alto peso molecular se
es degradar los depósitos de fibrina, clivando po- une al receptor de u-PA manteniendo su actividad de
límeros insolubles de fibrina en sitios específicos. u-PA. El u-PA es un activador efectivo de plasminó-
Además, la plasmina tiene otros roles fisiológicos geno con o sin presencia de fibrina. Principalmente,
múltiples como ha sido demostrado en diferentes este activador está involucrado en la migración ce-
experimentos con ratones deficientes de plasmi- lular y remodelado tisular. Finalmente, los principa-
nógeno. El ratón knockout plasminógeno -/- sufre les inhibidores de u-PA son PAI-1 y PAI-2(1,5).
trombosis espontánea, tiene depósitos de fibrina en
Inhibidores y moduladores del sistema plasminó-
los pulmones, hígado y estómago, reclutamiento
geno/plasmina
de monocitos dañados, daños en la formación de la
Inhibidores de plasmina
neoíntima después de una injuria eléctrica y muerte
La plasmina es inhibida por una familia de inhibi-
prematura(8).
dores de proteasa sérica llamada serpinas o inhi-
bidores suicidas. Los inhibidores de plasmina son
Activadores de plasminógeno
α2 antiplasmina, α2 macroglobulina e inhibidor alfa
Activador tisular de plasminógeno (t-PA)
proteasa.
El activador tisular de plasminógeno es una protea-
sa sérica que contiene cinco dominios estructurales: α2 antiplasmina
un factor de crecimiento símil epidérmico, fibro- La α2 antiplasmina es una molécula sintetizada en
nectin-like finger, dos estructuras kringle similares los hepatocitos, circula en altas concentraciones en
a los kringles del plasminógeno y un dominio de plasma (aproximadamente 1 µM) y está presente en
proteasa sérica(6). La molécula de t-PA propiamente gránulos alfa de las plaquetas. La α2 antiplasmina es
dicha tiene una vida media en circulación de apro- el principal inhibidor fisiológico de plasmina, pero
ximadamente 5 minutos y es sintetizada y secretada también inhibe quimotripsina y tripsina(1-5). La APL
por las células endoteliales en diferentes maneras de forma un complejo equimolecular con la plasmina.
acuerdo a la localización de cada célula en el propio Es interesante notar que cuando la plasmina está
endotelio. Existe un vasto número de estímulos que unida a la fibrina, la velocidad de inactivación des-
induce la liberación de t-PA desde las células endo- ciende dos órdenes de magnitud. Además, la plas-
teliales como la trombina, histamina, bradiquinina, mina unida no es inhibida por α2 macroglobulina y
adrenalina, acetilcolina, vasopresina, el ejercicio fí- el inhibidor de proteasa alfa. Los déficits congénitos
sico, la oclusión venosa y el estrés de cizallamien- o adquiridos de α2 antiplasmina están relacionados
to. El t-PA es el principal activador intravascular de a un aumento de sangrado porque la plasmina libre
plasminógeno para disolver un coágulo de fibrina y cliva fibrinógeno y otros factores de coagulación(1-5).
para mantener la homeostasis vascular(7) (Figura 2).
Inhibidores de activadores de plasminógeno
Activador de plasminógeno tipo uroquinasa Inhibidor del activador del plasminógeno-1 (PAI-1) es
El u-PA humano es sintetizado principalmente en el el principal inhibidor de t-PA y u-PA, pero también
pulmón y el riñón (células renales epiteliales) pero inhibe la trombina, plasmina y proteína C activada
también en las células endoteliales, queratinocitos más lentamente(1-5). PAI-1 a través de la inhibición
y por algunas líneas de células tumorales. Consiste de t-PA es un regulador negativo de la fibrinólisis,
en una sola cadena multi dominio de glucoproteínas que no sólo tiene un rol fibrinolítico sino que tam-
que contiene un factor de crecimiento epidermal, bién actúa en otros procesos biológicos en los cuales
a un solo K similar al plasminógeno y una triada el PAI está involucrado a través de la inhibición del
catalítica de serino proteasa(4,5). u-PA(9). El PAI-1 es principalmente secretado por
HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017 51
TIPO DE ARTÍCULO
células endoteliales, y su expresión es regulada por o embrionario. El PAI-2 también influencia la dife-
varias sustancias como citoquinas, hormonas, endo- renciación y la proliferación celular(1-5).
toxinas y factores de crecimiento. EL PAI-1 es seña-
lado como el verdadero regulador del potencial fi- Inhibidor de la fibrinólisis activable por trombi-
brinolítico en el humano, ya que el plasminógeno se na (TAFI)
encuentra en altas concentraciones(9). Las citoquinas El inhibidor de la fibrinólisis activable de trombina
pro inflamatorias, los lipopolisacáridos, el factor de (TAFI) es una carboxipeptidasa inestable formada
necrosis tumoral alfa, el factor de crecimiento fibro- por la acción de la trombina sobre su proenzima pro-
blástico, la LDL y angiotensina II son agentes que carboxipeptidasa. La proenzima TAFI es sintetizada
inducen la expresión y la secreción de PAI-1, sin en el hígado y está presente en la plaquetas(4,11). La
afectar los niveles de t-PA. Aunque el PAI se sinte- activación del TAFI realizada por trombina es acele-
tiza en forma de un inhibidor activo, se convierte en rada drásticamente por trombomodulina. TAFIa tie-
una forma inactiva estable con una vida media apa- ne una vida media de entre 8-15 minutos. El TAFI
rente de aproximadamente 2 hs a 37 C. Esta forma es un atenuante potente de la fibrinólisis, y su efecto
latente de PAI no reacciona con las proteasas diana. anti fibrinolítico se debe a su capacidad para remo-
EL PAI existe en dos pools diferentes en plasma y en ver los residuos de lisina C terminal de la superficie
plaquetas. La concentración plasmática de la forma del coágulo de fibrina. Estos residuos de lisina son
activa de PAI-1 es baja (0 a 60 ng/ml) mientras que necesarios para la unión de plasminógeno y t-PA a la
el de las plaquetas es mayor 200 a 300 ng/ml, pero red de fibrina. Otros sustratos para el TAFI incluyen
el 90% corresponde a la forma inactiva. También bradiquinina, factor de complemento C3a y C5a, y
existe una forma inactiva de PAI-1 que está unida a receptores celulares de plasminógeno(4,11).
vitronectina en la matriz extracelular(10).
En humanos numerosos estudios clínicos y epide- Receptores celulares de plasminógeno
miológicos demostraron que el PAI-1 juega un rol Existen dos tipos de receptores para PLG en las su-
central en muchos procesos patológicos como la perficies celulares: receptores de activación, los
obesidad, apoptosis, adhesión celular, migración ce- cuales se localizan en las membranas celulares y
lular, inflamación y fibrosis. PAI-1 es el mayor res- potencian la activación del plasminógeno, y recep-
ponsable de la hipofibrinólisis durante la sepsis(10). tores de limpieza, que son los responsable de elimi-
Ha sido descripto un polimorfismo genético (4G/5G) nar plasmina y activadores de plasminógeno de la
en la base -675 de la región promotora. Al comienzo circulación(12,13).
este polimorfismo fue asociado a niveles plasmá-
ticos altos de PAI pero actualmente se cree que la Receptores de plasminógeno. Son un grupo de
presencia del alelo 4G podría generar un aumento proteínas expresadas en diferentes tipos de célu-
de la transcripción de este inhibidor en respuesta a las, que comprenden a la anexina 2, α enolasa y el
las citoquinas pro inflamatorias. Hasta el momento complejo glicoproteína IIb/IIIa entre otros. La ane-
la contribución de la variante genética al riesgo de xina 2 es la que está estudiada más ampliamente.
trombosis, ya sea venosa o arterial, no ha sido esta- La anexina 2 es producida por células endoteliales,
blecida fehacientemente monocitos, macrófagos, células dendríticas, células
Algunos estudios encontraron que la homocigosis epiteliales y células tumorales. La anexina 2 acelera
para el alelo 4G puede ser un factor de riesgo inde- la activación de plasminógeno mediante t-PA alre-
pendiente para desarrollar aterosclerosis, trombosis dedor de 60 veces y presenta actividad de unión para
y enfermedad cardiovascular. ambos plasminógeno y t-PA pero no para u-PA. La
anexina 2 promueve la fibrinólisis, angiogénesis y la
Inhibidor del activador del plasminógeno-2 (PAI-2) migración celular. Ratones con deficiencia total de
Este inhibidor se está presente en la placenta hu- anexina 2 mostraron aclaramiento de trombina dis-
mana e inhibe al t-PA y a u-PA con una eficiencia minuido, deposición de fibrina en la microvascula-
similar. En humanos es indetectable y sólo aparece tura y defectos angiogénicos. A pesar de que varias
durante el embarazo. Se sugiere que el PAI-2 parti- investigaciones mostraron un rol multifacético de la
cipa en el mantenimiento del desarrollo placentario anexina 2 en la salud y enfermedad humana, existen
52 HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017
TÍTULO DEL ARTÍCULO
todavía demasiadas preguntas sobre la función y re- las tumorales, podocitos, células del túbulo renal y
gulación de este sistema(14). también en monocitos, macrófagos y células T acti-
vadas(4,5).
Receptor de activador de plasminógeno tipo uro- La principal función proteolítica del u-PAR es ace-
quinasa (uPAR) lerar la activación de plasminógeno por u-PA. El
El receptor del activador de plasminógeno tipo uro- u-PAR modula la proteólisis pericelular regulando
quinasa (uPAR) es un receptor de superficie celular la actividad del sistema plasminógeno/plasmina. La
que está involucrado en un gran número de procesos plasmina generada de esta forma va a escindir varios
fisiológicos y patológicos, tal como la proteólisis ex- componentes de la matriz extracelular.
tracelular, migración celular, adhesión, señalización La función no proteolítica del u-PAR está en rela-
y proliferación(15). El uPAR es una molécula anclada ción directa con la vitronectina, un componente
a la membrana celular por un glicosil-fosfatidil-ino- multifuncional de la matiz extracelular. El uPAR
sitol (GPI) y que tiene funciones proteolíticas y no es un receptor de adhesión para la vitronectina, una
proteolíticas(10) (Fig 3). La u-PAR tiene tres domi- molécula involucrada básicamente en la adhesión
nios (DI, DII, DIII) y una cola que se une al receptor celular. La vitronectina, además de unirse a uPA,
de membrana celular; la pérdida de alguno de estos presenta afinidad para PAI-1, sugiriendo que la vi-
dominios origina varias formas de uPA solubles y tronectina jugaría un rol clave en la activación del
ancladas con diferentes pesos moleculares y funcio- plasminógeno mediada por uPA y uPAR.
nes. La suPAR, la forma soluble más común, sólo Por otra parte, el uPAR regula los caminos de seña-
contiene los dominios DII y DIII y está presente en lización celular involucrados en la migración celular
plasma, orina y fluidos cerebroespinal. Este receptor y proteólisis extracelular(15,17). La función de señali-
está presente en células endoteliales, queratinocitos, zación y adhesión de este receptor está íntimamente
fibroblastos, megacariocitos, algunas líneas de célu- interconectada y regulada recíprocamente.
PROTEÓLISIS DE LA
MATRIX EXTRACELULAR
MMPs
Pro-MMPs
PLG-R
Figura 3. Sistema plasminógeno-plasmina sobre la superficie celular.
PLG-R : receptor de PLG, u-PA: activador del PLG tipo uroquinasa; A2: anexina 2; MMPs: metaloproteinasas
Fisiología de la lisis del coágulo
La fibrinólisis del coágulo es un proceso controlado proteólisis generalizada. Cuando la fibrina se forma,
y localizado sobre la red de fibrina evitando así la el coágulo mismo y/o la trombina que le dio origen
HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017 53
TIPO DE ARTÍCULO
estimulan a la célula endotelial a secretar t-PA. En Además la plasmina promueve la proliferación ce-
presencia de la red de fibrina el t-PA y el PLG se lular activando factores de crecimiento latentes y en
unen a través de su sitio de unión a lisina (LBS), el vaso sanguíneo ejerce una respuesta proliferativa
lo cual genera una rápida transformación del PLG a convirtiendo TGF-ß latente en su forma activa.
plasmina a través de una catálisis heterogénea. Las Se ha propuesto que la anexina 2 es la responsable
primeras moléculas de plasmina generada son inhi- de potenciar la generación de plasmina para evitar
bidas por las moléculas de APL presentes en la red, los depósitos de fibrina sobre algunos lechos vas-
dando tiempo a que el coágulo cumpla su función culares.
antes de lisarse. Cuando la cantidad de plasmina su-
pera la de APL unida a la red comienza la lisis del Hipofibrinólisis y trombosis
coágulo generando diversos fragmentos de distinto Un estado de hipofibrinólisis es generado cuando
peso molecular llamados en conjunto productos de existe una deficiencia de plasminógeno y/o niveles
degradación de la fibrina, entre los que se encuen- elevados de PAI. La deficiencia de plasminógeno
tra el fragmento llamado dímero D (D-D) que es un adquirida por disminución de la síntesis, aumento
marcador de la activación del sistema de coagula- del consumo o una combinación de ambas, ha sido
ción y el sistema fibrinolítico. La fibrina parcial- reportada en enfermedad hepática, sepsis, fiebre
mente degradada potencia, a través de la exposición hemorrágica argentina y coagulopatía intravascu-
de residuos lisina carboxi terminales, la activación lar diseminada. La deficiencia congénita de PLG se
del plasminógeno a plasmina mediada por t-PA am- clasifica en dos tipos: tipo I en que la concentración
plificando su propia lisis. Cuando toda la fibrina fue antigénica está reducida en paralelo con la activi-
lisada, la plasmina libre es rápidamente inhibida por dad y el tipo II donde hay pérdida de actividad con
la APL plasmática. Otro elemento que modula la concentración antigénica normal. Ambas deficien-
velocidad de lisis es el inhibidor de la fibrinólisis cias tienen baja prevalencia. El estudio denominado
activable por trombina (TAFI ) que, como ya se dijo, Leiden Thrombophilia Study (LETS) ha demostrado
actúa impidiendo que el PLG y el t-PA se unan a la que la hipofibrinólisis plasmática es un riesgo inde-
red porque secuestra sitios lisina. pendiente para la trombosis venosa. En este estudio
La velocidad de lisis va a depender no sólo del po- se demuestra que el riesgo de trombosis se incre-
tencial fibrinolítico sino también de la estructura de menta cuando el tiempo de lisis está por encima del
la red. Las redes formadas por fibras finas y ramifi- percentil 90 de la población sana(1). Por otro lado,
cadas son más compactas y más difíciles de lisar. La la expresión del PAI-1 y la secreción por las células
estructura de la red va a depender principalmente de endoteliales son fuertemente inducidas por un nú-
la concentración de trombina generada, de la con- mero de citoquinas inflamatorias. Una cantidad ex-
centración de fibrinógeno y del grado de entrecruza- cesiva de los niveles de PAI-1 es la anormalidad más
miento determinado por el FXIII. común que se encuentra en el sistema fibrinolítico
en estados inflamatorios. Varios estudios en huma-
Las acciones no fibrinolíticas del sistema plasmi- nos mostraron que niveles elevados de PAI-1 están
nógeno generalmente asociados con un aumento del riesgo
Cuando componentes del sistema plasminógeno/ de trombosis, aterosclerosis o enfermedad cardio-
plasmina tales como uPA, uPAR, plasminógeno y vascular y que juegan un rol crítico en la fibrosis.
receptores de plasminógeno se ensamblan sobre la
superficie celular, modulan la migración celular y Hiperfibrinólisis y hemorragia
la remodelación tisular mediante interacciones con Una pérdida, adquirida o congénita, de la actividad
la matriz extracelular. La plasmina generada en la del inhibidor de la fibrinólisis está asociado a hemo-
superficie celular convierte pro-metaloproteina- rragia porque la plasmina libre cliva al fibrinógeno y
sa a metaloproteinasa disparando la degradación otros factores de coagulación. La deficiencia adqui-
de matriz extracelular. In vitro, la plasmina puede rida de α2 antiplasmina ha sido reportada en pacien-
degradar trombospondina, laminina, fibronectina y tes con enfermedad hepática severa, coagulación
fibrinógeno. En ratones knock out para plasminó- intravascular diseminada, síndrome nefrótico y en
geno-/- se observó cicatrización alterada de heridas. cáncer de próstata.
54 HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017
TÍTULO DEL ARTÍCULO
En los pacientes con leucemia promielocítica se 11. Bouma BN, Meijers JC. New insights into fac-
produce una generación aumentada de plasmina tors affecting clot stability: A role for thrombin
sobre la superficie celular por la sobreexpresión de activatable fibrinolysis inhibitor (TAFI; plasma
anexina 2 de los blastos leucémicos. procarboxypeptidase B, plasma procarboxy-
peptidase U, procarboxypeptidase R). Semin
Bibliografia Hematol. 2004; 41(1 Suppl 1):13-9. (PMID:
1. Cesarman-Maus G, Hajjar KA. Molecular me- 14872415).
chanisms of fibrinolysis. Br J Haematol. 2005; 12. Miles LA, Parmer RJ. Plasminogen recep-
129 (3):307-21. (PMID: 15842654). tors: the first quarter century. Semin Thromb
2. Chapin JC, Hajjar KA. Fibrinolysis and the con- Hemost. 2013; 39(4):329-37. (PMID:
trol of blood coagulation. Blood Rev. 2014,16. 23532575).
(PMI: 25294122). 13. Miles LA, Plow EF, Waisman DM, Parmer
3. Kolev K, Machovich R. Molecular and cellular RJ. Plasminogen receptors. J Biomed Bio-
modulation of fibrinolysis. Thromb Haemost. technol. 2012;1-3 (PMID: 23226936).
2003; 89(4):610-21. (PMID: 12669114). 14. Luo M, Hajjar KA. Annexin A2 system in hu-
4. Schaller J, Gerber SS. The plasmin-antiplas- man biology: cell surface and beyond. Semin
min system: structural and functional aspects. Thromb Hemost. 2013; 39 (4):338-46. (PMID:
Cell Mol Life Sci. 2011; 68(5):785-801.(PMID: 25294122).
21136135). 15. Ferraris GM, Sidenius N. Urokinase plasmino-
5. Rijken DC, Lijnen HR. New insights into the gen activator receptor: a functional integrator of
molecular mechanisms of the fibrinolytic sys- extracellular proteolysis, cell adhesion, and sig-
tem. J Thromb Haemost. 2009; 7(1):4-13. nal transduction. Semin Thromb Hemost. 2013;
(PMID: 19017261). 39(4):347-55. (PMID: 23532573).
6. Hoylaerts M, Rijken DC, Lijnen HR, Collen 16. Smith HW, Marshall CJ. Regulation of cell sig-
D. Kinetics of the activation of plasminogen nalling by uPAR. Nat Rev Mol Cell Biol. 2010;
by human tissue plasminogen activator. Role 11(1):23-36. doi: 10.1038/nrm2821. (PMID:
of fibrin. J Biol Chem. 1982; 257 (6):2912-9. 20027185).
(PMID: 7199524). 17. Del Rosso M, Margheri F, Serratì S, Chillà A,
7. Zamarron C, Lijnen HR, Collen D. Kinetics of Laurenzana A, Fibbi G. The urokinase receptor
the activation of plasminogen by natural and system, a key regulator at the intersection be-
recombinant tissue-type plasminogen activa- tween inflammation, immunity, and coagula-
tor. J Biol Chem. 1984; 259(4):2080-3. (PMID: tion. Curr Pharm Des. 2011; 17(19):1924-43.
6538196). (PMID: 21711238).
8. Moons L, Shi C, Ploplis V, Plow E, Haber E,
Collen D, Carmeliet P. Reduced transplant ar-
teriosclerosis in plasminogen-deficient mice.
J Clin Invest. 1998; 102(10):1788-97. (PMID:
9819364).
9. Declerck PJ, Gils A. Three decades of research
on plasminogen activator inhibitor-1: a multi-
faceted serpin. Semin Thromb Hemost. 2013;
39(4):356-64. (PMID: 23504606).
10. Gando S. Role of fibrinolysis in sepsis. Se-
min Thromb Hemost. 2013; 39 (4):392-9
(PMID: 23446914).
HEMATOLOGÍA • Volumen 21 Nº Extraordinario • Fisiología de la hemostasia normal: 48-55, 2017 55
También podría gustarte
- 5 Leyes Biológicas de HammerDocumento7 páginas5 Leyes Biológicas de HammerCaroline SS71% (14)
- TomboliticosDocumento51 páginasTomboliticosCami Ortiz100% (1)
- TrombofiliasDocumento78 páginasTrombofiliasLyz Honorato SoledadAún no hay calificaciones
- Experimentación Con AnimalesDocumento6 páginasExperimentación Con AnimalesclaudialiagaAún no hay calificaciones
- TromobolíticosDocumento15 páginasTromobolíticosfulanotaAún no hay calificaciones
- FibrinolisisDocumento15 páginasFibrinolisisspeedy.00Aún no hay calificaciones
- Fibrinolisis y DD DR Rosa Nov 2022Documento76 páginasFibrinolisis y DD DR Rosa Nov 2022yandros666Aún no hay calificaciones
- Alteraciones de La Fibrino Ülisis. Hiperfibrino ÜlisisDocumento10 páginasAlteraciones de La Fibrino Ülisis. Hiperfibrino ÜlisisInternational Medical PublisherAún no hay calificaciones
- FibrinólisisDocumento39 páginasFibrinólisisNothing hereAún no hay calificaciones
- Mecanismo FibrinoliticoDocumento9 páginasMecanismo Fibrinoliticomafald3Aún no hay calificaciones
- FISIOLOGIA COAGULACION-tema-10Documento56 páginasFISIOLOGIA COAGULACION-tema-10Jhonny IbañezAún no hay calificaciones
- Anticoagulantes Orales y ParenteralesDocumento51 páginasAnticoagulantes Orales y ParenteralesNicolas De la CruzAún no hay calificaciones
- FibrinólisisDocumento30 páginasFibrinólisisHermas Orozco AlarconAún no hay calificaciones
- Sistema FibrinolíticoDocumento6 páginasSistema FibrinolíticoFernando Taboada Lozano100% (1)
- FibrinolisisDocumento14 páginasFibrinolisisAnny HernandezAún no hay calificaciones
- FIBRINOLISISDocumento4 páginasFIBRINOLISISFlor Ariana0% (1)
- Clase 6 (Diapositivas) - ANCADocumento39 páginasClase 6 (Diapositivas) - ANCAMaca RuizAún no hay calificaciones
- FibrinolisisDocumento32 páginasFibrinolisisJosué García Flores50% (2)
- 3 HemostasiaDocumento37 páginas3 HemostasiaTøfuAún no hay calificaciones
- 05 Fisiologia de Las Plaquetas y Factores de CoagulaciónDocumento29 páginas05 Fisiologia de Las Plaquetas y Factores de Coagulaciónjavier ochoaAún no hay calificaciones
- HEMOSTASIADocumento69 páginasHEMOSTASIAesquivelchaconmiguelygaelAún no hay calificaciones
- TROMBOLITICOSDocumento29 páginasTROMBOLITICOSfulanotaAún no hay calificaciones
- Hemostasia CLASEDocumento31 páginasHemostasia CLASEkennydi Benites GalindosAún no hay calificaciones
- TP 6 - Inhibidores de ParedDocumento46 páginasTP 6 - Inhibidores de ParedALISON ANDREA BERROCAL SALAZARAún no hay calificaciones
- HemostasiaDocumento69 páginasHemostasiaPOLIANNA PARRA GARCESAún no hay calificaciones
- Hemostasiay Coagulación IIDocumento9 páginasHemostasiay Coagulación IIYoselinfinolpalmettAún no hay calificaciones
- FibrinólisisDocumento11 páginasFibrinólisislizbeth cruz mondragonAún no hay calificaciones
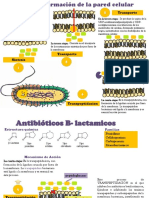
- B LactamicosDocumento4 páginasB LactamicosLiseth SC100% (1)
- 4ta Clase Hemostasia ExpDocumento30 páginas4ta Clase Hemostasia ExpJoseph BarbozaAún no hay calificaciones
- 3 - Fisiologia y Metodologías de Estudio PlaquetarioDocumento44 páginas3 - Fisiologia y Metodologías de Estudio PlaquetarioIgnacia CortezAún no hay calificaciones
- FIBRINOLISISDocumento18 páginasFIBRINOLISISTomas AguilarAún no hay calificaciones
- Inhibidores FisiológicosDocumento5 páginasInhibidores FisiológicospasqualijAún no hay calificaciones
- Examen de Orina Caso ClínicoDocumento37 páginasExamen de Orina Caso ClínicoHellen Mabel Avellaneda Valera100% (2)
- Capitulo. 37 Hemostasia y Coagulación SanguineaDocumento24 páginasCapitulo. 37 Hemostasia y Coagulación SanguineaHelmy Mendez Mejia100% (2)
- Informe Sistema Fibrinolitico (Miercoles)Documento11 páginasInforme Sistema Fibrinolitico (Miercoles)CarlosGarciaAún no hay calificaciones
- Coagulacion FisiologiaDocumento26 páginasCoagulacion FisiologiaAnggy KathyuskaAún no hay calificaciones
- 3 - Fisiologia de La Sangre - Hemostasia - 2014-IDocumento46 páginas3 - Fisiologia de La Sangre - Hemostasia - 2014-IDharyll Chancasanampa NarvaezAún no hay calificaciones
- 1era Clase - Generalidades de La Terapia Antibacteriana - AlejandraDocumento38 páginas1era Clase - Generalidades de La Terapia Antibacteriana - AlejandraLisania Millano100% (1)
- Hemostasia 5Documento40 páginasHemostasia 5Yamile PalaciosAún no hay calificaciones
- 1 AntimicrobianosDocumento24 páginas1 AntimicrobianosAngel Leal100% (4)
- Hormonas 2 Aldosterona Cortisol Catecolaminas PancreasDocumento3 páginasHormonas 2 Aldosterona Cortisol Catecolaminas PancreasgsaraibcAún no hay calificaciones
- 3 Mecanismo de La Fibrinolisis FisiologicaDocumento2 páginas3 Mecanismo de La Fibrinolisis Fisiologicaapi-3697492100% (2)
- Wuolah Free Practica PMG 1o CuatriDocumento11 páginasWuolah Free Practica PMG 1o CuatriInes Esteban ReolidAún no hay calificaciones
- C Iklo ApronDocumento3 páginasC Iklo Aprongennair50% (2)
- Bioquimica Oral PDFDocumento13 páginasBioquimica Oral PDFGabriela GregórioAún no hay calificaciones
- PLASMINOGENODocumento2 páginasPLASMINOGENOQUIMICO CLINICO WILLIANS SANCHEZAún no hay calificaciones
- CLASE N°4 Fibrinolisis IIDocumento6 páginasCLASE N°4 Fibrinolisis IIDelia Heather Molina GarridoAún no hay calificaciones
- Síndrome HemorragíparoDocumento76 páginasSíndrome HemorragíparoJENNYAún no hay calificaciones
- Clase Cardio 2 Usmp 2019 PDFDocumento47 páginasClase Cardio 2 Usmp 2019 PDFrobertoAún no hay calificaciones
- Regulacion Antitrombotica Por La FribrinolisisDocumento6 páginasRegulacion Antitrombotica Por La FribrinolisisTokita Starlliita KaulitzAún no hay calificaciones
- La Fase FibrinolíticaDocumento22 páginasLa Fase FibrinolíticaMariaGonzalezAún no hay calificaciones
- II Parcial de HematologiaDocumento36 páginasII Parcial de HematologiaNathasha AguileraAún no hay calificaciones
- Activadores Del Plasminogeno PDFDocumento7 páginasActivadores Del Plasminogeno PDFSantiago100% (1)
- HipotálamoDocumento2 páginasHipotálamoFranyer VargasAún no hay calificaciones
- Señalización de Hormonas.Documento5 páginasSeñalización de Hormonas.Leonardo GilAún no hay calificaciones
- Mecanismos de Acción Hormonal - 4 AnimacionesDocumento5 páginasMecanismos de Acción Hormonal - 4 AnimacionesHarold KnudsonAún no hay calificaciones
- 10 - Sistema de Anticoagulación - FibrinolisisDocumento9 páginas10 - Sistema de Anticoagulación - FibrinolisisguillermoAún no hay calificaciones
- 9 Apoptosis ÚltimoDocumento18 páginas9 Apoptosis ÚltimoAnthony Arteaga CogolloAún no hay calificaciones
- Endotelio VascularDocumento12 páginasEndotelio VascularAnaValentinaAún no hay calificaciones
- Imprimir Los Tiempos VerbalesDocumento5 páginasImprimir Los Tiempos VerbalesAnaValentinaAún no hay calificaciones
- Comunicación Asertiva Inteligencia Emocional y Liderazgo Pulse Aqui para Ver Los Contenidos de La Maestría InternacionalDocumento4 páginasComunicación Asertiva Inteligencia Emocional y Liderazgo Pulse Aqui para Ver Los Contenidos de La Maestría InternacionalAnaValentinaAún no hay calificaciones
- Tecnología, Empleo y Futuro Del Trabajo - McKinseyDocumento20 páginasTecnología, Empleo y Futuro Del Trabajo - McKinseyAnaValentinaAún no hay calificaciones
- Química Disoluciones PDFDocumento11 páginasQuímica Disoluciones PDFAnaValentinaAún no hay calificaciones
- Las ConvulsionesDocumento7 páginasLas Convulsionespascualjose100% (2)
- 4.donadoras y Receptoras de EmbrionesDocumento17 páginas4.donadoras y Receptoras de EmbrionesCesarEnriqueAlvaradoOjeda0% (1)
- Pai - PediatriaDocumento37 páginasPai - PediatriaMarquizael MarquesAún no hay calificaciones
- Protocolo Cirugia Segura v1.2Documento27 páginasProtocolo Cirugia Segura v1.2Carlos PabonAún no hay calificaciones
- Usos Alimentarios de La MaracuyáDocumento6 páginasUsos Alimentarios de La MaracuyáNícolas CarrascoAún no hay calificaciones
- Examen de Biología Grupo 3Documento2 páginasExamen de Biología Grupo 3Alexander ChavezAún no hay calificaciones
- Elaboracion Del YOGURT 1Documento58 páginasElaboracion Del YOGURT 1Nicky Xikitho KevinnAún no hay calificaciones
- Anatomía Vestibular CentralDocumento9 páginasAnatomía Vestibular CentralMacarena Fernanda Hernández0% (1)
- PyrogeniumDocumento3 páginasPyrogeniumLuis TellezAún no hay calificaciones
- Laboratorio de InmunologiaDocumento9 páginasLaboratorio de InmunologiaAlejandro Alba100% (1)
- Morfología y Génesis PulparDocumento10 páginasMorfología y Génesis PulparDenisse GalvánAún no hay calificaciones
- ENDODONCIADocumento9 páginasENDODONCIAAmaleet McCartneyAún no hay calificaciones
- Practicas Microbiologia.2013ok-CasaDocumento98 páginasPracticas Microbiologia.2013ok-CasaCristiam Paul AQAún no hay calificaciones
- MicrognatiaDocumento11 páginasMicrognatiaLaura BulaAún no hay calificaciones
- Introduccion 1225651767226514 9Documento45 páginasIntroduccion 1225651767226514 9Silvany Guzman100% (1)
- Glucogenosis MonografiaDocumento12 páginasGlucogenosis MonografiaPaulRamirezCribillerosAún no hay calificaciones
- Entrevista A PadresDocumento4 páginasEntrevista A PadresFabii Beatoriche Ushiromiya Ramírez100% (1)
- Genoma HumanoDocumento18 páginasGenoma HumanoKelly Medrano GaribayAún no hay calificaciones
- Introducción InmunologíaDocumento10 páginasIntroducción InmunologíaDéborah DonadelliAún no hay calificaciones
- Teorias Explicativas de La TartamudezDocumento4 páginasTeorias Explicativas de La TartamudezRodrigo Garcia OlguinAún no hay calificaciones
- Salud MentalDocumento11 páginasSalud MentalBelén Iparraguirre GarcíaAún no hay calificaciones
- Ejercicio de Visualización para Alejar El MiedoDocumento5 páginasEjercicio de Visualización para Alejar El MiedoMartha Cecilia MorenoAún no hay calificaciones
- Celula Animal y Vegetal (Tipos de Celulas) - BrisscelyDocumento2 páginasCelula Animal y Vegetal (Tipos de Celulas) - BrisscelyGian Andre Sr.Aún no hay calificaciones
- Barreras Fisicas y QuimicasDocumento36 páginasBarreras Fisicas y Quimicaselizabeth allenAún no hay calificaciones
- Yuenmedua Coxis Sistema NerviosoDocumento3 páginasYuenmedua Coxis Sistema Nerviosorolandos100% (9)
- Bisinosis y Asma OcupacionalDocumento24 páginasBisinosis y Asma OcupacionalLuis E Rivera MesonesAún no hay calificaciones
- Anatomía de La MamaDocumento26 páginasAnatomía de La MamaSebastian Hernandez Uknow100% (1)
- NeuroeducacionDocumento7 páginasNeuroeducaciongmailAún no hay calificaciones